名校
1 . 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案。
方案一(滴定法):用酸性KMnO4溶液滴定,测定铁元素的含量
(1)写出该滴定反应的离子方程式:___________ 。
(2)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管外,还需___________ (填仪器名称)。
在溶液配制过程中,下列操作会导致配制结果偏低的是___________ (填序号)。
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前内有少量蒸馏水
C.转移溶液后的烧杯、玻璃棒未洗涤
D.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(3)上述实验中KMnO4溶液需要酸化,用于酸化的酸是______(填序号)。
方案二(称量法):操作流程如下:
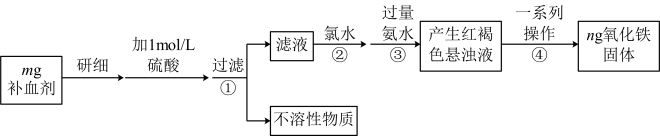
(4)步骤④一系列操作依次是:过滤、洗涤、______ 、冷却、称量。
(5)假设实验无损耗,则该补血剂含铁元素的质量分数为_____ 。(用含m、n的代数式表示)
方案一(滴定法):用酸性KMnO4溶液滴定,测定铁元素的含量
(1)写出该滴定反应的离子方程式:
(2)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管外,还需
在溶液配制过程中,下列操作会导致配制结果偏低的是
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前内有少量蒸馏水
C.转移溶液后的烧杯、玻璃棒未洗涤
D.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(3)上述实验中KMnO4溶液需要酸化,用于酸化的酸是______(填序号)。
| A.浓盐酸 | B.稀硫酸 | C.稀硝酸 | D.浓硫酸 |
方案二(称量法):操作流程如下:

(4)步骤④一系列操作依次是:过滤、洗涤、
(5)假设实验无损耗,则该补血剂含铁元素的质量分数为
您最近一年使用:0次
解题方法
2 . Ⅰ.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是( )
II.铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“钒土矿”为原料来冶炼金属铝。已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质)。为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.5 mol·L-1的NaOH溶液,得到如图所示的变化关系。请根据有关数据回答下列问题:
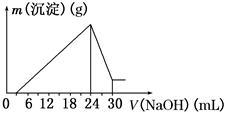
(1)写出滴加NaOH溶液0~3 mL时发生反应的离子方程式:________________ 。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为______ ,其物质的量为____________ 。
(3)该钒土矿样中Al2O3的质量分数为________ 。
(4)用10.0 t“钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上在_____ 极(填“阴”,“阳”)最多可制得金属铝________ t。
| A.该物质属于两性氢氧化物 |
| B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1 mol NaAl(OH)2CO3最多可消耗4 mol H+ |
| D.该药剂不适合于胃溃疡患者服用 |
II.铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“钒土矿”为原料来冶炼金属铝。已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质)。为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.5 mol·L-1的NaOH溶液,得到如图所示的变化关系。请根据有关数据回答下列问题:

(1)写出滴加NaOH溶液0~3 mL时发生反应的离子方程式:
(2)最后所得不溶于NaOH溶液的沉淀的化学式为
(3)该钒土矿样中Al2O3的质量分数为
(4)用10.0 t“钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上在
您最近一年使用:0次
3 . “侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。请回答下列问题:
(1)某实验小组模拟“侯氏制碱法”制得的 晶体中可能含有少量
晶体中可能含有少量 、
、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是_______ 。
(2)常温下在10mL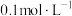
 溶液中逐滴加入
溶液中逐滴加入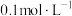
 溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液
溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液 变化的部分情况如图所示。根据图示回答下列问题:
变化的部分情况如图所示。根据图示回答下列问题:

①在同一溶液中, 、
、 、
、
_______ (填“能”或“不能”)大量共存。
②在滴加盐酸的过程中 的物质的量先增加后减少的原因是
的物质的量先增加后减少的原因是_______ ;_______ (请用离子方程式表示)。
(1)某实验小组模拟“侯氏制碱法”制得的
 晶体中可能含有少量
晶体中可能含有少量 、
、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是(2)常温下在10mL
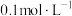
 溶液中逐滴加入
溶液中逐滴加入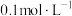
 溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液
溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液 变化的部分情况如图所示。根据图示回答下列问题:
变化的部分情况如图所示。根据图示回答下列问题:
①在同一溶液中,
 、
、 、
、
②在滴加盐酸的过程中
 的物质的量先增加后减少的原因是
的物质的量先增加后减少的原因是
您最近一年使用:0次
名校
解题方法
4 . 第ⅣA族元素R,在它的化合物R(OH)n中,其质量分数为0.778,在它的另一种化合物R(OH)m中,其质量分数为0.636.
(1)试求n和m的值:n=______ ,m=______ 。
(2)试求R的相对原子质量Ar=______ 。
(1)试求n和m的值:n=
(2)试求R的相对原子质量Ar=
您最近一年使用:0次
2024-01-12更新
|
69次组卷
|
2卷引用:海南省海口市长流中学2023-2024学年高一上学期第3次月考化学试题A卷
名校
5 . 物质的量是高中化学常用的物理量,请完成以下问题:
(1)等质量的CO和 ,物质的量之比为
,物质的量之比为__________ ;氧原子个数之比为__________ 。
(2)同温同压下,同体积的 和A气体的质量分别为1.0g和16.0g,则A的摩尔质量为
和A气体的质量分别为1.0g和16.0g,则A的摩尔质量为__________ 。
(3)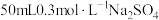 溶液和
溶液和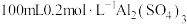 溶液混合后(混合体积变化忽略不计),溶液中
溶液混合后(混合体积变化忽略不计),溶液中 的物质的量浓度为
的物质的量浓度为__________ 。
(4)加热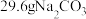 和
和 的混合物至质量不再变化,产生
的混合物至质量不再变化,产生 (标准状况下)1.12L(假设气体全部选出),试计算:混合物中
(标准状况下)1.12L(假设气体全部选出),试计算:混合物中 和
和 的物质的量之比为
的物质的量之比为__________ 。
(5)将18g铁铝合金投入足量NaOH溶液中,完全反应后生成2.24L氢气(标准状况),计算此铁铝合金中铝的质量分数。(假设合金中其他成分不与NaOH反应)__________ 。
(1)等质量的CO和
 ,物质的量之比为
,物质的量之比为(2)同温同压下,同体积的
 和A气体的质量分别为1.0g和16.0g,则A的摩尔质量为
和A气体的质量分别为1.0g和16.0g,则A的摩尔质量为(3)
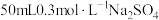 溶液和
溶液和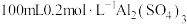 溶液混合后(混合体积变化忽略不计),溶液中
溶液混合后(混合体积变化忽略不计),溶液中 的物质的量浓度为
的物质的量浓度为(4)加热
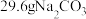 和
和 的混合物至质量不再变化,产生
的混合物至质量不再变化,产生 (标准状况下)1.12L(假设气体全部选出),试计算:混合物中
(标准状况下)1.12L(假设气体全部选出),试计算:混合物中 和
和 的物质的量之比为
的物质的量之比为(5)将18g铁铝合金投入足量NaOH溶液中,完全反应后生成2.24L氢气(标准状况),计算此铁铝合金中铝的质量分数。(假设合金中其他成分不与NaOH反应)
您最近一年使用:0次
6 . 某实验小组用6%的氯化钠溶液(密度约为1.04g/cm3)配制50g质量分数为3%的氯化钠溶液,步骤如下:①计算;②量取;③混匀;④装瓶贴标签。回答下列问题:
(1)计算需要6%的氯化钠溶液的体积是_______ mL(结果取整数);
(2)实验中用到的仪器有25mL的量筒、细口瓶、烧杯、_______ ;
(3)下列实验操作会导致所配溶液中溶质的质量分数一定偏大的是_______。
(1)计算需要6%的氯化钠溶液的体积是
(2)实验中用到的仪器有25mL的量筒、细口瓶、烧杯、
(3)下列实验操作会导致所配溶液中溶质的质量分数一定偏大的是_______。
A.量取 的氯化钠溶液时仰视读数 的氯化钠溶液时仰视读数 |
| B.向烧杯内加入水时有液体溅出 |
| C.混匀过程中没有使用玻璃棒搅拌 |
| D.配制好的溶液装入未干燥的细口瓶 |
您最近一年使用:0次
解题方法
7 .  和
和 是两种常见的钠盐。
是两种常见的钠盐。
(1)用洁净的铂丝蘸取
 溶液置于酒精灯火焰上灼烧,火焰呈
溶液置于酒精灯火焰上灼烧,火焰呈(2)等质量的
 和
和 分别与足量的盐酸反应,在相同条件下产生
分别与足量的盐酸反应,在相同条件下产生 的体积
的体积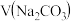
 填“大于”,“小于”或“等于”
填“大于”,“小于”或“等于” 。
。(3)若加热
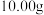 的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了
的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了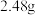 ,则原混合物中碳酸钠的质量分数为
,则原混合物中碳酸钠的质量分数为(4)实验室中需
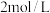 的
的 溶液
溶液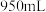 ,配制时应选用容量瓶的规格和称取
,配制时应选用容量瓶的规格和称取 的质量分别是
的质量分别是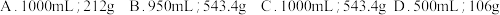
需要的玻璃仪器有容量瓶、玻璃棒、烧杯、量筒,还缺少的玻璃仪器有 填写仪器名称
填写仪器名称 ,若出现如下情况,其中将引起所配溶液浓度偏高的是
,若出现如下情况,其中将引起所配溶液浓度偏高的是 填下列编号
填下列编号 。
。
A.容量瓶实验前用蒸馏水洗干净,但未烘干
B.定容观察液面时俯视
C.未冷却至室温就开始定容
D.加蒸馏水时不慎超过了刻度
您最近一年使用:0次
2022-12-09更新
|
51次组卷
|
2卷引用:海南省海南枫叶国际学校2021-2022学年高三上学期第三次月考(1月)化学试题
8 . 将KI、NaBr、NaCl、K2S、(NH4)2SO3的溶液及氯水和碘水放入一烧杯中,若反应完毕后氯有剩余,则溶液中含量最大的离子是___________ ,一定不存在的离子是___________ 。
您最近一年使用:0次
9 . 氧化还原反应是一类重要的反应,在工农业生产、实验室、日常生活中都有广泛的用途。
(1)实验室用 和浓盐酸制氯气的反应为
和浓盐酸制氯气的反应为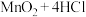 (浓)
(浓)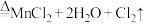
其中还原剂是_____ (填化学式,下同),氧化产物是_____ 。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有 的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为
的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为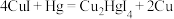
产物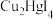 中
中 元素化合价是
元素化合价是_____ 价,上述反应的氧化剂为_____ (填化学式)。
(3)过氧化氢( )俗名双氧水,医疗上可作外科消毒剂。
)俗名双氧水,医疗上可作外科消毒剂。
①双氧水能与酸化的高锰酸钾溶液发生反应: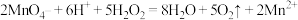 此时双氧水表现出
此时双氧水表现出_____ 性。
②将双氧水加入到 溶液中,溶液出现黄色沉淀(生成了
溶液中,溶液出现黄色沉淀(生成了 单质),该反应的化学方程式为
单质),该反应的化学方程式为_____ 。
(1)实验室用
 和浓盐酸制氯气的反应为
和浓盐酸制氯气的反应为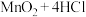 (浓)
(浓)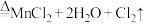
其中还原剂是
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有
 的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为
的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为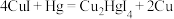
产物
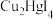 中
中 元素化合价是
元素化合价是(3)过氧化氢(
 )俗名双氧水,医疗上可作外科消毒剂。
)俗名双氧水,医疗上可作外科消毒剂。①双氧水能与酸化的高锰酸钾溶液发生反应:
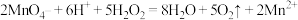 此时双氧水表现出
此时双氧水表现出②将双氧水加入到
 溶液中,溶液出现黄色沉淀(生成了
溶液中,溶液出现黄色沉淀(生成了 单质),该反应的化学方程式为
单质),该反应的化学方程式为
您最近一年使用:0次
名校
10 . 自然界中的铀和钴都有同位素。铀主要以三种同位素的形式存在,三种同位素的原子百分含量分别为 U 0.005%、
U 0.005%、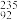 U 0.72%、
U 0.72%、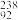 U 99.275%。请写出计算U元素近似相对原子质量的计算式
U 99.275%。请写出计算U元素近似相对原子质量的计算式___________ 。(不必算出具体数值)。
 U 0.005%、
U 0.005%、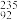 U 0.72%、
U 0.72%、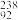 U 99.275%。请写出计算U元素近似相对原子质量的计算式
U 99.275%。请写出计算U元素近似相对原子质量的计算式
您最近一年使用:0次



