名校
1 . I.很多酸碱盐在学校的实验室中非常常见。请回答下列问题:
(1)现有下列12种物质:①空气;②H2O;③Mg;④CaO;⑤H2SO4;⑥Ca(OH)2;⑦CuSO4•5H20;⑧碘酒;⑨CH3CH2OH;⑩NaHCO3;⑪淀粉溶液;⑫盐酸。上述物质中不是电解质但是可以导电的是_______ 。
II.回答下列问题:
(2)老师在实验室制备Fe(OH)3胶体时的化学方程式为________ 。已知由AgNO3溶液和稍过量的KI溶液制得的AgI胶体,当它跟Fe(OH)3胶体相混合时,能析出AgI和Fe(OH)3的混合沉淀,可知AgI胶粒带________ 电荷(填“正”、“负”或者“不带”)。
III.某学校实验室从化学试剂商店买回的密度是1.84g•cm-3,质量分数为98%浓硫酸。现用该浓硫酸配制480mL0.2mol•L-1的稀硫酸。可供选用的仪器有:①托盘天平;②烧瓶;③烧杯;④药匙;⑤量筒;⑥玻璃棒。
(3)配制稀硫酸时,还缺少的仪器有_______ (写仪器名称)。配制稀硫酸需要用量筒量取上述浓硫酸的体积为_______ mL,量取硫酸时应选用_______ (填选项)规格的量筒。
A.10mL B.50mL C.100mL D.200mL
(4)用下列方法配制相应的溶液,所配制的溶液物质的量浓度或质量分数偏高的是_______ 。
①用1g98%的浓硫酸加4g水配成19.6%的硫酸溶液
②配制一定物质的量浓度的硫酸溶液时,定容,塞好塞子倒转摇匀后,发现液面低于刻度线
③10%的硫酸溶液和90%的硫酸溶液等体积混合配制50%的硫酸溶液
④向80mL水中加入18.4mol/L浓硫酸20mL,配制3.68mol/L的硫酸溶液
(1)现有下列12种物质:①空气;②H2O;③Mg;④CaO;⑤H2SO4;⑥Ca(OH)2;⑦CuSO4•5H20;⑧碘酒;⑨CH3CH2OH;⑩NaHCO3;⑪淀粉溶液;⑫盐酸。上述物质中不是电解质但是可以导电的是
II.回答下列问题:
(2)老师在实验室制备Fe(OH)3胶体时的化学方程式为
III.某学校实验室从化学试剂商店买回的密度是1.84g•cm-3,质量分数为98%浓硫酸。现用该浓硫酸配制480mL0.2mol•L-1的稀硫酸。可供选用的仪器有:①托盘天平;②烧瓶;③烧杯;④药匙;⑤量筒;⑥玻璃棒。
(3)配制稀硫酸时,还缺少的仪器有
A.10mL B.50mL C.100mL D.200mL
(4)用下列方法配制相应的溶液,所配制的溶液物质的量浓度或质量分数偏高的是
①用1g98%的浓硫酸加4g水配成19.6%的硫酸溶液
②配制一定物质的量浓度的硫酸溶液时,定容,塞好塞子倒转摇匀后,发现液面低于刻度线
③10%的硫酸溶液和90%的硫酸溶液等体积混合配制50%的硫酸溶液
④向80mL水中加入18.4mol/L浓硫酸20mL,配制3.68mol/L的硫酸溶液
| A.①③ | B.②③ | C.③④ | D.②④ |
您最近一年使用:0次
名校
2 . 回答下列问题
(1)①含0.4 mol K+的K2SO4中所含的 的物质的量是
的物质的量是_______ 。
②标准状况下9.03×1023个CH4所占的体积为_________ ,它与标准状况下 _______ L H2S含有相同数目的氢原子。
(2)①48 g RO 中,核外电子总数比质子总数多6.02×1023个,则R元素的摩尔质量为
中,核外电子总数比质子总数多6.02×1023个,则R元素的摩尔质量为_______ 。
②有一真空瓶的质量为M1 g,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为_______ 。
(3)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为________ ;(保留3位有效数字)
②所得溶液中Cl-的物质的量为_______ mol。
(4)标准状况下,将V L HCl溶解在1 L水中(水的密度近似为1g/cm3),所得溶液的密度为ρ g/cm3,物质的量浓度为c mol/L,则c=_______ 。(用含V、ρ的式子表示)
(1)①含0.4 mol K+的K2SO4中所含的
 的物质的量是
的物质的量是②标准状况下9.03×1023个CH4所占的体积为
(2)①48 g RO
 中,核外电子总数比质子总数多6.02×1023个,则R元素的摩尔质量为
中,核外电子总数比质子总数多6.02×1023个,则R元素的摩尔质量为②有一真空瓶的质量为M1 g,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为
(3)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为
②所得溶液中Cl-的物质的量为
(4)标准状况下,将V L HCl溶解在1 L水中(水的密度近似为1g/cm3),所得溶液的密度为ρ g/cm3,物质的量浓度为c mol/L,则c=
您最近一年使用:0次
名校
解题方法
3 . 小铭所在的化学兴趣小组需要配制1.84 mol·L-1的稀硫酸480 mL,回答下列问题:
(1)需要质量分数为98%,密度为1.84 g·cm-3的浓硫酸_______ mL。
(2)配制时,必须使用的仪器有_______ (填序号),还缺少的仪器是_______ 。
①烧杯②50 mL量筒③100 mL量筒④1 000 mL容量瓶⑤500 mL容量瓶⑥托盘天平(带砝码) ⑦玻璃棒
(3)配制时的操作的顺序是_______ (填字母,下同)。
A.冷却 B.量取 C.洗涤两次 D.定容 E.稀释 F.摇匀 G.转移
(4)下列操作中,容量瓶所不具备的功能有_______。
(5)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”或“不影响”)。
①用量筒量取浓硫酸时,仰视读数:_______ 。
②转移后,没有洗涤烧杯和玻璃棒:_______ 。
③定容时,俯视读数:_______ 。
④定容时,添加蒸馏水超过刻度线后,吸出多余的溶液:_______ 。
(1)需要质量分数为98%,密度为1.84 g·cm-3的浓硫酸
(2)配制时,必须使用的仪器有
①烧杯②50 mL量筒③100 mL量筒④1 000 mL容量瓶⑤500 mL容量瓶⑥托盘天平(带砝码) ⑦玻璃棒
(3)配制时的操作的顺序是
A.冷却 B.量取 C.洗涤两次 D.定容 E.稀释 F.摇匀 G.转移
(4)下列操作中,容量瓶所不具备的功能有_______。
| A.配制一定体积准确浓度的标准溶液 | B.长期贮存溶液 |
| C.用来加热溶解固体溶质 | D.作为反应容器 |
①用量筒量取浓硫酸时,仰视读数:
②转移后,没有洗涤烧杯和玻璃棒:
③定容时,俯视读数:
④定容时,添加蒸馏水超过刻度线后,吸出多余的溶液:
您最近一年使用:0次
2022-12-12更新
|
119次组卷
|
2卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期开学检测化学试题
名校
4 . 完成下列问题。
(1)①含0.4 mol K+的K2SO4中所含的 的物质的量是
的物质的量是_______ 。
②2.3 g金属钠中含电子的物质的量为_______ mol,在跟足量水反应中失去电子的物质的量为_______ mol。
(2)①48 g RO 中,核外电子总数比质子总数多6.02×1023个,则R元素的摩尔质量为
中,核外电子总数比质子总数多6.02×1023个,则R元素的摩尔质量为_______ 。
②有一真空瓶的质量为M1 g,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为_______ 。
(3)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为_______ ;
②所得溶液中Cl-的物质的量为_______ mol。
(4)在下列物质中:Na2CO3、稀盐酸、 CaO、CO2、Fe。
①属于混合物的是_______ ;
②属于电解质的是_______ ;
③属于非电解质的是_______ ;
④稀盐酸和CaO反应的离子方程式_______ ;
(5)酸性KMnO4溶液氧化FeCl2溶液,请将该反应的离子方程式补充完整并配平:_______ 。
 +Fe2++______=Mn2++Fe3++_______
+Fe2++______=Mn2++Fe3++_______
(1)①含0.4 mol K+的K2SO4中所含的
 的物质的量是
的物质的量是②2.3 g金属钠中含电子的物质的量为
(2)①48 g RO
 中,核外电子总数比质子总数多6.02×1023个,则R元素的摩尔质量为
中,核外电子总数比质子总数多6.02×1023个,则R元素的摩尔质量为②有一真空瓶的质量为M1 g,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为
(3)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为
②所得溶液中Cl-的物质的量为
(4)在下列物质中:Na2CO3、稀盐酸、 CaO、CO2、Fe。
①属于混合物的是
②属于电解质的是
③属于非电解质的是
④稀盐酸和CaO反应的离子方程式
(5)酸性KMnO4溶液氧化FeCl2溶液,请将该反应的离子方程式补充完整并配平:
 +Fe2++______=Mn2++Fe3++_______
+Fe2++______=Mn2++Fe3++_______
您最近一年使用:0次
名校
5 . 高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
)是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 ,
,

(1)除了用二氧化锰和浓盐酸反应外,实验室可以用氯酸钾和浓盐酸反应制取氯气,反应方程式如下: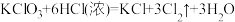 。
。
①浓盐酸在反应中显示出来的性质是___________ 。
②若产生标况下 ,则被氧化的HCl的物质的量为
,则被氧化的HCl的物质的量为___________ mol。
③如果要将装置B补充完整,除需用导管外,试剂瓶中还应装的除杂试剂为___________ 。
(2)C中得到紫色固体和溶液。C中 发生的反应有
发生的反应有 。另外还有
。另外还有______ 。(用离子方程式表示)
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是___________ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为2%,则生产1000kg该溶液需消耗氯气的质量为___________ kg(保留整数)。
 )是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
)是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 ,
,
(1)除了用二氧化锰和浓盐酸反应外,实验室可以用氯酸钾和浓盐酸反应制取氯气,反应方程式如下:
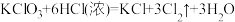 。
。①浓盐酸在反应中显示出来的性质是
②若产生标况下
 ,则被氧化的HCl的物质的量为
,则被氧化的HCl的物质的量为③如果要将装置B补充完整,除需用导管外,试剂瓶中还应装的除杂试剂为
(2)C中得到紫色固体和溶液。C中
 发生的反应有
发生的反应有 。另外还有
。另外还有(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
名校
解题方法
6 . 某小组模拟工业制漂白粉,设计了如图所示的实验装置。

已知:①氯气和碱反应放出热量;②温度高时, 。
。
请回答下列问题:
(1)a装置名称_______ 圆底烧瓶内发生反应的化学方程式为_______ ;装置乙中饱和食盐水的作用是_______ ,若没有乙装置会有什么影响_______ (用离子方程式描述)。
(2)丙装置发生的反应方程式为_______ 漂白粉在空气中失效的原因是_______ 、_______ (用化学方程式表示)。
(3)该小组制得的漂白粉中CaCl2的量远大于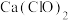 的量,其主要原因是
的量,其主要原因是_______ ;为提高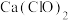 的含量,可采取的措施是
的含量,可采取的措施是_______ (任写一种即可)。

已知:①氯气和碱反应放出热量;②温度高时,
 。
。请回答下列问题:
(1)a装置名称
(2)丙装置发生的反应方程式为
(3)该小组制得的漂白粉中CaCl2的量远大于
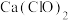 的量,其主要原因是
的量,其主要原因是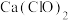 的含量,可采取的措施是
的含量,可采取的措施是
您最近一年使用:0次
7 . I.用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)经计算需要_______ mL浓盐酸,在量取时宜选用下列量筒中的_______ (填字母)。
A.5 mL量筒 B.10 mL量筒 C.25 mL量筒 D.50 mL量筒
II.明胶是水溶性蛋白质混合物,溶于水形成胶体。
(2)明胶的水溶液和 溶液共同具备的性质是
溶液共同具备的性质是_______ (填字母)。
a.都不稳定,密封放置沉淀 b.丁达尔效应 c.分散质粒子可通过滤纸
(3)已知胶体的分散质微粒不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的_______ (填字母)。


III.某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5 (直径≤2.5μm的悬浮颗粒物,已知1μm=1×10-6 m),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、 NOx等进行研究具有重要意义。请回答下列问题:
(4)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为_______ (填 “酸”或“碱”)性。
(5)煤燃烧排放的烟气含有SO2和NOx形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式_______ 。
______ +_______NO+______=______Cl-+_______
+_______NO+______=______Cl-+_______ +_______。
+_______。
(6)洗涤含SO2的烟气,以下物质可作洗涤剂的是_______ (填字母)。
a.Ca(OH)2 b.CaCl2 c. Na2CO3 d. NaHSO3
(7)汽车燃油不完全燃烧时产生CO,目前在汽车尾气系统中装置催化转化器,可将CO和NO转化为两种无污染的气体,其化学反应方程式为_______ 。
(1)经计算需要
A.5 mL量筒 B.10 mL量筒 C.25 mL量筒 D.50 mL量筒
II.明胶是水溶性蛋白质混合物,溶于水形成胶体。
(2)明胶的水溶液和
 溶液共同具备的性质是
溶液共同具备的性质是a.都不稳定,密封放置沉淀 b.丁达尔效应 c.分散质粒子可通过滤纸
(3)已知胶体的分散质微粒不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的


III.某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5 (直径≤2.5μm的悬浮颗粒物,已知1μm=1×10-6 m),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、 NOx等进行研究具有重要意义。请回答下列问题:
(4)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ |  |  |  | Cl- |
| 浓度/mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为
(5)煤燃烧排放的烟气含有SO2和NOx形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式
______
 +_______NO+______=______Cl-+_______
+_______NO+______=______Cl-+_______ +_______。
+_______。(6)洗涤含SO2的烟气,以下物质可作洗涤剂的是
a.Ca(OH)2 b.CaCl2 c. Na2CO3 d. NaHSO3
(7)汽车燃油不完全燃烧时产生CO,目前在汽车尾气系统中装置催化转化器,可将CO和NO转化为两种无污染的气体,其化学反应方程式为
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题
(1)下列有关物质分类或归类正确的是_______ 。
①碱性氧化物:


②氯水、盐酸、氨水均为混合物
③铜绿、纯碱、硫酸钡、碳酸氢钠均属于盐类
④碘酒、牛奶、豆浆均为胶体
(2)①实验室现需要配制 硫酸溶液,需用质量分数为
硫酸溶液,需用质量分数为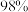 、密度为
、密度为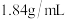 的浓硫酸
的浓硫酸_______  。
。
②实验使用仪器有:玻璃棒、量筒、烧杯、还有_______ 。
③下列操作使所配溶液浓度有何变化(填“偏高”“偏低”或“无影响”)。
A.转移硫酸后,小烧杯未洗涤,_______ ;
B.量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中,_______ ;
C.定容时俯视容量瓶刻度线,_______ ;
D.配制前容量瓶内留有少量蒸馏水,_______ 。
(1)下列有关物质分类或归类正确的是
①碱性氧化物:



②氯水、盐酸、氨水均为混合物
③铜绿、纯碱、硫酸钡、碳酸氢钠均属于盐类
④碘酒、牛奶、豆浆均为胶体
(2)①实验室现需要配制
 硫酸溶液,需用质量分数为
硫酸溶液,需用质量分数为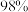 、密度为
、密度为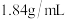 的浓硫酸
的浓硫酸 。
。②实验使用仪器有:玻璃棒、量筒、烧杯、还有
③下列操作使所配溶液浓度有何变化(填“偏高”“偏低”或“无影响”)。
A.转移硫酸后,小烧杯未洗涤,
B.量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中,
C.定容时俯视容量瓶刻度线,
D.配制前容量瓶内留有少量蒸馏水,
您最近一年使用:0次
名校
9 . 回答下列问题:
Ⅰ:在标准状况下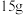
 与
与 的混合气体,体积为
的混合气体,体积为 。则:
。则:
(1)混合气体的平均摩尔质量是___________ 。
(2) 和
和 的体积之比是
的体积之比是___________ 。
(3) 和
和 的质量之比是
的质量之比是___________ 。
Ⅱ:将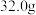
 固体溶于水配成
固体溶于水配成 溶液,其密度为
溶液,其密度为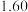
 ,试计算:
,试计算:
(4)该溶液中 的物质的量浓度为
的物质的量浓度为___________ 。
(5)该溶液中 的质量分数为
的质量分数为___________ 。
(6)从该溶液中取出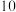
 ,含
,含 的质量为
的质量为___________ 。
(7)将取出的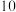
 溶液加水稀释到
溶液加水稀释到
 ,稀释后溶液中
,稀释后溶液中 的物质的量浓度为
的物质的量浓度为___________ 。
Ⅰ:在标准状况下
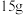
 与
与 的混合气体,体积为
的混合气体,体积为 。则:
。则:(1)混合气体的平均摩尔质量是
(2)
 和
和 的体积之比是
的体积之比是(3)
 和
和 的质量之比是
的质量之比是Ⅱ:将
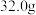
 固体溶于水配成
固体溶于水配成 溶液,其密度为
溶液,其密度为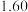
 ,试计算:
,试计算:(4)该溶液中
 的物质的量浓度为
的物质的量浓度为(5)该溶液中
 的质量分数为
的质量分数为(6)从该溶液中取出
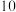
 ,含
,含 的质量为
的质量为(7)将取出的
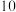
 溶液加水稀释到
溶液加水稀释到
 ,稀释后溶液中
,稀释后溶液中 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
2021-09-19更新
|
213次组卷
|
2卷引用:宁夏长庆高级中学 2021-2022学年高三上学期第一次月考化学试题
名校
10 . I.按要求填写下列空白:
(1)烷烃的通式_______ 。
(2)官能团-COOH的名称_______ 。
(3)乙烯分子的结构简式_______ 。
(4)已知常温常压下烃A的密度是氢气密度的15倍,且已知该烃中碳的质量分数为80%,则烃A的化学式为_______ 。
II.选用合理的试剂除去下列试剂中的杂质(用化学方程式表示 )。
(1)除去FeCl3溶液中的少量FeCl2:_______ 。
(2)除去Mg(OH)2中的少量Al(OH)3:_______ 。
(1)烷烃的通式
(2)官能团-COOH的名称
(3)乙烯分子的结构简式
(4)已知常温常压下烃A的密度是氢气密度的15倍,且已知该烃中碳的质量分数为80%,则烃A的化学式为
II.选用合理的试剂除去下列试剂中的杂质(
(1)除去FeCl3溶液中的少量FeCl2:
(2)除去Mg(OH)2中的少量Al(OH)3:
您最近一年使用:0次



