名校
1 . Ca(ClO)2、NaClO、FeCl3、Al2O3、Fe2O3、Mn2O7等都是重要的化合物。回答下列问题:
(1)属于酸性氧化物的是______ (填化学式),其相应的钾盐具有_____ (填“强氧化性”或“强还原性”),FeSO4溶液能使该钾盐的酸性溶液褪色,其原因为________ (用离子方程式解释)。
(2)属于“84"消毒液成分的是______ (填化学式),其在空气中易变质,产物之一为碳酸氢钠,写出发生该反应的离子方程式:_______ 。
(3)用覆铜板制作印刷电路板的原理是_______ (用离子方程式表示),检验“腐蚀液”中有无Fe3+的试剂为______ (填化学式)。
(4)将氯气通入冷的_____ (填物质名称)中可制得以Ca(ClO)2为有效成分的漂白粉,该过程中转移2mol电子时,消耗氧化剂与还原剂的质量之比为________ 。
(1)属于酸性氧化物的是
(2)属于“84"消毒液成分的是
(3)用覆铜板制作印刷电路板的原理是
(4)将氯气通入冷的
您最近一年使用:0次
名校
解题方法
2 . NaOH是重要的化工原料,研究其制备、贮存检验及应用具有重要意义。
(1)已知:I.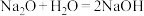 ,II.
,II.  。
。
①上述反应中属于氧化还原反应的是_______ (填编号)。
②用双线桥表示上述氧化还原反应:_______ 。
③指出其中的氧化剂是_______ ,氧化产物是_______ 。
(2)向饱和Na2CO3中通入足量CO2的化学方程式:_______ 。
(3)NaOH在保存过程中易变质生成Na2CO3,请写出发生变质的化学方程式:_______ 。
(4)若一定质量的NaOH在变质前后分别与足量的稀硝酸反应,则消耗HNO3的质量_______ (填“变质前多”“变质后多”或“一样多”)。
(1)已知:I.
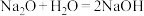 ,II.
,II.  。
。①上述反应中属于氧化还原反应的是
②用双线桥表示上述氧化还原反应:
③指出其中的氧化剂是
(2)向饱和Na2CO3中通入足量CO2的化学方程式:
(3)NaOH在保存过程中易变质生成Na2CO3,请写出发生变质的化学方程式:
(4)若一定质量的NaOH在变质前后分别与足量的稀硝酸反应,则消耗HNO3的质量
您最近一年使用:0次
3 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,应用广泛。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是_____ (填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:____ 。
②每生成1mol 转移
转移_____ mol电子;若反应过程中转移了0.3mol电子,则还原产物的物质的量为____ mol。
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-,2Fe2++Cl2=2Fe3++2Cl-
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是_____ 。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br-被氧化一半时,c为_____ (用含a、b的代数式表示)。
(3)已知: 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2 →2I-+
→2I-+ ,
, +2I-→2
+2I-→2 +I2,则
+I2,则 、
、 、I2氧化性强弱顺序为:
、I2氧化性强弱顺序为:____ 。
(4)已知溶液中:还原性 >I-,氧化性
>I-,氧化性 >I2>
>I2> ;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。

写出a点处还原产物是________ ;b点到c点反应的离子方程式________
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:
②每生成1mol
 转移
转移Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-,2Fe2++Cl2=2Fe3++2Cl-
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br-被氧化一半时,c为
(3)已知:
 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2 →2I-+
→2I-+ ,
, +2I-→2
+2I-→2 +I2,则
+I2,则 、
、 、I2氧化性强弱顺序为:
、I2氧化性强弱顺序为:(4)已知溶液中:还原性
 >I-,氧化性
>I-,氧化性 >I2>
>I2> ;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
写出a点处还原产物是
您最近一年使用:0次



