解题方法
1 . NaOH是重要的化工原料,研究其制备、贮存、检验及应用具有重要意义。
(1)已知:Ⅰ.Na2O+H2O=2NaOH,Ⅱ.2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
①上述反应中属于氧化还原反应的是___ (填编号)。
②工业上制取NaOH不用反应Ⅰ而用反应Ⅱ的原因是___ 。
(2)NaOH在保存程中易变质生成Na2CO3,请写出发生变质的化学方程式:___ 。
(3)探究NaOH样品是否发生变质。
①若NaOH样品已变质,请设计实验方案证明:___ 。
②一定质量的NaOH在变质前后分别与足量的稀硝酸反应,消耗HNO3的质量___ (填“变质前多”“变质后多”或“一样多”)。
(1)已知:Ⅰ.Na2O+H2O=2NaOH,Ⅱ.2NaCl+2H2O
 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。①上述反应中属于氧化还原反应的是
②工业上制取NaOH不用反应Ⅰ而用反应Ⅱ的原因是
(2)NaOH在保存程中易变质生成Na2CO3,请写出发生变质的化学方程式:
(3)探究NaOH样品是否发生变质。
①若NaOH样品已变质,请设计实验方案证明:
②一定质量的NaOH在变质前后分别与足量的稀硝酸反应,消耗HNO3的质量
您最近一年使用:0次
解题方法
2 . 过量排放含氮化合物对大气和水体造成环境污染,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
(1)水体中过量氨氮(以 表示)会导致水体富营养化。次氯酸钠去除氨氮的反应历程可以表示如下:
表示)会导致水体富营养化。次氯酸钠去除氨氮的反应历程可以表示如下:
I.
II.
III.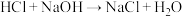
①写出用次氯酸钠去除氨氮的总反应的化学方程式:_____ 。
②从该反应历程并结合 的性质分析,温度过高时氨氮的去除率降低的主要原因是
的性质分析,温度过高时氨氮的去除率降低的主要原因是_____ 。
(2)用零价铁( )可以去除水体中的
)可以去除水体中的 以修复环境。在用
以修复环境。在用 去除水体中的
去除水体中的 时,
时,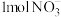 转化成
转化成 时转移
时转移____  电子。
电子。
(3)实验室模拟测定大气中 的含量,将含有
的含量,将含有 的气体样品
的气体样品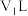 通入适量酸化的
通入适量酸化的 溶液中,使
溶液中,使 恰好完全被氧化为
恰好完全被氧化为 ,加水稀释至
,加水稀释至 ,向其中加入
,向其中加入 溶液时恰好完全反应。
溶液时恰好完全反应。
①加入 溶液时发生反应的离子方程式是
溶液时发生反应的离子方程式是_______ 。
②气体样品中 折合成
折合成 的含量为
的含量为_______  (用含
(用含 、
、 、c的代数式表示)。若
、c的代数式表示)。若 溶液部分变质,会使测定结果
溶液部分变质,会使测定结果_______ (填“偏高”“偏低”或“无影响”)。
(1)水体中过量氨氮(以
 表示)会导致水体富营养化。次氯酸钠去除氨氮的反应历程可以表示如下:
表示)会导致水体富营养化。次氯酸钠去除氨氮的反应历程可以表示如下:I.

II.

III.
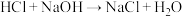
①写出用次氯酸钠去除氨氮的总反应的化学方程式:
②从该反应历程并结合
 的性质分析,温度过高时氨氮的去除率降低的主要原因是
的性质分析,温度过高时氨氮的去除率降低的主要原因是(2)用零价铁(
 )可以去除水体中的
)可以去除水体中的 以修复环境。在用
以修复环境。在用 去除水体中的
去除水体中的 时,
时,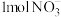 转化成
转化成 时转移
时转移 电子。
电子。(3)实验室模拟测定大气中
 的含量,将含有
的含量,将含有 的气体样品
的气体样品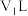 通入适量酸化的
通入适量酸化的 溶液中,使
溶液中,使 恰好完全被氧化为
恰好完全被氧化为 ,加水稀释至
,加水稀释至 ,向其中加入
,向其中加入 溶液时恰好完全反应。
溶液时恰好完全反应。①加入
 溶液时发生反应的离子方程式是
溶液时发生反应的离子方程式是②气体样品中
 折合成
折合成 的含量为
的含量为 (用含
(用含 、
、 、c的代数式表示)。若
、c的代数式表示)。若 溶液部分变质,会使测定结果
溶液部分变质,会使测定结果
您最近一年使用:0次
解题方法
3 . (1)0.3molNH3分子中所含原子数与___________ 个H2O分子中所含原子数相等。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有______________ (填“氧化性”或“还原性”);
(3)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为_________ 。
(4)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子:
a. 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,
取滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是_________ ,
b. 原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________ 。
A.Cl- B.NO3- C.CO32- D.OH-
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有
(3)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为
(4)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子:
a. 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,
取滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是
b. 原溶液中可能大量存在的阴离子是下列A-D中的(填序号)
A.Cl- B.NO3- C.CO32- D.OH-
您最近一年使用:0次
解题方法
4 . 焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,葡萄酒中常加入Na2S2O5,能防止酒中的一些成分被氧化,起到保质作用。
(1)制备:饱和Na2CO3溶液充分吸收SO2后,得到NaHSO3溶液,当溶液中NaHSO3含量达到过饱和时,就会脱水析出Na2S2O5。
①为了减少产品Na2S2O5中的杂质含量,理论上需控制Na2CO3与SO2的物质的量之比为________ 。
②写出NaHSO3脱水制备Na2S2O5的化学方程式:________ 。
(2)性质探究:
①向Na2S2O5溶液中滴加稀硫酸,产生使品红溶液褪色的气体,该反应的离子方程式为________ 。
②向Na2S2O5溶液中滴加氯水,则氧化产物为________ (填离子符号),设计检验该氧化产物的实验方案:________ 。
(3)含量测定:
某兴趣小组对葡萄酒中Na2S2O5的残留量进行测定,设计如下方案:取400mL葡萄酒样品酸化后加热,产生气体经H2O2溶液充分吸收,然后除去过量H2O2后,用NaOH溶液中和至吸收液呈中性,此时共消耗0.08mol•L-1NaOH溶液25.00mL。
①H2O2溶液吸收气体发生反应的离子方程式为________ 。
②除去过量H2O2的方法是加入试剂________ (填化学式)后振荡至无气体产生。
③该葡萄酒中Na2S2O5的残留量为________ g•L-1(以SO2计)。
(1)制备:饱和Na2CO3溶液充分吸收SO2后,得到NaHSO3溶液,当溶液中NaHSO3含量达到过饱和时,就会脱水析出Na2S2O5。
①为了减少产品Na2S2O5中的杂质含量,理论上需控制Na2CO3与SO2的物质的量之比为
②写出NaHSO3脱水制备Na2S2O5的化学方程式:
(2)性质探究:
①向Na2S2O5溶液中滴加稀硫酸,产生使品红溶液褪色的气体,该反应的离子方程式为
②向Na2S2O5溶液中滴加氯水,则氧化产物为
(3)含量测定:
某兴趣小组对葡萄酒中Na2S2O5的残留量进行测定,设计如下方案:取400mL葡萄酒样品酸化后加热,产生气体经H2O2溶液充分吸收,然后除去过量H2O2后,用NaOH溶液中和至吸收液呈中性,此时共消耗0.08mol•L-1NaOH溶液25.00mL。
①H2O2溶液吸收气体发生反应的离子方程式为
②除去过量H2O2的方法是加入试剂
③该葡萄酒中Na2S2O5的残留量为
您最近一年使用:0次
名校
5 . Ⅰ.实验室可由软锰矿(主要成分为 )制备
)制备 ,方法如下:软锰矿和过量的固体KOH和
,方法如下:软锰矿和过量的固体KOH和 在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,
在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后, 转变为
转变为 和
和 ;滤去
;滤去 沉淀,浓缩溶液,结晶得到深紫色的针状
沉淀,浓缩溶液,结晶得到深紫色的针状 。试回答:
。试回答:
(1)软锰矿制备 的化学方程式是
的化学方程式是_______ ;
(2) 制备
制备 的离子方程式是
的离子方程式是_______ ;
(3) 能与热的经硫酸酸化的
能与热的经硫酸酸化的 反应,生成
反应,生成 和
和 等产物,该反应的化学方程式是
等产物,该反应的化学方程式是_______ 。
Ⅱ.是一种重要的无机功能材料,粗的提纯是工业生产的重要环节。某研究性学习小组设计了将粗(含有较多的MnO和 )样品转化为纯实验,其流程如下:
)样品转化为纯实验,其流程如下:

(4)第①步加稀 时,粗
时,粗 样品中的
样品中的_______ (写化学式)转化为可溶性物质。
(5)完成第②步反应的离子方程式并配平:_______
 _______+
_______+ _______=
_______=

 _______。(“1”也要填写在
_______。(“1”也要填写在 内)
内)
 )制备
)制备 ,方法如下:软锰矿和过量的固体KOH和
,方法如下:软锰矿和过量的固体KOH和 在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,
在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后, 转变为
转变为 和
和 ;滤去
;滤去 沉淀,浓缩溶液,结晶得到深紫色的针状
沉淀,浓缩溶液,结晶得到深紫色的针状 。试回答:
。试回答:(1)软锰矿制备
 的化学方程式是
的化学方程式是(2)
 制备
制备 的离子方程式是
的离子方程式是(3)
 能与热的经硫酸酸化的
能与热的经硫酸酸化的 反应,生成
反应,生成 和
和 等产物,该反应的化学方程式是
等产物,该反应的化学方程式是Ⅱ.是一种重要的无机功能材料,粗的提纯是工业生产的重要环节。某研究性学习小组设计了将粗(含有较多的MnO和
 )样品转化为纯实验,其流程如下:
)样品转化为纯实验,其流程如下:
(4)第①步加稀
 时,粗
时,粗 样品中的
样品中的(5)完成第②步反应的离子方程式并配平:
 _______+
_______+ _______=
_______=

 _______。(“1”也要填写在
_______。(“1”也要填写在 内)
内)
您最近一年使用:0次
名校
6 . “7•20”特大洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效措施之一。“84”消毒液、漂白粉和ClO2等都是有效的消杀试剂。
(1)用化学方程式表示氯气与烧碱溶液制备“84”消毒液的原理____ ,标况下56L氯气完全被吸收,需要____ L1mol/L的NaOH溶液。
(2)使用漂白粉漂白,只需取适量漂白粉溶于水即可,漂白原理用化学方程式表示为_____ 。
(3)漂白粉的保存要注意密封,为了判断一份儿久置的漂白粉是①没有失效②部分失效③完全失效。某化学兴趣小组设计实验进行验证。
已知:Ca(ClO)2溶液呈碱性;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;Ca(ClO)2+2HCl(稀)=CaCl2+2HClO
a.甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。由此,判断结论为①,你是否同意他的结论____ (填“同意”或“不同意”),若不同意,你认为的结论是____ (若同意,此空不用填)
A.② B.③ C.①或② D.①②③均有可能
b.乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊;他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。据此你得出的结论是_____ (从①②③中选填)。
(4)目前普遍使用ClO2代替Cl2及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。其摩尔质量为_____ 。ClO2还可以将剧毒的NaCN转化为无毒物质除去,产物是氯化钠和两种常见气体。试写出该反应的化学方程式_____ 。
(1)用化学方程式表示氯气与烧碱溶液制备“84”消毒液的原理
(2)使用漂白粉漂白,只需取适量漂白粉溶于水即可,漂白原理用化学方程式表示为
(3)漂白粉的保存要注意密封,为了判断一份儿久置的漂白粉是①没有失效②部分失效③完全失效。某化学兴趣小组设计实验进行验证。
已知:Ca(ClO)2溶液呈碱性;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;Ca(ClO)2+2HCl(稀)=CaCl2+2HClO
a.甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。由此,判断结论为①,你是否同意他的结论
A.② B.③ C.①或② D.①②③均有可能
b.乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊;他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。据此你得出的结论是
(4)目前普遍使用ClO2代替Cl2及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。其摩尔质量为
您最近一年使用:0次
7 . 二氧化氯( )在工业上可用于淀粉及油脂的漂白及自来水的消毒。回答下列问题:
)在工业上可用于淀粉及油脂的漂白及自来水的消毒。回答下列问题:
(1)制备二氧化氯:
方法1:60℃时,用潮湿的 与草酸(
与草酸( )反应制取
)反应制取 。
。
方法2:亚氯酸钠( )和稀盐酸反应,反应原理为
)和稀盐酸反应,反应原理为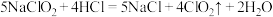 。
。
①方法1中制得的 中混有的气态杂质主要为
中混有的气态杂质主要为_____ (写分子式)。
②方法2中氧化产物和还原产物物质的量之比为______ 。
(2)利用 进行自来水消毒时,需要监测水中
进行自来水消毒时,需要监测水中 的含量,其步骤为:
的含量,其步骤为:
步骤1:量取自来水10.0mL,准确配制100mL检测液,量取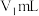 检测液于碘量瓶(
检测液于碘量瓶( )中。
)中。
步骤2:调节试样呈弱酸性,加入足量的KI,立即盖紧碘量瓶的塞子并在塞子周围加入少量水,将碘量瓶置于黑暗处静置片刻。
步骤3:加入几滴淀粉溶液于碘量瓶中,用 的
的 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液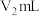 (发生的化学反应方程式:
(发生的化学反应方程式: )。
)。
①制100mL检测液,除了量筒外,还需要_____ (填字母)。
A.普通漏斗B.胶头滴管C.100mL容量瓶D.分液漏斗
②使用碘量瓶代替锥形瓶的目的是_______ (写出一点即可)。
③步骤2中发生反应的离子方程式为_______ 。
④该自来水样品中 的质量浓度为
的质量浓度为_____  (质量浓度
(质量浓度 )。
)。
 )在工业上可用于淀粉及油脂的漂白及自来水的消毒。回答下列问题:
)在工业上可用于淀粉及油脂的漂白及自来水的消毒。回答下列问题:(1)制备二氧化氯:
方法1:60℃时,用潮湿的
 与草酸(
与草酸( )反应制取
)反应制取 。
。方法2:亚氯酸钠(
 )和稀盐酸反应,反应原理为
)和稀盐酸反应,反应原理为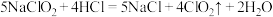 。
。①方法1中制得的
 中混有的气态杂质主要为
中混有的气态杂质主要为②方法2中氧化产物和还原产物物质的量之比为
(2)利用
 进行自来水消毒时,需要监测水中
进行自来水消毒时,需要监测水中 的含量,其步骤为:
的含量,其步骤为:步骤1:量取自来水10.0mL,准确配制100mL检测液,量取
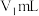 检测液于碘量瓶(
检测液于碘量瓶( )中。
)中。步骤2:调节试样呈弱酸性,加入足量的KI,立即盖紧碘量瓶的塞子并在塞子周围加入少量水,将碘量瓶置于黑暗处静置片刻。
步骤3:加入几滴淀粉溶液于碘量瓶中,用
 的
的 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液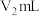 (发生的化学反应方程式:
(发生的化学反应方程式: )。
)。①制100mL检测液,除了量筒外,还需要
A.普通漏斗B.胶头滴管C.100mL容量瓶D.分液漏斗
②使用碘量瓶代替锥形瓶的目的是
③步骤2中发生反应的离子方程式为
④该自来水样品中
 的质量浓度为
的质量浓度为 (质量浓度
(质量浓度 )。
)。
您最近一年使用:0次
名校
解题方法
8 . 某化学小组在实验室制取Na2O2。 查阅资料可知,温度在573~673 K之间可生成Na2O2,若温度提高到733 K以上Na2O2会分解。除Li外其他碱金属不与N2反应。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为______ 。
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是_____ 。水槽中量筒中收集到的气体为_____ 。测定装置的接口从左至右正确的连接顺序是_____ 。
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果____ (填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案I中发生反应的化学方程式为_______ 。 根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是______ 。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液,加入少量MnO2粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液后先变红后褪色 |
您最近一年使用:0次
2020-09-11更新
|
783次组卷
|
10卷引用:河南省顶级名校2023届高三上学期10月月考化学试题
河南省顶级名校2023届高三上学期10月月考化学试题山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题山西省运城市景胜中学2020-2021学年高一10月月考化学试题河北省邢台市2022届高三9月第二次联合考试化学试题河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷山东省济南市商河县第三中学2022届高三10月月考化学试题2021年河北省高考化学试卷变式题10-18题广西贺州市昭平中学2021-2022学年高二下学期第一次月考化学试题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第1讲 钠及其重要化合物
9 . 氮族元素包括氮(N),磷(P),砷(As),锑(Sb)和铋(Bi)五种元素,它们位于元素周期表第15纵列,研究氮族元素单质及其化合物的性质对于生产生活具有重要意义。请回答下列问题:
(1)亚硝酸钠( )是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。
)是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。
①亚硝酸钠会与人体中的血红蛋白作用,将二价铁氧化为三价铁,从而使血红蛋白丧失输送氧气的能力而使人体中毒;一旦发生亚硝酸盐中毒,可立即注射美蓝溶液进行解毒治疗,试推断美蓝溶液具有______ (填“氧化”或“还原”)性。
②亚硝酸钠外观极像食盐,工业上检验食盐中是否混有亚硝酸钠的方法是:取样品,加淀粉碘化钾溶液,酸化后溶液______ (描述现象),说明样品中含有亚硝酸钠。
(2)饮用水中的 对人类健康会产生危害,为降低
对人类健康会产生危害,为降低 的浓度,某饮用水研究人员提出用铝粉将
的浓度,某饮用水研究人员提出用铝粉将 还原为
还原为 ,其化学方程式为
,其化学方程式为 。用“双线桥法”表示反应中电子转移的方向和数目:
。用“双线桥法”表示反应中电子转移的方向和数目:________ 。
(3)次磷酸( )是一种精细磷化工产品,具有较强还原性,它可将溶液中的
)是一种精细磷化工产品,具有较强还原性,它可将溶液中的 还原为银单质,因而可用于化学镀银。在利用
还原为银单质,因而可用于化学镀银。在利用 进行化学镀银反应中,还原剂与氧化剂的物质的量之比为1:4,则氧化产物为
进行化学镀银反应中,还原剂与氧化剂的物质的量之比为1:4,则氧化产物为____ (填化学式)。
(4)工业上常将含砷废渣(主要成分为 ,其中硫元素显-2价)制成浆状,通入
,其中硫元素显-2价)制成浆状,通入 氧化,生成
氧化,生成 和单质硫,写出发生反应的化学方程式
和单质硫,写出发生反应的化学方程式_______ 。
(5)已知由 、
、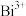 、
、 、
、 、
、 、
、 组成的一个氧化还原反应体系中,发生了
组成的一个氧化还原反应体系中,发生了 的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:
的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:___ +____ +___ 
___ +____ +___  。
。
(1)亚硝酸钠(
 )是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。
)是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质。①亚硝酸钠会与人体中的血红蛋白作用,将二价铁氧化为三价铁,从而使血红蛋白丧失输送氧气的能力而使人体中毒;一旦发生亚硝酸盐中毒,可立即注射美蓝溶液进行解毒治疗,试推断美蓝溶液具有
②亚硝酸钠外观极像食盐,工业上检验食盐中是否混有亚硝酸钠的方法是:取样品,加淀粉碘化钾溶液,酸化后溶液
(2)饮用水中的
 对人类健康会产生危害,为降低
对人类健康会产生危害,为降低 的浓度,某饮用水研究人员提出用铝粉将
的浓度,某饮用水研究人员提出用铝粉将 还原为
还原为 ,其化学方程式为
,其化学方程式为 。用“双线桥法”表示反应中电子转移的方向和数目:
。用“双线桥法”表示反应中电子转移的方向和数目:(3)次磷酸(
 )是一种精细磷化工产品,具有较强还原性,它可将溶液中的
)是一种精细磷化工产品,具有较强还原性,它可将溶液中的 还原为银单质,因而可用于化学镀银。在利用
还原为银单质,因而可用于化学镀银。在利用 进行化学镀银反应中,还原剂与氧化剂的物质的量之比为1:4,则氧化产物为
进行化学镀银反应中,还原剂与氧化剂的物质的量之比为1:4,则氧化产物为(4)工业上常将含砷废渣(主要成分为
 ,其中硫元素显-2价)制成浆状,通入
,其中硫元素显-2价)制成浆状,通入 氧化,生成
氧化,生成 和单质硫,写出发生反应的化学方程式
和单质硫,写出发生反应的化学方程式(5)已知由
 、
、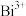 、
、 、
、 、
、 、
、 组成的一个氧化还原反应体系中,发生了
组成的一个氧化还原反应体系中,发生了 的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:
的反应过程。将以上物质分别填入下面对应的横线上,组成一个配平的化学方程式:
 。
。
您最近一年使用:0次
10 . 有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以 Fe3+离子的形式存在,则样品①的质量为_________g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量 (设为ag)范围是________。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3⁻三种离子中的一种离子的物质的量的变化曲线如下图所示,则该曲线表示的是________物质的量变化的曲线,请你在此图中再画出另外两种离子的物质的量的变化曲线。

(1)甲取样品①,反应后的溶液中铁只以 Fe3+离子的形式存在,则样品①的质量为_________g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量 (设为ag)范围是________。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3⁻三种离子中的一种离子的物质的量的变化曲线如下图所示,则该曲线表示的是________物质的量变化的曲线,请你在此图中再画出另外两种离子的物质的量的变化曲线。

您最近一年使用:0次



