1 . 已知A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物略去)。请回答下列问题:

(1)若A为常见的非金属单质,常温下为固体,B、C、D均为气体.A与C的反应需要在高温下进行,若单质A对应元素的一种核素中子数为6,则该核素的质量数为__ 。
(2)若D为用量最大,用途最广泛的金属单质,它的一种氧化物为红棕色固体,可用作颜料A是一种黄绿色气体,则C的化学式为__ ,为了验证C溶液是否变质,可向溶液中加入__ 。B的溶液与Cu反应的离子方程式为__ 。
Ⅲ.若A、B、C的溶液均显碱性,C常用于焙制糕点的发酵粉的主要成分之一,也可以作为抗酸药剂。则:
(3)B的俗名为___ ,A与C反应生成B的离子方程式为___ 。
(4)若将21.2gB溶于水用容量瓶配成250mL溶液,B的物质的量浓度为__ ;若配制溶液时仰视容量瓶刻度线,会使所配制的溶液浓度产生怎样的误差__ (填:偏高、偏低、无影响)。

(1)若A为常见的非金属单质,常温下为固体,B、C、D均为气体.A与C的反应需要在高温下进行,若单质A对应元素的一种核素中子数为6,则该核素的质量数为
(2)若D为用量最大,用途最广泛的金属单质,它的一种氧化物为红棕色固体,可用作颜料A是一种黄绿色气体,则C的化学式为
Ⅲ.若A、B、C的溶液均显碱性,C常用于焙制糕点的发酵粉的主要成分之一,也可以作为抗酸药剂。则:
(3)B的俗名为
(4)若将21.2gB溶于水用容量瓶配成250mL溶液,B的物质的量浓度为
您最近一年使用:0次
名校
2 . I.化学学科作为一门基础自然科学,为推动人类文明和社会进步做出了重要贡献,作为中学生要学好它,需要大家准确掌握化学基本概念和研究方法。
(1)下列是某同学对中学常见的物质进行分类的列表:
上表中某一组分类中有一处错误,请指出其错误的物质_______ (填化学式);已知 在空气易被氧化变质,请结合教材中有关
在空气易被氧化变质,请结合教材中有关 的性质,请写出它与
的性质,请写出它与 反应的化学方程式
反应的化学方程式_______ 。
(2)胶体是一类重要的分散系,它和溶液的本质区别是_______ ,实验室中制备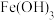 胶体的化学反应方程式为
胶体的化学反应方程式为_______ 。
(3)高铁酸钾( )是一种新型、高效、多功能绿色水处理剂,比
)是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,且无二次污染,工业上是向热的氢氧化铁浓碱性悬浮液中通入氯气,先制得高铁酸钠溶液,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,且无二次污染,工业上是向热的氢氧化铁浓碱性悬浮液中通入氯气,先制得高铁酸钠溶液,然后在低温下,向高铁酸钠溶液中加入 至饱和就可以析出高铁酸钾晶体。制备高铁酸钠(
至饱和就可以析出高铁酸钾晶体。制备高铁酸钠(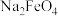 )的反应体系中有六种数粒:
)的反应体系中有六种数粒: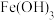 、
、 、
、 、
、 、
、 、
、 。
。
①写出并配平制高铁酸钠的离子反应方程式:_______ 。
②每生成 转移
转移_______  电子,若反应过程中转移了
电子,若反应过程中转移了 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为_______  。
。
Ⅱ.已知还原性: ,氧化性:
,氧化性:
(4)请写出向 溶液中滴加少量
溶液中滴加少量 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为_______ 。
(5)在 溶液中滴加过量
溶液中滴加过量 溶液,待反应完全后,推测溶液中的还原产物为
溶液,待反应完全后,推测溶液中的还原产物为_______ (填化学式)。
(6)向含 的溶液中逐滴加入
的溶液中逐滴加入 溶液。加入
溶液。加入 物质的量和析出
物质的量和析出 单质的物质的量的关系曲线如下图所示,写出反应过程中与
单质的物质的量的关系曲线如下图所示,写出反应过程中与 段曲线对应的离子方程式
段曲线对应的离子方程式_______ ;当溶液中 与
与 的物质的量之比为
的物质的量之比为 时,加入的
时,加入的 为
为_______  。
。

(1)下列是某同学对中学常见的物质进行分类的列表:
| 强电解质 | 弱电解质 | 盐 | 酸性氧化物 | 碱性氧化物 | |
| 第一组 |  |  |  |  |  |
| 第二组 |  |  |  |  |  |
| 第三组 |  | 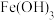 |  |  |  |
上表中某一组分类中有一处错误,请指出其错误的物质
 在空气易被氧化变质,请结合教材中有关
在空气易被氧化变质,请结合教材中有关 的性质,请写出它与
的性质,请写出它与 反应的化学方程式
反应的化学方程式(2)胶体是一类重要的分散系,它和溶液的本质区别是
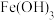 胶体的化学反应方程式为
胶体的化学反应方程式为(3)高铁酸钾(
 )是一种新型、高效、多功能绿色水处理剂,比
)是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,且无二次污染,工业上是向热的氢氧化铁浓碱性悬浮液中通入氯气,先制得高铁酸钠溶液,然后在低温下,向高铁酸钠溶液中加入
氧化性更强,且无二次污染,工业上是向热的氢氧化铁浓碱性悬浮液中通入氯气,先制得高铁酸钠溶液,然后在低温下,向高铁酸钠溶液中加入 至饱和就可以析出高铁酸钾晶体。制备高铁酸钠(
至饱和就可以析出高铁酸钾晶体。制备高铁酸钠(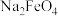 )的反应体系中有六种数粒:
)的反应体系中有六种数粒: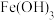 、
、 、
、 、
、 、
、 、
、 。
。①写出并配平制高铁酸钠的离子反应方程式:
②每生成
 转移
转移 电子,若反应过程中转移了
电子,若反应过程中转移了 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为 。
。Ⅱ.已知还原性:
 ,氧化性:
,氧化性:
(4)请写出向
 溶液中滴加少量
溶液中滴加少量 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为(5)在
 溶液中滴加过量
溶液中滴加过量 溶液,待反应完全后,推测溶液中的还原产物为
溶液,待反应完全后,推测溶液中的还原产物为(6)向含
 的溶液中逐滴加入
的溶液中逐滴加入 溶液。加入
溶液。加入 物质的量和析出
物质的量和析出 单质的物质的量的关系曲线如下图所示,写出反应过程中与
单质的物质的量的关系曲线如下图所示,写出反应过程中与 段曲线对应的离子方程式
段曲线对应的离子方程式 与
与 的物质的量之比为
的物质的量之比为 时,加入的
时,加入的 为
为 。
。
您最近一年使用:0次
3 .  是重要的化工原料,具有多种用途。
是重要的化工原料,具有多种用途。
(1) 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
(2)将一定量的 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有___________ (填离子符号)。
(3)查阅资料知: 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
请回答下列问题:
①已知 能发生如下反应:
能发生如下反应: 。
。
上述反应中氧化剂是___________ ,氧化产物是___________ ;HI在反应中体现了___________ 性
②根据上述反应鉴别 和NaCl。可选用的物质有
和NaCl。可选用的物质有___________ (填序号)
A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
③某厂废液中含有3%—6%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是___________ 。
A.浓硫酸 B. C.
C. D.
D.
(4)某学习小组以过氧化钠为原料制备出了一定量的纯碱,不小心混入了少量的 ,现欲对其纯度进行测定,将ag样品加热至质量不再发生变化,其质量变为bg,则该纯碱样品的纯度(即质量分数)为
,现欲对其纯度进行测定,将ag样品加热至质量不再发生变化,其质量变为bg,则该纯碱样品的纯度(即质量分数)为___________ 。
 是重要的化工原料,具有多种用途。
是重要的化工原料,具有多种用途。(1)
 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与
与 反应的化学方程式
反应的化学方程式(2)将一定量的
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有(3)查阅资料知:
 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。请回答下列问题:
①已知
 能发生如下反应:
能发生如下反应: 。
。上述反应中氧化剂是
②根据上述反应鉴别
 和NaCl。可选用的物质有
和NaCl。可选用的物质有A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
③某厂废液中含有3%—6%的
 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是A.浓硫酸 B.
 C.
C. D.
D.
(4)某学习小组以过氧化钠为原料制备出了一定量的纯碱,不小心混入了少量的
 ,现欲对其纯度进行测定,将ag样品加热至质量不再发生变化,其质量变为bg,则该纯碱样品的纯度(即质量分数)为
,现欲对其纯度进行测定,将ag样品加热至质量不再发生变化,其质量变为bg,则该纯碱样品的纯度(即质量分数)为
您最近一年使用:0次
4 . NaNO2易溶于水,外观和食盐相似,有咸味,人误食会中毒。已知NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请回答下列问题:
(1)已知HI和HCl性质相似。上述反应的离子方程式为_______ 。
(2)上述反应中NaI_______ (填序号)。
①是氧化产物 ②是还原产物
③既不是氧化产物,又不是还原产物 ④既是氧化产物,又是还原产物
(3)根据上述反应可鉴别NaNO2和NaCl。可选用的物质有:
①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋
你认为应该选用的物质有_______ (填序号)。
(4)某厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是_______ (填序号)。
A.NaCl B.NH4Cl C.HNO3
(5)NaNO2也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定。某实验小组欲用酸性KMnO4测定NaNO2样品纯度,所涉及到的反应有:
(a) NO +MnO
+MnO +H+ →NO
+H+ →NO +Mn2+ +H2O
+Mn2+ +H2O
(b) MnO + H2C2O4+ H+ → Mn2+ + CO2↑+ H2O
+ H2C2O4+ H+ → Mn2+ + CO2↑+ H2O
①配平反应(a) _______NO + _______MnO
+ _______MnO + _______H+ = _______NO
+ _______H+ = _______NO + _______Mn2+ + _______H2O
+ _______Mn2+ + _______H2O
_______
②误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是_______ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(1)已知HI和HCl性质相似。上述反应的离子方程式为
(2)上述反应中NaI
①是氧化产物 ②是还原产物
③既不是氧化产物,又不是还原产物 ④既是氧化产物,又是还原产物
(3)根据上述反应可鉴别NaNO2和NaCl。可选用的物质有:
①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋
你认为应该选用的物质有
(4)某厂废液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是
A.NaCl B.NH4Cl C.HNO3
(5)NaNO2也可作为食品防腐剂,但由于亚硝酸钠具有一定的毒性,因此食品中用量和残留量均有严格规定。某实验小组欲用酸性KMnO4测定NaNO2样品纯度,所涉及到的反应有:
(a) NO
 +MnO
+MnO +H+ →NO
+H+ →NO +Mn2+ +H2O
+Mn2+ +H2O(b) MnO
 + H2C2O4+ H+ → Mn2+ + CO2↑+ H2O
+ H2C2O4+ H+ → Mn2+ + CO2↑+ H2O①配平反应(a) _______NO
 + _______MnO
+ _______MnO + _______H+ = _______NO
+ _______H+ = _______NO + _______Mn2+ + _______H2O
+ _______Mn2+ + _______H2O②误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
您最近一年使用:0次
5 . 氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是___________ 。
a.沙里淘金 b.蜡炬成灰 c.星火燎原
(2)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为_______________________ 。
(3)NaNO2是食品防腐剂,常用于肉类食品保鲜。但亚硝酸钠具有一定的毒性 ,还会与食物作用生成致癌物,因此食品中用量和残留量均有严格规定。某实验小组欲用酸性KMnO4测定NaNO2样品的纯度。
(a)5NO + 2MnO
+ 2MnO + 6H+ = 5NO
+ 6H+ = 5NO + 2Mn2+ + 3H2O
+ 2Mn2+ + 3H2O
(b)MnO + H2C2O4+ H+→Mn2+ + CO2↑+ H2O(未配平)
+ H2C2O4+ H+→Mn2+ + CO2↑+ H2O(未配平)
①用双线桥法标出反应(a)的电子得失和数目_______________ ,其中氧化产物是_______________ 。
②H2C2O4中C元素的化合价为_________ ,配平(b):____________________ 。
(4)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是_________________ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(1)下列表述中没有氧化还原反应发生的是
a.沙里淘金 b.蜡炬成灰 c.星火燎原
(2)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为
(3)NaNO2是食品防腐剂,常用于肉类食品保鲜。但亚硝酸钠具有一定的毒性 ,还会与食物作用生成致癌物,因此食品中用量和残留量均有严格规定。某实验小组欲用酸性KMnO4测定NaNO2样品的纯度。
(a)5NO
 + 2MnO
+ 2MnO + 6H+ = 5NO
+ 6H+ = 5NO + 2Mn2+ + 3H2O
+ 2Mn2+ + 3H2O(b)MnO
 + H2C2O4+ H+→Mn2+ + CO2↑+ H2O(未配平)
+ H2C2O4+ H+→Mn2+ + CO2↑+ H2O(未配平)①用双线桥法标出反应(a)的电子得失和数目
②H2C2O4中C元素的化合价为
(4)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
您最近一年使用:0次
2020-12-13更新
|
190次组卷
|
3卷引用:重庆市万州新田中学2020-2021学年高一上学期第二次月考化学试题



