解题方法
1 . 亚氯酸钠( )是一种重要的含氯消毒剂。电解法生产
)是一种重要的含氯消毒剂。电解法生产 的部分工艺流程如下:
的部分工艺流程如下:

(1)饱和 溶液由粗盐水精制而成,为除去粗盐水中的
溶液由粗盐水精制而成,为除去粗盐水中的 和
和 ,需加入的试剂分别为
,需加入的试剂分别为_ 、_ 。
(2)写出“无隔膜电解”步骤发生反应的化学方程式____ 。
(3) 在溶液中可生成
在溶液中可生成 、
、 、
、 等微粒,其中
等微粒,其中 和
和 都具有漂白作用,但
都具有漂白作用,但 是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是
是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是___________________ (填字母)
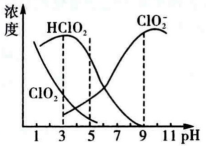
A. 在碱性条件下较稳定
在碱性条件下较稳定
B. 25℃时,该溶液在pH=4时比pH=11时更适合漂白
C.pH=7时,溶液中含氯微粒浓度大小为:c( )>c(
)>c( )>e(
)>e( )>c(
)>c( )
)
(4) 可发生反应3
可发生反应3 =2
=2 +
+ 而变质。
而变质。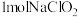 完全变质,理论上转移电子
完全变质,理论上转移电子_ mol。
(5)通过下列实验可测定所得 产品的纯度,实验检测原理为:
产品的纯度,实验检测原理为: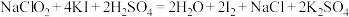 ;
;
①取1.000g样品,用适量蒸馏水溶解后,加入略过量的 溶液;
溶液;
②充分反应后,将反应液定容至200.00mL;
③取出20.00mL于锥形瓶中,向锥形瓶中滴加两滴淀粉溶液,用0.2000mol∙L-1的溶液 与之反应,至恰好完全反应时消耗
与之反应,至恰好完全反应时消耗 溶液22.00mL。
溶液22.00mL。
计算该样品中 的质量分数(写出计算过程)
的质量分数(写出计算过程)__________ 。
 )是一种重要的含氯消毒剂。电解法生产
)是一种重要的含氯消毒剂。电解法生产 的部分工艺流程如下:
的部分工艺流程如下:
(1)饱和
 溶液由粗盐水精制而成,为除去粗盐水中的
溶液由粗盐水精制而成,为除去粗盐水中的 和
和 ,需加入的试剂分别为
,需加入的试剂分别为(2)写出“无隔膜电解”步骤发生反应的化学方程式
(3)
 在溶液中可生成
在溶液中可生成 、
、 、
、 等微粒,其中
等微粒,其中 和
和 都具有漂白作用,但
都具有漂白作用,但 是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是
是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是
A.
 在碱性条件下较稳定
在碱性条件下较稳定B. 25℃时,该溶液在pH=4时比pH=11时更适合漂白
C.pH=7时,溶液中含氯微粒浓度大小为:c(
 )>c(
)>c( )>e(
)>e( )>c(
)>c( )
)(4)
 可发生反应3
可发生反应3 =2
=2 +
+ 而变质。
而变质。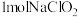 完全变质,理论上转移电子
完全变质,理论上转移电子(5)通过下列实验可测定所得
 产品的纯度,实验检测原理为:
产品的纯度,实验检测原理为: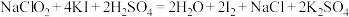 ;
;
①取1.000g样品,用适量蒸馏水溶解后,加入略过量的
 溶液;
溶液;②充分反应后,将反应液定容至200.00mL;
③取出20.00mL于锥形瓶中,向锥形瓶中滴加两滴淀粉溶液,用0.2000mol∙L-1的溶液
 与之反应,至恰好完全反应时消耗
与之反应,至恰好完全反应时消耗 溶液22.00mL。
溶液22.00mL。计算该样品中
 的质量分数(写出计算过程)
的质量分数(写出计算过程)
您最近一年使用:0次
名校
2 . 氯气(液氯)、漂白粉、“84消毒液”等都是含氯消毒剂。
(1)工业上用电解饱和食盐水的方法制取氯气,实验室中可以用二氧化锰或高锰酸钾与浓盐酸反应制取氯气。
①写出工业上制取氯气的化学方程式:_______ ,该反应中氧化产物是_______ (填化学式)
②写出二氧化锰与浓盐酸反应制取氯气的化学方程式:_______ 该反应中氧化剂和还原剂的物质的量之比为_______
③实验室中用高锰酸钾与浓盐酸反应制取氯气的化学方程式为: 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,有3.01×1022个电子发生转移时,生成的氯气的体积约为_______ (STP)
④用高锰酸钾和二氧化锰制备等量的氯气,被氧化的HCl的物质的量之比为_______ 。
(2)由于氯气不便于保存,生活中常用的含氯消毒剂是漂白粉或“84消毒液”
①将氯气入石灰乳(工业上先煅烧石灰石或贝壳,再加水反应来获得石灰乳)中可以制得漂白粉,写出该反应的化学方程式:_______ ,并用双线桥法标出该反应的电子转移方向和数目_____ 。
②漂白粉长时间暴露在空气中会变质,其原因是_______ 。
③氯气和氢氧化钠溶液反应可制得“84消毒液”。“84消毒液”和洁厕灵(主要成分是稀盐酸)不能混合使用,其原因是_______ 。
(3)含氯消毒剂的消毒能力可以用氧化性来衡量,商业上常用“有效氯”来说明消毒剂的消毒能力。“有效氯”的基本含义是指一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值可以用此时氯气的质量对消毒剂质量的百分比来表示。若100g某“84消毒液”与4.26g氯气的氧化能力相当(即该产品的“有效氯”为4.26%),则100g该产品中次氯酸钠的质量为_______ 。
(1)工业上用电解饱和食盐水的方法制取氯气,实验室中可以用二氧化锰或高锰酸钾与浓盐酸反应制取氯气。
①写出工业上制取氯气的化学方程式:
②写出二氧化锰与浓盐酸反应制取氯气的化学方程式:
③实验室中用高锰酸钾与浓盐酸反应制取氯气的化学方程式为: 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,有3.01×1022个电子发生转移时,生成的氯气的体积约为
④用高锰酸钾和二氧化锰制备等量的氯气,被氧化的HCl的物质的量之比为
(2)由于氯气不便于保存,生活中常用的含氯消毒剂是漂白粉或“84消毒液”
①将氯气入石灰乳(工业上先煅烧石灰石或贝壳,再加水反应来获得石灰乳)中可以制得漂白粉,写出该反应的化学方程式:
②漂白粉长时间暴露在空气中会变质,其原因是
③氯气和氢氧化钠溶液反应可制得“84消毒液”。“84消毒液”和洁厕灵(主要成分是稀盐酸)不能混合使用,其原因是
(3)含氯消毒剂的消毒能力可以用氧化性来衡量,商业上常用“有效氯”来说明消毒剂的消毒能力。“有效氯”的基本含义是指一定质量的这种消毒剂与多少质量的氯气的氧化能力相当,其数值可以用此时氯气的质量对消毒剂质量的百分比来表示。若100g某“84消毒液”与4.26g氯气的氧化能力相当(即该产品的“有效氯”为4.26%),则100g该产品中次氯酸钠的质量为
您最近一年使用:0次
2021-03-25更新
|
225次组卷
|
2卷引用:江苏省苏州市吴江区2020-2021学年高一上学期期中统考化学试卷.
3 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生Cl-和少量的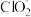 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将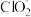 转化为Cl-除去。
转化为Cl-除去。
①关于二氧化氯的说法不正确的是_______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去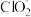 的离子方程式为
的离子方程式为_______ 。
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:ClO2+H2O2+NaOH=NaClO2+O2+H2O(未配平)。
①ClO2的氧化性_______ H2O2的氧化性(填“大于”或“小于”)。
②为测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应: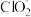 +4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2
+4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2 =2I-+
=2I-+ )。计算该样品的纯度为
)。计算该样品的纯度为_______ 。(写出计算过程)
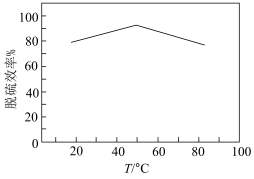
③工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件下NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2.在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中的阴离子为Cl-,则SO2的氧化产物是_______ 。测得脱硫效率(即SO2的吸收率)随温度变化的曲线如下图所示。_______ 。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生Cl-和少量的
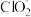 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将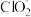 转化为Cl-除去。
转化为Cl-除去。①关于二氧化氯的说法不正确的是
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去
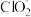 的离子方程式为
的离子方程式为(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:ClO2+H2O2+NaOH=NaClO2+O2+H2O(未配平)。
①ClO2的氧化性
②为测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应:
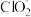 +4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2
+4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2 =2I-+
=2I-+ )。计算该样品的纯度为
)。计算该样品的纯度为③工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件下NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2.在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中的阴离子为Cl-,则SO2的氧化产物是
您最近一年使用:0次
名校
4 . 血液中的钙离子平衡在临床医学中具有重要的意义。某研究小组为测定血液样品中Ca2+的含量,进行的实验如下:
①量取5.0 mL血液样品,处理后配制成100 mL溶液;
②量取10.0 mL溶液,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得的CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入0.001 mol·L-1的酸性KMnO4溶液,使H2C2O4完全氧化,同时产生使澄清石灰水变浑浊的无色无味气体,消耗酸性KMnO4溶液的体积为2.00 mL。
(1)步骤①中用到的玻璃仪器有玻璃棒、烧杯、量筒、________________________ 。
(2)步骤②中发生反应的离子方程式为_______________________________________ 。
(3)步骤④中发生反应的离子方程式为__________________________ ;氧化产物与还原产物的物质的量之比为___________________ 。
(4)血样中Ca2+的含量为________ g·mL-1。
①量取5.0 mL血液样品,处理后配制成100 mL溶液;
②量取10.0 mL溶液,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得的CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入0.001 mol·L-1的酸性KMnO4溶液,使H2C2O4完全氧化,同时产生使澄清石灰水变浑浊的无色无味气体,消耗酸性KMnO4溶液的体积为2.00 mL。
(1)步骤①中用到的玻璃仪器有玻璃棒、烧杯、量筒、
(2)步骤②中发生反应的离子方程式为
(3)步骤④中发生反应的离子方程式为
(4)血样中Ca2+的含量为
您最近一年使用:0次



