名校
解题方法
1 . 含氯物质用途广泛,可用于特定场合的消毒。回答下列问题:
(1)下列关于氯气的说法错误的是___________。
(2)实验室可利用 和浓盐酸制备氯气。为测定反应残余液中盐酸的浓度,小组同学提出方案:与足量Zn反应,测量生成的
和浓盐酸制备氯气。为测定反应残余液中盐酸的浓度,小组同学提出方案:与足量Zn反应,测量生成的 体积,计算残余液中盐酸的浓度。装置如图所示(量气管和水准管之间用橡胶管连接,夹持仪器略)。
体积,计算残余液中盐酸的浓度。装置如图所示(量气管和水准管之间用橡胶管连接,夹持仪器略)。

①仪器a的名称为___________ 。
②在记录量气管读数时,应注意将装置冷却至室温,再___________ (填具体操作),视线与量气管内凹液面相切,水平读数。
③取残余液10.0mL与足量的锌粒反应,最终量气管内收集到气体367.5mL(已知此时气体摩尔体积为24.5L/mol)。由此可知:不与 反应的盐酸临界浓度约为
反应的盐酸临界浓度约为___________ mol/L(保留3位有效数字)。
(3)消毒效率可用单位质量消毒剂的得电子数来表示。NaClO和 作消毒剂时还原产物均为
作消毒剂时还原产物均为 。NaClO的消毒效率是氯气的
。NaClO的消毒效率是氯气的___________ 倍(保留2位小数)。
(4)久置后的84消毒液会变质,用化学方程式解释原因:___________ ;___________ 。(已知酸性: )
)
(5)针对不同物品的消毒,84消毒液需要稀释到不同的浓度。取1mL含次氯酸钠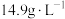 的84消毒液,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
的84消毒液,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为___________  。
。
(6)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为___________ kg(保留整数)。
(1)下列关于氯气的说法错误的是___________。
| A.室温下,氯气能溶于水 | B.可采用碱石灰干燥氯气 |
| C.可通过排饱和食盐水法收集少量氯气 | D.室温下,可通过加压使氯气液化而储存于钢瓶中 |
(2)实验室可利用
 和浓盐酸制备氯气。为测定反应残余液中盐酸的浓度,小组同学提出方案:与足量Zn反应,测量生成的
和浓盐酸制备氯气。为测定反应残余液中盐酸的浓度,小组同学提出方案:与足量Zn反应,测量生成的 体积,计算残余液中盐酸的浓度。装置如图所示(量气管和水准管之间用橡胶管连接,夹持仪器略)。
体积,计算残余液中盐酸的浓度。装置如图所示(量气管和水准管之间用橡胶管连接,夹持仪器略)。
①仪器a的名称为
②在记录量气管读数时,应注意将装置冷却至室温,再
③取残余液10.0mL与足量的锌粒反应,最终量气管内收集到气体367.5mL(已知此时气体摩尔体积为24.5L/mol)。由此可知:不与
 反应的盐酸临界浓度约为
反应的盐酸临界浓度约为(3)消毒效率可用单位质量消毒剂的得电子数来表示。NaClO和
 作消毒剂时还原产物均为
作消毒剂时还原产物均为 。NaClO的消毒效率是氯气的
。NaClO的消毒效率是氯气的(4)久置后的84消毒液会变质,用化学方程式解释原因:
 )
)(5)针对不同物品的消毒,84消毒液需要稀释到不同的浓度。取1mL含次氯酸钠
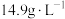 的84消毒液,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
的84消毒液,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为 。
。(6)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为
您最近一年使用:0次
2 . 铝、铁是常见的两种金属,它们的单质及化合物在生活生产中处处可见。
(1)过量的铁和稀硝酸发生反应,产物是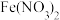 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式_______________ 。
(2)实验室配制 溶液时,如果没有隔绝空气,
溶液时,如果没有隔绝空气, 会被氧化为
会被氧化为________ (填写化学式)。在该溶液中加入________ 试剂,看到_________ 现象,证明溶液变质。写出检验 已经被氧化的离子方程式
已经被氧化的离子方程式_________ 。
(3)已知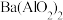 可溶于水,下图表示的是向
可溶于水,下图表示的是向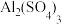 溶液中逐滴加入
溶液中逐滴加入 溶液时,生成沉淀的物质的量y与加入
溶液时,生成沉淀的物质的量y与加入 的物质的量x的关系。
的物质的量x的关系。

由图可知c点的沉淀是______ (填化学式),a-b过程中沉淀物质的量较大的是____ (填化学式),写出从开始滴加入 溶液至c点的总反应离子方程式
溶液至c点的总反应离子方程式_______ 。
(1)过量的铁和稀硝酸发生反应,产物是
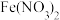 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式(2)实验室配制
 溶液时,如果没有隔绝空气,
溶液时,如果没有隔绝空气, 会被氧化为
会被氧化为 已经被氧化的离子方程式
已经被氧化的离子方程式(3)已知
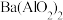 可溶于水,下图表示的是向
可溶于水,下图表示的是向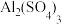 溶液中逐滴加入
溶液中逐滴加入 溶液时,生成沉淀的物质的量y与加入
溶液时,生成沉淀的物质的量y与加入 的物质的量x的关系。
的物质的量x的关系。
由图可知c点的沉淀是
 溶液至c点的总反应离子方程式
溶液至c点的总反应离子方程式
您最近一年使用:0次
3 . 氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是___________ 。
a.沙里淘金 b.蜡炬成灰 c.星火燎原
(2)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为_______________________ 。
(3)NaNO2是食品防腐剂,常用于肉类食品保鲜。但亚硝酸钠具有一定的毒性 ,还会与食物作用生成致癌物,因此食品中用量和残留量均有严格规定。某实验小组欲用酸性KMnO4测定NaNO2样品的纯度。
(a)5NO + 2MnO
+ 2MnO + 6H+ = 5NO
+ 6H+ = 5NO + 2Mn2+ + 3H2O
+ 2Mn2+ + 3H2O
(b)MnO + H2C2O4+ H+→Mn2+ + CO2↑+ H2O(未配平)
+ H2C2O4+ H+→Mn2+ + CO2↑+ H2O(未配平)
①用双线桥法标出反应(a)的电子得失和数目_______________ ,其中氧化产物是_______________ 。
②H2C2O4中C元素的化合价为_________ ,配平(b):____________________ 。
(4)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是_________________ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(1)下列表述中没有氧化还原反应发生的是
a.沙里淘金 b.蜡炬成灰 c.星火燎原
(2)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为
(3)NaNO2是食品防腐剂,常用于肉类食品保鲜。但亚硝酸钠具有一定的毒性 ,还会与食物作用生成致癌物,因此食品中用量和残留量均有严格规定。某实验小组欲用酸性KMnO4测定NaNO2样品的纯度。
(a)5NO
 + 2MnO
+ 2MnO + 6H+ = 5NO
+ 6H+ = 5NO + 2Mn2+ + 3H2O
+ 2Mn2+ + 3H2O(b)MnO
 + H2C2O4+ H+→Mn2+ + CO2↑+ H2O(未配平)
+ H2C2O4+ H+→Mn2+ + CO2↑+ H2O(未配平)①用双线桥法标出反应(a)的电子得失和数目
②H2C2O4中C元素的化合价为
(4)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
您最近一年使用:0次
2020-12-13更新
|
190次组卷
|
3卷引用:四川省广安市武胜烈面中学校2021-2022学年高一上学期期中测试化学试题
名校
4 . 二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式____________________________________________ 。
(2)写出草酸(H2C2O4)使酸性高锰酸钾褪色的离子方程式__________________________ 。
(3)写出向Na2S2O3 中加入稀硫酸反应的离子方程式______________________________ 。
(4)已知:Se + 2H2SO4(浓) =2SO2↑ + SeO2 + 2H2O
2SO2 + SeO2 + 2H2O =Se + 2SO42-+ 4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________________ 。
(5)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2 + KI + HNO3 → Se + I2 + KNO3 + H2O ② I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
配平方程式①,标出电子转移的方向和数目。_________________________ 。
(6)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_____________ 。
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3反应的化学方程式
(2)写出草酸(H2C2O4)使酸性高锰酸钾褪色的离子方程式
(3)写出向Na2S2O3 中加入稀硫酸反应的离子方程式
(4)已知:Se + 2H2SO4(浓) =2SO2↑ + SeO2 + 2H2O
2SO2 + SeO2 + 2H2O =Se + 2SO42-+ 4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(5)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2 + KI + HNO3 → Se + I2 + KNO3 + H2O ② I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
配平方程式①,标出电子转移的方向和数目。
(6)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为
您最近一年使用:0次



