1 . 某中学趣味化学实验小组的同学想通过“ 被浓
被浓 氧化”的实验,验证
氧化”的实验,验证 的还原性.
的还原性.
实验一:验证 的还原性
的还原性
(1)红棕色气体是____________ 。(写化学式)
(2)实验现象与预期不符,继续进行实验。
取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明___________________ 。
实验二:探究溶液变为深棕色的原因
【资料与猜想】
查阅资料后猜想,可能是生成的 或NO与溶液中的
或NO与溶液中的 或
或 反应,而使溶液变为深棕色。
反应,而使溶液变为深棕色。
【实验与探究】
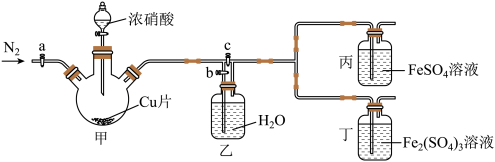
用如图所示装置进行实验(气密性已检验,尾气处理已略去)
ⅱ.向甲中加入适量浓 ,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ.关闭b、打开c,更换丙、丁中的溶液(试剂不变);
ⅳ.继续向甲中加入浓 ,一段时间后观察到了与ⅱ相同的实验现象。
,一段时间后观察到了与ⅱ相同的实验现象。
(3)通入 的目的是
的目的是________________________ 。
(4)铜与浓硝酸反应的离子方程式是__________________________ 。
(5)装置乙的作用是_____________________ 。
(6)实验结论:溶液的深棕色可能是因为 。
【反思与改进】
实验三:验证 的还原性
的还原性
(7)该小组同学依据实验二的结论改进了实验一,观察到了预期现象,其实验操作是向盛有____________ 的试管中滴入几滴____________ ,振荡。
 被浓
被浓 氧化”的实验,验证
氧化”的实验,验证 的还原性.
的还原性.实验一:验证
 的还原性
的还原性实验操作 | 预期现象 | 实验现象 |
向盛有2mL  溶液的试管中,滴入几滴浓硝酸,振荡。 溶液的试管中,滴入几滴浓硝酸,振荡。 | 试管中产生红棕色气体,溶液变为黄色。 | 试管中产生红棕色气体,溶液变为深棕色。 |
(1)红棕色气体是
(2)实验现象与预期不符,继续进行实验。
取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明
实验二:探究溶液变为深棕色的原因
【资料与猜想】
查阅资料后猜想,可能是生成的
 或NO与溶液中的
或NO与溶液中的 或
或 反应,而使溶液变为深棕色。
反应,而使溶液变为深棕色。【实验与探究】
用如图所示装置进行实验(气密性已检验,尾气处理已略去)
ⅱ.向甲中加入适量浓
 ,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;ⅲ.关闭b、打开c,更换丙、丁中的溶液(试剂不变);
ⅳ.继续向甲中加入浓
 ,一段时间后观察到了与ⅱ相同的实验现象。
,一段时间后观察到了与ⅱ相同的实验现象。(3)通入
 的目的是
的目的是(4)铜与浓硝酸反应的离子方程式是
(5)装置乙的作用是
(6)实验结论:溶液的深棕色可能是因为 。
A. 与NO发生了反应 与NO发生了反应 | B. 与 与 发生了反应 发生了反应 |
C. 与NO发生了反应 与NO发生了反应 | D. 与 与 发生了反应 发生了反应 |
【反思与改进】
实验三:验证
 的还原性
的还原性(7)该小组同学依据实验二的结论改进了实验一,观察到了预期现象,其实验操作是向盛有
您最近一年使用:0次
名校
解题方法
2 . 为测定某补血剂样品(主要成分是硫酸亚铁晶体 )中铁元素的含量,某学兴趣小组设计了如下实验方案:
)中铁元素的含量,某学兴趣小组设计了如下实验方案:
方案一:将 转化为
转化为 ,测定质量变化.
,测定质量变化.
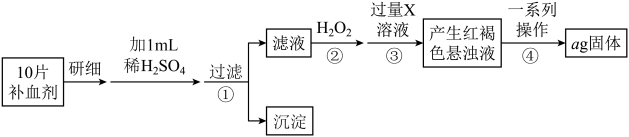
(1)写出步骤②中发生的反应的离子方程式__________________________
(2)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量,写出发生反应的化学方程式_______________________________ .
(3)假设实验无损耗,则每片补血剂含铁元素的质量为____________ g(用含a的代数式表示)。
方案二:用酸性 溶液滴定测定铁元素的含量
溶液滴定测定铁元素的含量
实验前,首先要准确配制 的酸性
的酸性 溶液250mL
溶液250mL
(4)计算所需 固体的质量为
固体的质量为____________ g.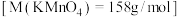
(5)配制溶液时,必须用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、________________
(6)配制过程中,下列操作导致溶液浓度偏小的是(填序号)_______
A.加水定容时俯视刻度线
B.定容加水时超过刻度线后,立即吸出多余的水
C.溶液从烧杯转移到容量瓶后没有洗涤烧杯
(7)若某同学取5片补血剂样品配成100mL溶液,取20.00mL,用上述操作配置的 溶液滴定,耗去
溶液滴定,耗去 ,反应的离子方程式为
,反应的离子方程式为______________________ ,每片补血剂含铁元素的质量____________ g(用代数式表示).
 )中铁元素的含量,某学兴趣小组设计了如下实验方案:
)中铁元素的含量,某学兴趣小组设计了如下实验方案:方案一:将
 转化为
转化为 ,测定质量变化.
,测定质量变化.
(1)写出步骤②中发生的反应的离子方程式
(2)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量,写出发生反应的化学方程式
(3)假设实验无损耗,则每片补血剂含铁元素的质量为
方案二:用酸性
 溶液滴定测定铁元素的含量
溶液滴定测定铁元素的含量实验前,首先要准确配制
 的酸性
的酸性 溶液250mL
溶液250mL(4)计算所需
 固体的质量为
固体的质量为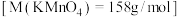
(5)配制溶液时,必须用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、
(6)配制过程中,下列操作导致溶液浓度偏小的是(填序号)
A.加水定容时俯视刻度线
B.定容加水时超过刻度线后,立即吸出多余的水
C.溶液从烧杯转移到容量瓶后没有洗涤烧杯
(7)若某同学取5片补血剂样品配成100mL溶液,取20.00mL,用上述操作配置的
 溶液滴定,耗去
溶液滴定,耗去 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
名校
3 . 某小组探究CuSO4溶液、FeSO4溶液与碱的反应,探究物质氧化性和还原性的变化规律。将一定浓度CuSO4溶液,饱和FeSO4混合溶液加入适量氨水,产生红褐色沉淀,经检验,红褐色沉淀含Fe(OH)3。
(1)分析Fe(OH)3产生的原因:O2氧化所致。
验证:向FeSO4溶液中滴入氨水,生成的白色沉淀迅速变为灰绿色,一段时间后有红褐色沉淀生成。
①生成白色沉淀的离子方程式是___________ 。
②产生红褐色沉淀:4Fe(OH)2+O2+2H2O=4Fe(OH)3。电极反应式:还原反应:O2+2H2O+4e-=4OH-。氧化反应:___________ 。
(2)提出问题:产生Fe(OH)3的原因可能是Cu2+氧化所致。
验证如下(溶液A:饱和FeSO4溶液+CuSO4溶液;已排除空气的影响):
①I中可能产生Cu,运用氧化还原反应规律分析产生Cu的合理性:___________ 。
②检验:滤出I中不溶物,用稀H2SO4溶解,未检出Cu。分析原因:
i.I中未生成Cu。
iiI中生成了Cu。由于___________ (用离子方程式表示),因此未检出Cu。
(3)设计实验(III)确认CuSO4的作用(已排除空气的影响),装置示意图如下所示。
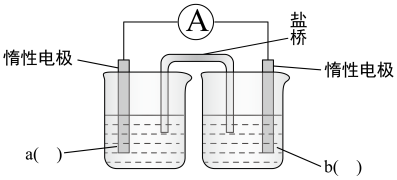
①补全电化学装置示意图___________ 。经检验,实验中产生了Fe(OH)3、Cu。
②II、III中均含Cu2+。III中产生了Cu,II中未产生Cu,试解释原因___________ 。
(4)CH3CHO分别与AgNO3溶液、银氨溶液混合并加热,CH3CHO与AgNO3溶液混合物明显现象,但与银氨溶液混合能产生银镜。试解释原因:___________ 。
(1)分析Fe(OH)3产生的原因:O2氧化所致。
验证:向FeSO4溶液中滴入氨水,生成的白色沉淀迅速变为灰绿色,一段时间后有红褐色沉淀生成。
①生成白色沉淀的离子方程式是
②产生红褐色沉淀:4Fe(OH)2+O2+2H2O=4Fe(OH)3。电极反应式:还原反应:O2+2H2O+4e-=4OH-。氧化反应:
(2)提出问题:产生Fe(OH)3的原因可能是Cu2+氧化所致。
验证如下(溶液A:饱和FeSO4溶液+CuSO4溶液;已排除空气的影响):
| 序号 | 实验 | 试剂 | 现象 |
| I | 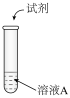 | 氨水 | 生成沉淀,一段时间后,产生红褐色沉淀和灰黑色固体物质 |
| II | 水 | 溶液无明显变化 |
②检验:滤出I中不溶物,用稀H2SO4溶解,未检出Cu。分析原因:
i.I中未生成Cu。
iiI中生成了Cu。由于
(3)设计实验(III)确认CuSO4的作用(已排除空气的影响),装置示意图如下所示。

①补全电化学装置示意图
②II、III中均含Cu2+。III中产生了Cu,II中未产生Cu,试解释原因
(4)CH3CHO分别与AgNO3溶液、银氨溶液混合并加热,CH3CHO与AgNO3溶液混合物明显现象,但与银氨溶液混合能产生银镜。试解释原因:
您最近一年使用:0次
2022-01-16更新
|
1081次组卷
|
8卷引用:北京市朝阳区2021-2022学年高三上学期期末考试化学试题
名校
解题方法
4 . 纳米 在磁流体等领域有应用。一种制备纳米
在磁流体等领域有应用。一种制备纳米 的方法如下:
的方法如下:
Ⅰ. 的氧化:常温,将
的氧化:常温,将 溶液用
溶液用 溶液调节
溶液调节 至
至 ,再加入
,再加入 溶液,得到
溶液,得到 红棕色悬浊液。
红棕色悬浊液。
(1)①若用 溶液调节
溶液调节 过高会产生白色沉淀,该反应的离子方程式是
过高会产生白色沉淀,该反应的离子方程式是___________ 。
上述反应完成后,测得 值与
值与 产率及其生成后溶液
产率及其生成后溶液 的关系,结果如下:
的关系,结果如下:
②用离子方程式解释 生成后溶液
生成后溶液 下降的原因:
下降的原因:___________ 。
③当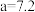 时,产物中存在大量
时,产物中存在大量 。对
。对 的产生提出两种假设:
的产生提出两种假设:
假设ⅰ:反应过程中溶液酸性增强,导致 向
向 转化。
转化。
假设ⅱ:溶液中存在少量 ,导致
,导致 向
向 转化。
转化。
经分析假设ⅰ不成立。其实验依据是___________ 。
为验证假设ⅱ,其他条件相同时,向 浊液中加入不同浓度
浊液中加入不同浓度 ,
, 后测定物质的组成,结果如下:
后测定物质的组成,结果如下:
④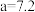 和
和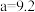 时,
时, 产率差异很大的原因是
产率差异很大的原因是___________ 。
Ⅱ. 和
和 共沉淀:向
共沉淀:向 红棕色悬浊液中同时加入
红棕色悬浊液中同时加入 溶液和
溶液和 浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米
浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米 。
。
(2)共沉淀时的反应条件对产物纯度和产率有影响。
①共沉淀 过低时,得到的纳米
过低时,得到的纳米 中会混有的物质是
中会混有的物质是___________ 。
②已知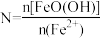 ,其他条件一定时,测得纳米
,其他条件一定时,测得纳米 的产率随
的产率随 的变化曲线如图所示。经理论分析,
的变化曲线如图所示。经理论分析, 时纳米
时纳米 产率应最高,事实并非如此的可能原因是
产率应最高,事实并非如此的可能原因是___________ 。
 在磁流体等领域有应用。一种制备纳米
在磁流体等领域有应用。一种制备纳米 的方法如下:
的方法如下:Ⅰ.
 的氧化:常温,将
的氧化:常温,将 溶液用
溶液用 溶液调节
溶液调节 至
至 ,再加入
,再加入 溶液,得到
溶液,得到 红棕色悬浊液。
红棕色悬浊液。(1)①若用
 溶液调节
溶液调节 过高会产生白色沉淀,该反应的离子方程式是
过高会产生白色沉淀,该反应的离子方程式是上述反应完成后,测得
 值与
值与 产率及其生成后溶液
产率及其生成后溶液 的关系,结果如下:
的关系,结果如下: | 7.2 | 8.2 | 9.2 |
 的产率 的产率 | 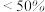 | 95% | 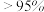 |
 生成后的 生成后的 | 约4 | 约4 | 约4 |
 生成后溶液
生成后溶液 下降的原因:
下降的原因:③当
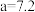 时,产物中存在大量
时,产物中存在大量 。对
。对 的产生提出两种假设:
的产生提出两种假设:假设ⅰ:反应过程中溶液酸性增强,导致
 向
向 转化。
转化。假设ⅱ:溶液中存在少量
 ,导致
,导致 向
向 转化。
转化。经分析假设ⅰ不成立。其实验依据是
为验证假设ⅱ,其他条件相同时,向
 浊液中加入不同浓度
浊液中加入不同浓度 ,
, 后测定物质的组成,结果如下:
后测定物质的组成,结果如下: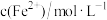 |  含量% 含量% |  含量% 含量% |
| 0.00 | 100 | 0 |
| 0.01 | 40 | 60 |
| 0.02 | 0 | 100 |
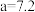 和
和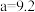 时,
时, 产率差异很大的原因是
产率差异很大的原因是Ⅱ.
 和
和 共沉淀:向
共沉淀:向 红棕色悬浊液中同时加入
红棕色悬浊液中同时加入 溶液和
溶液和 浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米
浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米 。
。(2)共沉淀时的反应条件对产物纯度和产率有影响。
①共沉淀
 过低时,得到的纳米
过低时,得到的纳米 中会混有的物质是
中会混有的物质是②已知
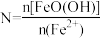 ,其他条件一定时,测得纳米
,其他条件一定时,测得纳米 的产率随
的产率随 的变化曲线如图所示。经理论分析,
的变化曲线如图所示。经理论分析, 时纳米
时纳米 产率应最高,事实并非如此的可能原因是
产率应最高,事实并非如此的可能原因是
您最近一年使用:0次
5 . 某同学探究Fe2+还原性的实验记录如下:
下列说法错误的是
| ① | ② | ③ |
 |  |  |
溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。 | 溶液变红且不褪色,有气体生成(经检验为O2),经检验有丁达尔效应。 | 溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,经检验无丁达尔效应。 |
| A.对比①②,可以判定酸性越强,H2O2的氧化能力越强 |
| B.①中发生的氧化还原反应只有两种 |
| C.②中红色溶液中含有Fe(OH)3胶体 |
| D.③中发生的氧化还原反应为4Fe2++O2+4H+=4Fe3++2H2O |
您最近一年使用:0次
2021-10-09更新
|
1281次组卷
|
11卷引用:北京市海淀区第二十中学2022-2023学年高一上学期11月月考化学试题
北京市海淀区第二十中学2022-2023学年高一上学期11月月考化学试题山东省滨州市2021届高三上学期期末考试化学试题(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)山东省六校(泰安一中、菏泽一中、章丘四中、东营一中、济宁一中、聊城一中、胜利一中)2022届高三“山东学情”10月联考化学试题A卷山东省六校(泰安一中、菏泽一中、章丘四中、东营一中、济宁一中、聊城一中、胜利一中)2022届高三“山东学情”10月联考化学试题B卷(已下线)解密11 化学实验(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)江西省景德镇市第一中学2021-2022学年高二上学期期末(重点班)化学试题湖南省永州市2023届高考第一次适应性考试化学试题湖南省宁远县第一中学2022-2023学年高二上学期第一次适应性考试化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
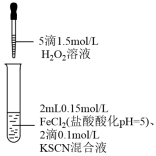
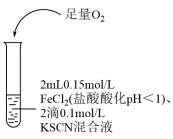
6 . 某同学用KSCN溶液和FeCl2溶液探究Fe2+的还原性时出现异常现象,实验如下:
下列说法错误的是( )
| ① | ② | ③ |
 | 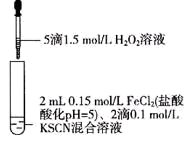 |  |
| 溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀 | 溶液变红且不褪色,有气体生成(经检验为O2),经检验有丁达尔效应。 | 溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,经检验无丁达尔效应。 |
| A.②中红色溶液中含有Fe(OH)3胶体 |
| B.实验②中发生的氧化还原反应只有两种 |
| C.对比①②③,可以判定酸性条件下H2O2可以氧化SCN- |
| D.③中发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O |
您最近一年使用:0次
2020-11-03更新
|
1839次组卷
|
15卷引用:北京市延庆区2019届高三第一次模拟考试化学试题
北京市延庆区2019届高三第一次模拟考试化学试题山西省太原市第五中学2020届高三10月月考化学试题2020届高考化学知识点必练——氧化还原反应的本质及相关概念2020届高三化学化学二轮复习——高考常考题:情境下氧化还原反应方程式书写【精编选择26题】山东省师范大学附属中学2021届高三上学期第二次考试化学试题辽宁省大连市一〇三中学2021届高三一模考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一12月月考化学试题(已下线)【浙江新东方】在线化学13江西省南昌市南昌县莲塘第一中学2021届高三上学期12月质量检测化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)山东省潍坊市实验中学2021-2022学年高三9月单元测试(入学考试)化学试题武汉市第一中学2021-2022学年高三上学期10月月考化学试题重庆市缙云教育联盟2023-2024学年高三下学期8月月考化学试题重庆市乌江新高考协作体2023-2024学年高一上学期11月期中化学试题
解题方法
7 . 纳米铜是一种性能优质的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图所示。

资料:肼(N2H4)无色油状液体,溶于水生成水合肼N2H4·H2O(水合肼有强还原性,生成无污染物质,易挥发)
(1)①上述流程中可以加快反应速率的措施有______ 。
A.过滤和萃取 B.升高温度 C.增大压强 D.研磨矿石
②用FeCl3溶液浸取辉铜矿中铜元素的反应为:Cu2S+4FeCl3=2CuCl2+4FeCl2+S。浸取时,在有氧的环境下可维持Fe3+较高浓度,有关反应的离子方程式为_______ 。
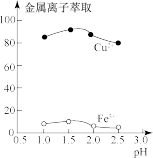
(2)“萃取”时,两种金属离子萃取率与pH的关系如图所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是______ 。
(3)“反萃取”得到的CuSO4溶液制备纳米铜粉时,Cu2+的还原率随pH和温度的变化如下表所示:
①该反应的离子方程式为_______ 。
②超过70℃时Cu2+的还原率降低的原因是______ 。
③以辉铜矿为原料制备纳米铜粉的工艺条件选择70℃、pH=10的理由是______ 。
(4)“水相1”中加入适量氨水,静置,再经过滤、_____ 、干燥、______ 等操作可得到Fe2O3。
(5)假设制得纳米铜的质量为akg,则最少投入肼的物质的量是______ 。

资料:肼(N2H4)无色油状液体,溶于水生成水合肼N2H4·H2O(水合肼有强还原性,生成无污染物质,易挥发)
(1)①上述流程中可以加快反应速率的措施有
A.过滤和萃取 B.升高温度 C.增大压强 D.研磨矿石
②用FeCl3溶液浸取辉铜矿中铜元素的反应为:Cu2S+4FeCl3=2CuCl2+4FeCl2+S。浸取时,在有氧的环境下可维持Fe3+较高浓度,有关反应的离子方程式为
(2)“萃取”时,两种金属离子萃取率与pH的关系如图所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是

(3)“反萃取”得到的CuSO4溶液制备纳米铜粉时,Cu2+的还原率随pH和温度的变化如下表所示:
| pH | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| Cu2+还原率(%) | 34 | 60 | 90 | 92 | 95 | 92 | 90 | |
| 产物形态 | 砖红色Cu2O | 铜粉 | 紫黑色纳米铜 | |||||
| 温度 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | |
| Cu2+还原率(%) | 25 | 45 | 70 | 80 | 95 | 90 | 85 | |
| 产物形态 | 砖红色Cu2O | 铜粉 | 紫黑色纳米铜 | |||||
①该反应的离子方程式为
②超过70℃时Cu2+的还原率降低的原因是
③以辉铜矿为原料制备纳米铜粉的工艺条件选择70℃、pH=10的理由是
(4)“水相1”中加入适量氨水,静置,再经过滤、
(5)假设制得纳米铜的质量为akg,则最少投入肼的物质的量是
您最近一年使用:0次
名校
解题方法
8 . 探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85%H3PO4配制100mL1.0mol·L-1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______ 。
(2)请结合实验Ⅱ中现象,分析铁钉与H3PO4反应的产物_______ 。
(3)探究实验Ⅰ中停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是未排除O2的干扰,请解释O2是如何干扰实验的:_____ 。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。形成氧化膜(以Fe3O4计)的离子方程式是____ 。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析其原因:______ 。
| 实验 | 操作 | 现象 |
| Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30mL1.0mol•L-1H3PO4和3mL30%H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。  |
| Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30mL1.0mol•L-1H3PO4和3mLH2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
(1)用85%H3PO4配制100mL1.0mol·L-1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
(2)请结合实验Ⅱ中现象,分析铁钉与H3PO4反应的产物
(3)探究实验Ⅰ中停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是未排除O2的干扰,请解释O2是如何干扰实验的:
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。形成氧化膜(以Fe3O4计)的离子方程式是
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析其原因:
您最近一年使用:0次
名校
解题方法
9 . 纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
I.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到 FeO( OH)红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生灰白色沉淀,该反应的离子方程式是_____________ 。
②上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
用离子方程式解释FeO( OH)生成后溶液pH下降的原因:____ 。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2 O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeO( OH)向Fe2 O3的转化;
ii.溶液中存在少量Fe2+,导致FeO( OH)向Fe2O3的转化。
①经分析,假设i不成立的实验依据是____ 。
②其他条件相同时,向FeO( OH)浊液中加入不同浓度Fe2+,30 min后测定物质的组成,结果如下:
以上结果表明:____ 。
③ a=7和a =9时,FeO( OH)产率差异很大的原因是____ 。
Ⅱ.Fe2+和Fe3+共沉淀:向FeO( OH)红棕色悬浊液中同时加入FeSO4溶液和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3O4。
(3)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是____ 。
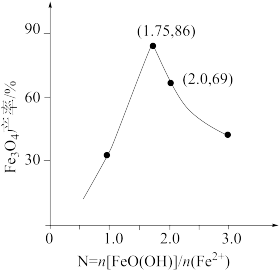
②已知N=n[FeO(OH)]/n(Fe2+),其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如下图所示:

经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是_________ 。
I.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到 FeO( OH)红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生灰白色沉淀,该反应的离子方程式是
②上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
| a | 7.0 | 8.0 | 9.0 |
| Fe(OH)的产率 | <50% | 95% | >95% |
| FeO(OH)生成后的pH | 接近4 | 接近4 | 接近4 |
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2 O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeO( OH)向Fe2 O3的转化;
ii.溶液中存在少量Fe2+,导致FeO( OH)向Fe2O3的转化。
①经分析,假设i不成立的实验依据是
②其他条件相同时,向FeO( OH)浊液中加入不同浓度Fe2+,30 min后测定物质的组成,结果如下:
| c(Fe2+)/mol·L-1 | Fe(OH)百分含量/% | Fe2O3百分含量/% |
| 0.00 | 100 | 0 |
| 0.01 | 40 | 60 |
| 0.02 | 0 | 100 |
③ a=7和a =9时,FeO( OH)产率差异很大的原因是
Ⅱ.Fe2+和Fe3+共沉淀:向FeO( OH)红棕色悬浊液中同时加入FeSO4溶液和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3O4。
(3)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是
②已知N=n[FeO(OH)]/n(Fe2+),其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如下图所示:

经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是
您最近一年使用:0次
10 . 某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
分析上述三个实验,下列叙述不正确 的是
| 编号 | 实验I | 实验II | 实验II |
| 实验步骤 | 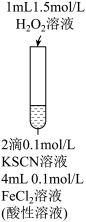 | 将实验I褪色后的溶液分三份分别进行实验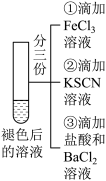 | 为进一步探究“红色褪去”的原因,又进行以下实验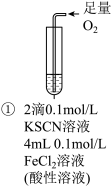 ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
| 现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
| A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快 |
| B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化 |
| C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关 |
| D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关 |
您最近一年使用:0次



