名校
解题方法
1 . 某化学兴趣小组在研究“铁及其化合物性质”时,发现向 溶液中滴加2滴
溶液中滴加2滴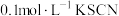 溶液;无明显现象,再滴加
溶液;无明显现象,再滴加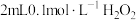 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
(1)溶液先变红的原因是____________ 、____________ (用两个离子方程式表示)。
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是 被
被 还原。取褪色后溶液,滴加
还原。取褪色后溶液,滴加 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。
Ⅱ.乙同学认为是 被氧化。取褪色后溶液,滴加
被氧化。取褪色后溶液,滴加 溶液,出现红色。
溶液,出现红色。
根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为 被
被 氧化。
氧化。
丙同学认为____________ 。
为了探究溶液褪色的原因究竟是上述的哪一种,该兴趣小组进行了如下实验。向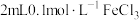 溶液中滴加2滴
溶液中滴加2滴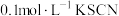 溶液,后通入
溶液,后通入 ,发现溶液
,发现溶液___________ ,证明溶液褪色的原因不是乙同学认为的原因,而是丙同学认为的原因。
(3)该兴趣小组通过查阅资料,发现 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体,写出上述实验中
和两种可直接排放到空气中的气体,写出上述实验中 被氧化的离子方程式:
被氧化的离子方程式:_________ 。
(4)根据题目所给信息及实验现象推断物质还原性强弱:
____________  (填“>”或“<”)
(填“>”或“<”)
 溶液中滴加2滴
溶液中滴加2滴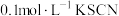 溶液;无明显现象,再滴加
溶液;无明显现象,再滴加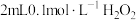 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:(1)溶液先变红的原因是
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是
 被
被 还原。取褪色后溶液,滴加
还原。取褪色后溶液,滴加 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。Ⅱ.乙同学认为是
 被氧化。取褪色后溶液,滴加
被氧化。取褪色后溶液,滴加 溶液,出现红色。
溶液,出现红色。根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为
 被
被 氧化。
氧化。丙同学认为
为了探究溶液褪色的原因究竟是上述的哪一种,该兴趣小组进行了如下实验。向
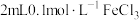 溶液中滴加2滴
溶液中滴加2滴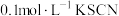 溶液,后通入
溶液,后通入 ,发现溶液
,发现溶液(3)该兴趣小组通过查阅资料,发现
 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体,写出上述实验中
和两种可直接排放到空气中的气体,写出上述实验中 被氧化的离子方程式:
被氧化的离子方程式:(4)根据题目所给信息及实验现象推断物质还原性强弱:

 (填“>”或“<”)
(填“>”或“<”)
您最近一年使用:0次
名校
解题方法
2 . 向仅含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法错误的是
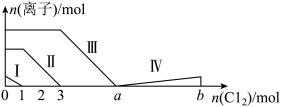

| A.线段Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表I-、Fe2+、Br-、HIO3的变化情况 |
| B.Fe2+、I-和Br-的物质的量之比为1∶2∶3 |
| C.根据图像可计算b=11 |
| D.线段Ⅳ对应的反应中氧化剂和还原剂的物质的量之比是5∶1 |
您最近一年使用:0次
2023-08-14更新
|
495次组卷
|
3卷引用:河北省迁安市第一中学2022-2023学年高三上学期期中考试化学试题
名校
3 . 向仅含有 、
、 、
、 的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。

提示:①不考虑 、
、 与水的反应;
与水的反应;
②不考虑气体的逸出;
③不考虑水电离出的 和
和 。
。
④产物只有 、
、 和
和 。
。
回答下列问题:
(1)
_______ ,曲线I对应的离子方程式为_______ 。
(2)b点溶液中,共含有_______ 种离子,分别为_______ (填离子符号)。
(3)
_______ ,曲线II对应的离子方程式为_______ 。
(4)c点溶液中,阳离子的总物质的量与阴离子的总物质的量之比为_______ 。
 、
、 、
、 的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
提示:①不考虑
 、
、 与水的反应;
与水的反应;②不考虑气体的逸出;
③不考虑水电离出的
 和
和 。
。④产物只有
 、
、 和
和 。
。回答下列问题:
(1)

(2)b点溶液中,共含有
(3)

(4)c点溶液中,阳离子的总物质的量与阴离子的总物质的量之比为
您最近一年使用:0次
2023-02-08更新
|
519次组卷
|
4卷引用:河北省保定市定州市第二中学2022-2023学年高一下学期开学考试化学试题
名校
4 . 某酸性溶液中可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 和
和 。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是

 、
、 、
、 、
、 、
、 、
、 、
、 、
、 和
和 。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
A.反应①发生反应的离子方程式为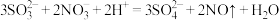 |
B.溶液中至少有6种离子大量存在,其中 一定存在,且 一定存在,且 |
C.溶液中可能含有 ,一定含有 ,一定含有 ,可取少量原溶液加入 ,可取少量原溶液加入 溶液检验 溶液检验 |
D. 、 、 、 、 一定存在, 一定存在, 、 、 一定不存在 一定不存在 |
您最近一年使用:0次
2022-11-17更新
|
1333次组卷
|
10卷引用:河北省石家庄市正定中学2022- 2023学年高二下学期期末考试化学试题
河北省石家庄市正定中学2022- 2023学年高二下学期期末考试化学试题百师联盟2023届高三上学期一轮复习联考(全国卷)化学试题宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题辽宁省葫芦岛市四校2022-2023学年高三上学期期中联考化学试题(已下线)专题03 离子反应方程式和离子共存(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题三 离子反应-实战高考·二轮复习核心突破(已下线)专题卷06 离子共存与离子推断-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)江西省百师联盟2024届高三上学期一轮复习联考化学试题江西省百师联盟2024届高三上学期9月复习联考化学试题黑龙江省海伦市第一中学2022-2023学年高三上学期1月期末考试化学试题
5 . 铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含Ru(CO3)2,还含少量的FeO、MgO、RuO4、CaO、SiO2]为原料制备钌(Ru)的流程如图。回答下列问题:
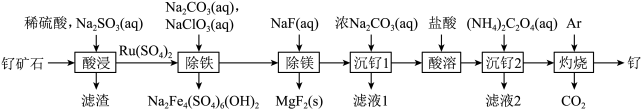
(1)Na2Fe4(SO4)6(OH)2中Fe的化合价为____ 。
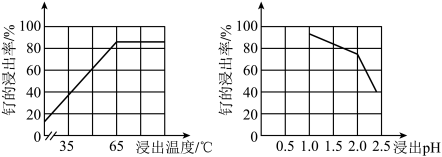
(2)“酸浸”时,Na2SO3的作用____ 。“滤渣”的主要成分有SiO2和____ (填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是____ 。
(3)“除铁”的离子方程式为____ 。(提示:1molNaClO3参与反应,转移6mol电子)
(4)从“滤液2”中可提取一种化肥,其电子式为____ 。
(5)“灼烧”时Ar的作用是____ 。
(6)某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为____ 。(保留三位有效数字)

(1)Na2Fe4(SO4)6(OH)2中Fe的化合价为
(2)“酸浸”时,Na2SO3的作用

(3)“除铁”的离子方程式为
(4)从“滤液2”中可提取一种化肥,其电子式为
(5)“灼烧”时Ar的作用是
(6)某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为
您最近一年使用:0次
2022-05-10更新
|
1870次组卷
|
15卷引用:河北省保定市2022届高三第二次模拟考试化学试题
河北省保定市2022届高三第二次模拟考试化学试题河南省新乡市2022届高三第三次模拟理科综合化学试题河南省名校联盟2022届高三下学期5月大联考理科综合化学试题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编广东省广州市海珠外国语实验中学2022-2023学年高三上学期第二次阶段性考试化学试题福建省福州第一中学2022-2023学年高三上学期检考前适应性考试化学试题湖南省株洲市北附高级中学2022-2023学年高三上学期第五次月考化学试题(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)考前特训 [综合大题分类规范练](已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题
6 . 某班同学用如下实验探究 与
与 的转化,回答下列问题,
的转化,回答下列问题,
(1)实验I: 转化为
转化为
实验步骤及现象;甲组同学将少量铜粉加入1mL 0.1mol/L 溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L
溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L
溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,
溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,
①分别取三组实验反应后的溶液于三支试管中_______ (填操作步骤以及现象),证明生成了 ;分析三组实验结果,实验中均发生的反应离子方程式为
;分析三组实验结果,实验中均发生的反应离子方程式为_________
②对比三组实验,说明加入蒸馏水后沉淀的产生与_________ 有关。
③向丙组实验后的溶液中加入饱和NaCl溶液可能出现的现象为_________ 。
④丙组在检验反应后的溶液中是否存在 时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i.
时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i. 的化学性质与
的化学性质与 相似,CuSCN为白色固体;ii.
相似,CuSCN为白色固体;ii. ,写出该实验中出现白色沉淀的离子方程式为
,写出该实验中出现白色沉淀的离子方程式为________ 。
(2)实验II: 转化为
转化为
实验步骤及现象:向3mL 0.1mol/L 溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知
溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知 (棕色)
(棕色)
⑤使用的 溶液中存在少量铁屑,其目的是
溶液中存在少量铁屑,其目的是___________ 。
⑥实验中产生NO的原因为___________ (用离子方程式表示)。
(3)实验III: 与
与 互转化
互转化
实验步骤及现象:将 通入足量
通入足量 溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入
溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入 溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为
溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为___________ 。
 与
与 的转化,回答下列问题,
的转化,回答下列问题,(1)实验I:
 转化为
转化为
实验步骤及现象;甲组同学将少量铜粉加入1mL 0.1mol/L
 溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L
溶液中,观察到铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象:乙组同学将过量铜粉加入1mL 0.1mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L
溶液中,观察到铜粉有剩余,溶液黄色褪去,加入蒸馏水后出现白色沉淀;丙组同学将过量铜粉加入1mL 0.05mol/L  溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,
溶液中,观察到铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀,①分别取三组实验反应后的溶液于三支试管中
 ;分析三组实验结果,实验中均发生的反应离子方程式为
;分析三组实验结果,实验中均发生的反应离子方程式为②对比三组实验,说明加入蒸馏水后沉淀的产生与
③向丙组实验后的溶液中加入饱和NaCl溶液可能出现的现象为
④丙组在检验反应后的溶液中是否存在
 时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i.
时,取反应后上层清液于试管中,滴加3滴KSCN溶液,结果出现白色沉淀,查阅资料:i. 的化学性质与
的化学性质与 相似,CuSCN为白色固体;ii.
相似,CuSCN为白色固体;ii. ,写出该实验中出现白色沉淀的离子方程式为
,写出该实验中出现白色沉淀的离子方程式为(2)实验II:
 转化为
转化为
实验步骤及现象:向3mL 0.1mol/L
 溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知
溶液中加入稍过量稀硝酸,溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色,已知 (棕色)
(棕色)⑤使用的
 溶液中存在少量铁屑,其目的是
溶液中存在少量铁屑,其目的是⑥实验中产生NO的原因为
(3)实验III:
 与
与 互转化
互转化实验步骤及现象:将
 通入足量
通入足量 溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入
溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入 溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为
溶液,则会产生白色沉淀。将产生的白色沉淀经过滤、洗涤、干燥后称量其质量为6.99g,则整个实验中产生的气体(假设只生成一种气体,该气体遇空气变为红棕色)在标准状况下体积为
您最近一年使用:0次
2021-10-17更新
|
355次组卷
|
2卷引用:河北省秦皇岛市昌黎汇文二中2022届高三9月月考化学试卷
名校
7 . 相同条件下,草酸根(C2 O )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:
资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在: [Fe(C2O4)3]3- Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21
(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为___________ ,B的作用为___________ 。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________ 。
(3)D中用NaOH溶液进行尾气处理,存在的问题是___________ 、___________ 。
(实验2)通过Fe3+和C2O 在溶液中的反应比较Fe2+ 和C2O
在溶液中的反应比较Fe2+ 和C2O 的还原性强弱。
的还原性强弱。
(4)取实验2中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是___________ 。
(5)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:______ _____ [Fe(C2O4)3]3-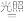 _______FeC2O4↓+_______↑+_______
_______FeC2O4↓+_______↑+_______
 )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在: [Fe(C2O4)3]3-
 Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是
(3)D中用NaOH溶液进行尾气处理,存在的问题是
(实验2)通过Fe3+和C2O
 在溶液中的反应比较Fe2+ 和C2O
在溶液中的反应比较Fe2+ 和C2O 的还原性强弱。
的还原性强弱。| 操作 | 现象 |
| 在避光处,向10mL 0.5 mol·L-1FeCl3溶液中缓慢加入0.5 mol·L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到亮绿色溶液和亮绿色晶体 |
(5)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:
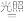 _______FeC2O4↓+_______↑+_______
_______FeC2O4↓+_______↑+_______
您最近一年使用:0次
8 . 工业上可用软锰矿(含少量铜化合物的MnO2)和黄铁矿(主要成分是FeS2、SiO2等)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工艺流程如图:

下列说法不正确的是

下列说法不正确的是
| A.研磨矿石、适当升高温度均可提高溶浸工序中原料的浸出率 |
| B.溶浸工序产生的废渣成分为S;净化工序产生的废渣成分为CaF2 |
| C.除铁工序中,试剂的加入顺序是先加软锰矿,再加石灰调节溶液pH |
| D.从沉锰工序中得到纯净MnCO3的操作方法是过滤、洗涤、干燥 |
您最近一年使用:0次
2021-04-29更新
|
1147次组卷
|
4卷引用:2021年河北省高考化学试卷变式题1-9题
2021年河北省高考化学试卷变式题1-9题山东省德州市2021届高三第二次模拟考试化学试题黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题(已下线)专题12 工艺流程选择题-备战2022年高考化学真题及地市好题专项集训【山东专用】
名校
9 . 工业废水中含有的重铬酸根离子(Cr2O )有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,反应的离子方程式为6Fe2++Cr2O
)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,反应的离子方程式为6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O,下列说法正确的是
+14H+=6Fe3++2Cr3++7H2O,下列说法正确的是
 )有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,反应的离子方程式为6Fe2++Cr2O
)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)作处理剂,反应的离子方程式为6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O,下列说法正确的是
+14H+=6Fe3++2Cr3++7H2O,下列说法正确的是| A.氧化剂与还原剂的物质的量之比为6:1 |
| B.用绿矾作处理剂,不仅可去除毒性,还可净水 |
| C.酸化试剂可以用盐酸或硫酸 |
| D.可以用草酸溶液代替绿矾作处理剂 |
您最近一年使用:0次
解题方法
10 . 下面是某课外小组从初选后的方铅矿【主要成分PbS,含少量黄铜矿(CuFeS2)】中提取硫磺、铜、铅的工艺流程:

已知:CuFeS2+4FeCl3=2S+5FeCl2+CuCl2、PbS+2FeCl3=S+PbCl2+2FeCl2
(1)黄铜矿( CuFeS2 )中Fe元素的化合价为______ ,提高方铅矿酸浸效率的措施有 ______ (写出两种方法即可)。
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、______ ;单质A是 ______ ,在此工艺操作中可循环利用的物质有铅和 ______ 。
(3)在酸性的FeCl2溶液中加入H2O2溶液,其反应的离子方程式为______ 。
(4)PbSO4与PbS加热条件下反应的化学方程式为______ 。
将沉淀PbSO4与足量的碳酸钠溶液混合,沉淀可转化可转化为PbCO3,写出该反应的平衡常数表达式:K=______ 。(已知Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14)
(5)铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为硫酸;铅蓄电池充放电的总反应方程式为:PbO2+Pb+2H2SO4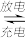 2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为
2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为 ______ 。

已知:CuFeS2+4FeCl3=2S+5FeCl2+CuCl2、PbS+2FeCl3=S+PbCl2+2FeCl2
(1)黄铜矿( CuFeS2 )中Fe元素的化合价为
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、
(3)在酸性的FeCl2溶液中加入H2O2溶液,其反应的离子方程式为
(4)PbSO4与PbS加热条件下反应的化学方程式为
将沉淀PbSO4与足量的碳酸钠溶液混合,沉淀可转化可转化为PbCO3,写出该反应的平衡常数表达式:K=
(5)铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为硫酸;铅蓄电池充放电的总反应方程式为:PbO2+Pb+2H2SO4
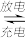 2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为
2PbSO4+2H2O,充电时,铅蓄电池阳极的电极反应式为
您最近一年使用:0次
2019-12-02更新
|
448次组卷
|
3卷引用:2015届河北省唐山市高三第二次模拟考试理综化学试卷



