1 . 某实验小组探究Fe2+与H2O2反应中滴加KSCN溶液变红色后又褪色的原因,提出如下假设:
a.Fe3+被H2O2还原 b.SCN-被O2氧化 c.SCN-被H2O2氧化。
设计如下实验,下列说法错误的是
a.Fe3+被H2O2还原 b.SCN-被O2氧化 c.SCN-被H2O2氧化。
设计如下实验,下列说法错误的是
| 实验 | 滴加试剂 | 现象 |
| I | i.向2mLFeCl2溶液中滴加2滴0.1mol·L-1KSCN溶液 ii.再滴加5滴5%H2O2溶液(物质的量浓度约为1.5mol·L-1、pH约为5) | i.无明显现象 ii.溶液变红,大约10秒左右红色褪去,并测得生成了两种可直接排放到空气中的气体 |
| II | iii.取褪色后溶液两份,一份滴加FeC13溶液;另一份滴加KSCN溶液 iV.取褪色后溶液,滴加盐酸和BaCl2溶液 | iii.一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色 iV.产生白色沉淀 |
| III | V.向2mL0.1mol·L-1FeCl3溶液中滴加2滴0.1mol·L-1KSCN溶液,观察现象;后通入O2,观察现象 | V.先变红,通入氧气后无明显变化 |
| A.实验I褪色后的溶液中n(H+)变小 | B.通过实验II、III可验证假设c正确 |
C.实验II证明SCN-被氧化成SO | D.实验III的目的是排除假设b |
您最近一年使用:0次
名校
2 . 向500 含
含 、
、 、
、 的溶液中缓慢通入
的溶液中缓慢通入 L
L (标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
(标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是

 含
含 、
、 、
、 的溶液中缓慢通入
的溶液中缓慢通入 L
L (标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
(标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
A.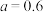 |
B. 时反应为 时反应为 |
C.原溶液中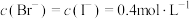 |
D.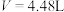 时总反应为 时总反应为 |
您最近一年使用:0次
2024-02-23更新
|
244次组卷
|
2卷引用:湖北省荆州八县市2023-2024学年高一上学期期末联考化学试题
解题方法
3 . 工业废水任意排放,是造成环境污染的最大祸首。协同去污,变废为宝,为处理工业废水提供了新思路。永固电镀厂产生大量含FeSO4、CuSO4的电镀废液,水光皮革厂产生大量含K2Cr2O7的废液。两厂联合处理废水,回收Cu并生产铁红和媒染剂Cr2(SO4)3•6H2O,工艺流程如图:
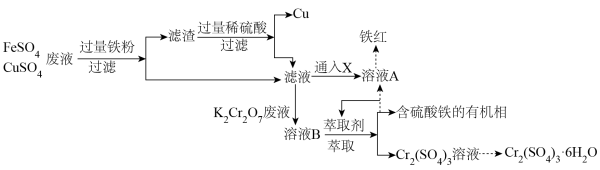
(1)K2Cr2O7中Cr元素的化合价为_______ 。
(2)处理滤渣时,要保持通风,并严禁烟火,其原因是_______ 。
(3)滤液可以通入X一步转化为溶液A,检验溶液A中金属阳离子的试剂是______ ,X可以是下列选项中的哪些物质_______ 。
A.CO2 B.O2 C.Cl2 D.SO2
(4)滤液与含K2Cr2O7的废液反应的离子方程式为_______ 。
(5)从Cr2(SO4)3溶液制取Cr2(SO4)3•6H2O晶体的实验操作方法为_______ 、_______ 、过滤、洗涤、干燥。
(6)已知Cr(OH)3化学性质与Al(OH)3类似,选择合适的化学试剂,将流程中的Cr2(SO4)3溶液转化为可用于陶瓷和搪瓷的着色剂Cr2O3(绿色粉末,广泛用于陶瓷和搪瓷的着色剂),转化过程中发生的主要的化学方程式为:_______ 、_______ 。

(1)K2Cr2O7中Cr元素的化合价为
(2)处理滤渣时,要保持通风,并严禁烟火,其原因是
(3)滤液可以通入X一步转化为溶液A,检验溶液A中金属阳离子的试剂是
A.CO2 B.O2 C.Cl2 D.SO2
(4)滤液与含K2Cr2O7的废液反应的离子方程式为
(5)从Cr2(SO4)3溶液制取Cr2(SO4)3•6H2O晶体的实验操作方法为
(6)已知Cr(OH)3化学性质与Al(OH)3类似,选择合适的化学试剂,将流程中的Cr2(SO4)3溶液转化为可用于陶瓷和搪瓷的着色剂Cr2O3(绿色粉末,广泛用于陶瓷和搪瓷的着色剂),转化过程中发生的主要的化学方程式为:
您最近一年使用:0次
名校
4 . 钴酸锂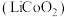 可用作锂离子电池的电极材料。以红土镍矿为原料制备
可用作锂离子电池的电极材料。以红土镍矿为原料制备 的工艺流程如图:
的工艺流程如图:

已知:①红土镍矿的主要成分有 、
、 、
、 、
、 、
、 、
、 等。
等。
②20℃时,生成氢氧化物沉淀的pH
注:金属离子起始浓度为0.1mol/L。
(1)上述流程中能加快反应速率的措施有_______ 。(写出两点)
(2) 的作用是将
的作用是将 氧化为
氧化为 。
。
①加入 发生反应的离子方程式是
发生反应的离子方程式是_______ 。
②滤渣2的主要成分是_______ (写化学式)。
(3)萃取剂RH可用于对溶液中的 、
、 的萃取率影响如图所示,萃取剂浓度的最佳取值约为
的萃取率影响如图所示,萃取剂浓度的最佳取值约为_______  。
。

(4)向反萃取后的水溶液中加入稍过量 ,得到
,得到 沉淀。将
沉淀。将 与
与 按
按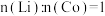 的比例混合,鼓入空气,高温烧结,得到
的比例混合,鼓入空气,高温烧结,得到 。
。
①得到 沉淀的离子方程式是
沉淀的离子方程式是_______ 。
②选择沉淀剂时,若不采用 而采用
而采用 ,产物中会混有
,产物中会混有 ,原因是
,原因是_______ 。
③在空气中烧结反应的化学方程式是_______ 。
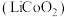 可用作锂离子电池的电极材料。以红土镍矿为原料制备
可用作锂离子电池的电极材料。以红土镍矿为原料制备 的工艺流程如图:
的工艺流程如图:
已知:①红土镍矿的主要成分有
 、
、 、
、 、
、 、
、 、
、 等。
等。②20℃时,生成氢氧化物沉淀的pH
| 离子 |  |  |  |  |  |
| 开始沉淀 | 7.0 | 1.9 | 3.4 | 7.2 | 7.1 |
| 沉淀完全 | 9.0 | 3.2 | 4.7 | 9.2 | 9.1 |
注:金属离子起始浓度为0.1mol/L。
(1)上述流程中能加快反应速率的措施有
(2)
 的作用是将
的作用是将 氧化为
氧化为 。
。①加入
 发生反应的离子方程式是
发生反应的离子方程式是②滤渣2的主要成分是
(3)萃取剂RH可用于对溶液中的
 、
、 的萃取率影响如图所示,萃取剂浓度的最佳取值约为
的萃取率影响如图所示,萃取剂浓度的最佳取值约为 。
。
(4)向反萃取后的水溶液中加入稍过量
 ,得到
,得到 沉淀。将
沉淀。将 与
与 按
按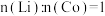 的比例混合,鼓入空气,高温烧结,得到
的比例混合,鼓入空气,高温烧结,得到 。
。①得到
 沉淀的离子方程式是
沉淀的离子方程式是②选择沉淀剂时,若不采用
 而采用
而采用 ,产物中会混有
,产物中会混有 ,原因是
,原因是③在空气中烧结反应的化学方程式是
您最近一年使用:0次
5 . 某同学用KSCN溶液和FeCl2溶液探究Fe2+的还原性时出现异常现象,实验如下:
下列说法错误的是( )
| ① | ② | ③ |
 | 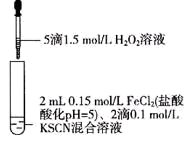 |  |
| 溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀 | 溶液变红且不褪色,有气体生成(经检验为O2),经检验有丁达尔效应。 | 溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,经检验无丁达尔效应。 |
| A.②中红色溶液中含有Fe(OH)3胶体 |
| B.实验②中发生的氧化还原反应只有两种 |
| C.对比①②③,可以判定酸性条件下H2O2可以氧化SCN- |
| D.③中发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O |
您最近一年使用:0次
2020-11-03更新
|
1839次组卷
|
15卷引用:武汉市第一中学2021-2022学年高三上学期10月月考化学试题
武汉市第一中学2021-2022学年高三上学期10月月考化学试题山西省太原市第五中学2020届高三10月月考化学试题2020届高考化学知识点必练——氧化还原反应的本质及相关概念2020届高三化学化学二轮复习——高考常考题:情境下氧化还原反应方程式书写【精编选择26题】北京市延庆区2019届高三第一次模拟考试化学试题山东省师范大学附属中学2021届高三上学期第二次考试化学试题辽宁省大连市一〇三中学2021届高三一模考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一12月月考化学试题(已下线)【浙江新东方】在线化学13江西省南昌市南昌县莲塘第一中学2021届高三上学期12月质量检测化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)山东省潍坊市实验中学2021-2022学年高三9月单元测试(入学考试)化学试题重庆市缙云教育联盟2023-2024学年高三下学期8月月考化学试题重庆市乌江新高考协作体2023-2024学年高一上学期11月期中化学试题
6 . 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示生成一种含氧酸(HIO3),且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法不正确的是( )
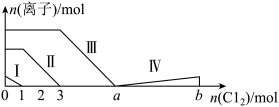

| A.线段Ⅱ表示Fe2+的变化情况 |
| B.线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O |
| C.根据图象可计算a=6 |
| D.原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶3 |
您最近一年使用:0次
2018-01-08更新
|
577次组卷
|
10卷引用:湖北省黄冈市重点校2022-2023学年高一下学期期末综合选拔性联考化学试题
湖北省黄冈市重点校2022-2023学年高一下学期期末综合选拔性联考化学试题山东省济宁市2017-2018学年度高三上学期期末考试化学试题山东省济宁市2018届高三上学期期末教学质量检测化学试题河北省定州中学2018届高三上学期期末考试化学试题(已下线)2019年高考化学一轮复习讲练测 2.4 氧化还原反应的规律及应用 讲【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高一下学期第一次月考(开学)化学试题黑龙江省黑河市逊克县第一中学2018-2019学年高一下学期第一次月考化学试题湖南省邵阳市邵东创新实验学校2021-2022学年高三上学期第一次月考化学试题陕西省西安市长安区第一中学2021-2022学年高二下学期期中考试化学试题(已下线)专题04 氧化还原反应及其应用(练)-2023年高考化学二轮复习讲练测(新高考专用)
12-13高三上·湖北黄冈·期末
名校
7 . 下列过程中,没有明显实验现象的是( )
| A.向Fe(NO3)2溶液中滴加稀硫酸 | B.将HCl通入NaAlO2溶液中 |
| C.加热溶有SO2的品红溶液 | D.向碳酸氢钠溶液中滴加氢氧化钠溶液 |
您最近一年使用:0次
2017-05-14更新
|
877次组卷
|
12卷引用:2012届湖北省黄冈市高三上学期期末考试理科综合_化学部分
(已下线)2012届湖北省黄冈市高三上学期期末考试理科综合_化学部分2016届河南省洛阳市高三上学期12月统考化学试卷2017届河北省景县中学高三上学期摸底考试化学试卷2017届河北邯郸市大名一中高三上学期第二次月考化学试卷2017届湖南省岳阳市华容县四校高三联考二化学试卷内蒙古赤峰市宁城县2017届高三第三次模拟考试理科综合化学试题河南省洛阳市2018届高三上学期第一次统一考试(12月)化学试题1河南省洛阳市2018届高三上学期第一次统一考试(12月)化学试题2吉林省桦甸市第八高级中学2019届高三第一次阶段性考试(8月)化学试题陕西省渭南中学2019届高三上学期第五次质量检测化学试题黑龙江省牡丹江市第三高级中学2020届高三上学期第一次月考化学试题山东省济宁市鱼台县第一中学2020届高三上学期期中考试化学试题



