名校
解题方法
1 . 有关反应的离子方程式书写正确的是(均充分反应)
A.向 明矾溶液中滴入几滴 明矾溶液中滴入几滴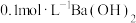 溶液: 溶液: |
B.向KI与稀硫酸的混合溶液中通入氧气: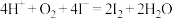 |
C. 溶液中通入 溶液中通入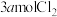 : :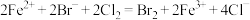 |
D.在澄清石灰水中加入少量碳酸氢镁(易溶)溶液: |
您最近一年使用:0次
名校
2 . 下列表示反应的离子方程式正确的是
A.向 溶液中通入过量的氯气: 溶液中通入过量的氯气: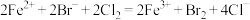 |
B. 溶液与少量的 溶液与少量的 溶液混合: 溶液混合: |
C.将 溶液滴入明矾 溶液滴入明矾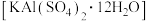 溶液中至沉淀质量最大: 溶液中至沉淀质量最大: |
D.用醋酸和淀粉-KI溶液检验加碘盐中的 : : |
您最近一年使用:0次
2023-07-19更新
|
1856次组卷
|
4卷引用:辽宁省东北育才学校2024届高三上学期高中学段联合考试化学试题
3 . 硅氯仿( ,熔点
,熔点 ,沸点
,沸点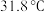 )遇水分解,易发生氧化反应,实验室利用硅粉和氯化氢在温度为
)遇水分解,易发生氧化反应,实验室利用硅粉和氯化氢在温度为 条件下制备硅氯仿。
条件下制备硅氯仿。
回答下列问题:
(1)实验室将 固体与浓
固体与浓 混合加热制取
混合加热制取 。
。

①选用图甲所示装置制取并收集一瓶纯净且干燥的 ,连接顺序为
,连接顺序为___________ (用小写字母表示,气流方向从左往右,个别装置可以多次选用)。
② 固体与浓
固体与浓 反应还生成一种酸式盐,该反应的化学方程式为
反应还生成一种酸式盐,该反应的化学方程式为___________ 。
(2)硅粉和氯化氢反应制备硅氯仿的装置如图乙所示(夹持仪器已略去)。

① 在空气中能够自燃,其中氢元素的化合价为
在空气中能够自燃,其中氢元素的化合价为___________ 。
②仪器A中发生反应的化学方程式为___________ 。
③设置装置B的目的是___________ 。
④C口需要连接丙装置的___________ (填“D”或“E”)口, 溶液的作用是:a.
溶液的作用是:a.___________ ;b.吸收氧气,防止氧气进入A中与硅氯仿反应,用离子方程式表示其吸收 的原理:
的原理:___________ 。
 ,熔点
,熔点 ,沸点
,沸点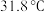 )遇水分解,易发生氧化反应,实验室利用硅粉和氯化氢在温度为
)遇水分解,易发生氧化反应,实验室利用硅粉和氯化氢在温度为 条件下制备硅氯仿。
条件下制备硅氯仿。回答下列问题:
(1)实验室将
 固体与浓
固体与浓 混合加热制取
混合加热制取 。
。
①选用图甲所示装置制取并收集一瓶纯净且干燥的
 ,连接顺序为
,连接顺序为②
 固体与浓
固体与浓 反应还生成一种酸式盐,该反应的化学方程式为
反应还生成一种酸式盐,该反应的化学方程式为(2)硅粉和氯化氢反应制备硅氯仿的装置如图乙所示(夹持仪器已略去)。

①
 在空气中能够自燃,其中氢元素的化合价为
在空气中能够自燃,其中氢元素的化合价为②仪器A中发生反应的化学方程式为
③设置装置B的目的是
④C口需要连接丙装置的
 溶液的作用是:a.
溶液的作用是:a. 的原理:
的原理:
您最近一年使用:0次
4 .  化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究
化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究 与
与 的反应机理,实验步骤如下:
的反应机理,实验步骤如下:
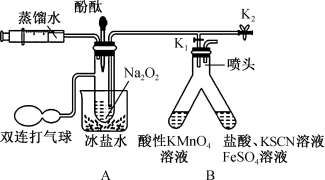
Ⅰ.打开 、
、 ,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);
,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);
Ⅱ.将部分液体转移至B中;
Ⅲ.向A剩余的溶液中滴加几滴酚酞试液。
请回答下列问题:
(1)“步骤Ⅱ”B中左侧溶液褪色且有气泡产生,右侧溶液变为红色。
①将部分液体转移至B中的具体操作为_______ 。
②右侧溶液变红色的原因是_______ (用离子方程式解释)。
③左侧 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
(2)若向“步骤Ⅱ”A的剩余溶液中加入 时,有大量气泡产生。
时,有大量气泡产生。
① 在该反应中的作用为
在该反应中的作用为_______ 。
②“步骤Ⅲ”的现象为_______ ;由此推测 与
与 反应的第一步为
反应的第一步为_______ (写出化学方程式)。
(3)过氧化钠可与铝粉发生反应: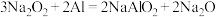 ,该反应可以体现
,该反应可以体现 具有
具有_______ (填“氧化性”、“还原性”或“既有氧化性,也有还原性”)。
 化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究
化学性质活泼,能与许多物质反应。某实验小组利用下列装置(夹持装置已省略)探究 与
与 的反应机理,实验步骤如下:
的反应机理,实验步骤如下:
Ⅰ.打开
 、
、 ,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);
,通过注射器注入适量蒸馏水,使固体全部溶解(未见气泡产生);Ⅱ.将部分液体转移至B中;
Ⅲ.向A剩余的溶液中滴加几滴酚酞试液。
请回答下列问题:
(1)“步骤Ⅱ”B中左侧溶液褪色且有气泡产生,右侧溶液变为红色。
①将部分液体转移至B中的具体操作为
②右侧溶液变红色的原因是
③左侧
 参与反应的离子方程式为
参与反应的离子方程式为(2)若向“步骤Ⅱ”A的剩余溶液中加入
 时,有大量气泡产生。
时,有大量气泡产生。①
 在该反应中的作用为
在该反应中的作用为②“步骤Ⅲ”的现象为
 与
与 反应的第一步为
反应的第一步为(3)过氧化钠可与铝粉发生反应:
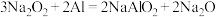 ,该反应可以体现
,该反应可以体现 具有
具有
您最近一年使用:0次
2023-01-04更新
|
772次组卷
|
3卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
名校
5 . 某酸性溶液中可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 和
和 。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是

 、
、 、
、 、
、 、
、 、
、 、
、 、
、 和
和 。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
A.反应①发生反应的离子方程式为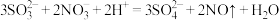 |
B.溶液中至少有6种离子大量存在,其中 一定存在,且 一定存在,且 |
C.溶液中可能含有 ,一定含有 ,一定含有 ,可取少量原溶液加入 ,可取少量原溶液加入 溶液检验 溶液检验 |
D. 、 、 、 、 一定存在, 一定存在, 、 、 一定不存在 一定不存在 |
您最近一年使用:0次
2022-11-17更新
|
1333次组卷
|
10卷引用:辽宁省葫芦岛市四校2022-2023学年高三上学期期中联考化学试题
辽宁省葫芦岛市四校2022-2023学年高三上学期期中联考化学试题百师联盟2023届高三上学期一轮复习联考(全国卷)化学试题宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题(已下线)专题03 离子反应方程式和离子共存(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题三 离子反应-实战高考·二轮复习核心突破(已下线)专题卷06 离子共存与离子推断-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)河北省石家庄市正定中学2022- 2023学年高二下学期期末考试化学试题江西省百师联盟2024届高三上学期一轮复习联考化学试题江西省百师联盟2024届高三上学期9月复习联考化学试题黑龙江省海伦市第一中学2022-2023学年高三上学期1月期末考试化学试题
6 . 碘及其化合物广泛用于医药、染料等方面。碘酸是一种强酸,其水溶液有强氧化性。已知氧化性: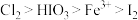 。回答下列问题:
。回答下列问题:
(1)一种以含有少量 的废液为原料制备
的废液为原料制备 的方法如图所示。
的方法如图所示。
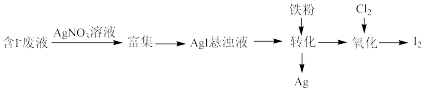
①“转化”生成的Ag溶于稀硝酸可获得硝酸银,写出Ag与稀硝酸反应的离子方程式:___________ 。
②通入 的过程中,若
的过程中,若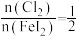 ,则反应中被氧化的元素为
,则反应中被氧化的元素为___________ (填元素符号);当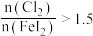 后,单质碘的产率会降低,原因是
后,单质碘的产率会降低,原因是___________ 。
(2)大量的碘由自然界的 与还原剂
与还原剂 反应制得,则该制备
反应制得,则该制备 的反应中的氧化剂和还原剂的物质的量之比为
的反应中的氧化剂和还原剂的物质的量之比为___________ 。
(3)卤素互化物 可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:
可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:___________ 。
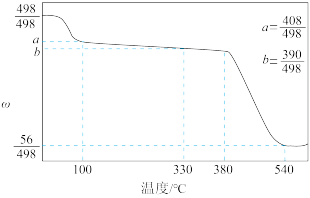
(4)碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水。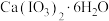 加热升温过程中剩余固体的质量分数w(
加热升温过程中剩余固体的质量分数w( )随温度变化的关系如图所示。为获得无水碘酸钙,可将
)随温度变化的关系如图所示。为获得无水碘酸钙,可将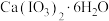 晶体
晶体___________ (填实验操作)。若将加热温度提高至540℃,则此时得到固体的主要成分为___________ (填化学式)。
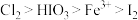 。回答下列问题:
。回答下列问题:(1)一种以含有少量
 的废液为原料制备
的废液为原料制备 的方法如图所示。
的方法如图所示。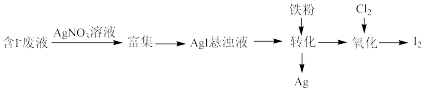
①“转化”生成的Ag溶于稀硝酸可获得硝酸银,写出Ag与稀硝酸反应的离子方程式:
②通入
 的过程中,若
的过程中,若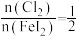 ,则反应中被氧化的元素为
,则反应中被氧化的元素为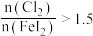 后,单质碘的产率会降低,原因是
后,单质碘的产率会降低,原因是(2)大量的碘由自然界的
 与还原剂
与还原剂 反应制得,则该制备
反应制得,则该制备 的反应中的氧化剂和还原剂的物质的量之比为
的反应中的氧化剂和还原剂的物质的量之比为(3)卤素互化物
 可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:
可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:(4)碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水。
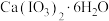 加热升温过程中剩余固体的质量分数w(
加热升温过程中剩余固体的质量分数w( )随温度变化的关系如图所示。为获得无水碘酸钙,可将
)随温度变化的关系如图所示。为获得无水碘酸钙,可将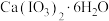 晶体
晶体
您最近一年使用:0次
2022-09-26更新
|
369次组卷
|
4卷引用:辽宁省协作校2022-2023学年高二上学期第一次考试化学试题
名校
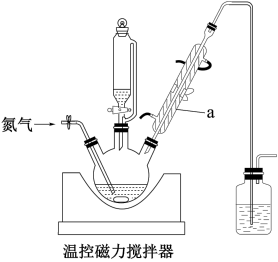
7 . Fe/Fe3O4磁性材料在很多领域具有应用前景,其制备过程如下(各步均在N2氛围中进行):
①称取9.95g FeCl2·4H2O(Mr =199),配成50mL溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入100mL14mol· L-1KOH溶液。
③持续磁力搅拌,将FeCl2溶液以2mL·min-1的速度全部滴入三颈烧瓶中,100°C 下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在40°C干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:
回答下列问题:
(1)仪器a的名称是_______ ;使用恒压滴液漏斗的原因是_______ 。
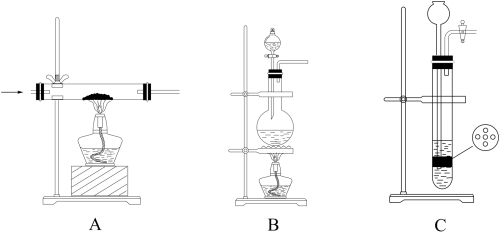
(2)实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合以下供选试剂和装置,选出一种可行的方法,化学方程式为_______ ,对应的装置为_______ (填标号)。
可供选择的试剂:CuO(s)、 NH3(g)、 Cl2(g)、 O2(g)、 饱和NaNO2(aq)、饱和NH4Cl(aq)可供选择的发生装置(净化装置略去):
(3)三颈烧瓶中反应生成了Fe和Fe3O4,离子方程式为_______ 。
(4)为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。
(5)步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为_______ ;
(6)该实验所得磁性材料的产率为_______ (保留 3位有效数字)。
①称取9.95g FeCl2·4H2O(Mr =199),配成50mL溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入100mL14mol· L-1KOH溶液。
③持续磁力搅拌,将FeCl2溶液以2mL·min-1的速度全部滴入三颈烧瓶中,100°C 下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在40°C干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
(1)仪器a的名称是
(2)实验室制取N2有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合以下供选试剂和装置,选出一种可行的方法,化学方程式为
可供选择的试剂:CuO(s)、 NH3(g)、 Cl2(g)、 O2(g)、 饱和NaNO2(aq)、饱和NH4Cl(aq)可供选择的发生装置(净化装置略去):

(3)三颈烧瓶中反应生成了Fe和Fe3O4,离子方程式为
(4)为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。
| A.采用适宜的滴液速度 |
| B.用盐酸代替KOH溶液,抑制Fe2+水解 |
| C.在空气氛围中制备 |
| D.选择适宜的焙烧温度 |
(6)该实验所得磁性材料的产率为
您最近一年使用:0次
2022-04-17更新
|
383次组卷
|
2卷引用:辽宁省沈阳市第五中学2021-2022学年高三下学期3月月考化学试题
解题方法
8 . 实验室测定氧化物X(FexO)的组成实验如下:

下列有关说法正确的是

下列有关说法正确的是
| A.根据步骤I、II可判断X的组成为Fe0.8O |
| B.溶液Y中c(Fe2+):c(Fe3+)=1:2 |
| C.溶液Z中的离子只有Fe3+和Cl- |
| D.样品X中氧元素的质量分数约为27.6% |
您最近一年使用:0次
2022-01-13更新
|
468次组卷
|
2卷引用:辽宁省协作校2021-2022学年高一上学期期末考试化学试题
9 . 化合物X在一定条件下可发生如图转化,有关叙述错误的是


A.溶液C到溶液D中发生的离子方程式为:Fe3++3SCN— Fe(SCN)3 Fe(SCN)3 |
| B.E为CO,物质的量为0.05mol |
| C.X为Fe(CO)4 |
| D.过量的稀硫酸若换成盐酸,会造成环境污染 |
您最近一年使用:0次
2021-06-30更新
|
2098次组卷
|
7卷引用:辽宁省实验中学2022届高三第一次阶段性考试化学试题
辽宁省实验中学2022届高三第一次阶段性考试化学试题安徽省淮北市2021届高三第一次模拟考试化学试题(已下线)专题三 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题06 常见金属及其化合物-备战2022年高考化学学霸纠错(全国通用)(已下线)专题14物质的反应和转化-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题13物质的反应和转化-2022年高考真题+模拟题汇编(全国卷)(已下线)专题14物质的反应和转化-五年(2018~2022)高考真题汇编(全国卷)
解题方法
10 .  可用于医药、食品、造纸、催化剂等行业。工业上可以用软锰矿(主要成分是
可用于医药、食品、造纸、催化剂等行业。工业上可以用软锰矿(主要成分是 、含有
、含有 、
、 、
、 、
、 、
、 等少量杂质)和还原剂(主要为有机物,如纤维素等)为原料制备。其工业流程如下:
等少量杂质)和还原剂(主要为有机物,如纤维素等)为原料制备。其工业流程如下:

(1)酸浸时加入稍过量 溶液的目的是
溶液的目的是_______ 。
(2)操作1中,加入 氧化
氧化 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)滤渣2的主要成分是_______ (填化学式)。
(4)为测定某软锰矿中 的质量分数,准确称量
的质量分数,准确称量 软锰矿样品,加入
软锰矿样品,加入 固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到
固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到 容量瓶中用蒸馏水稀释至刻度,从中取出
容量瓶中用蒸馏水稀释至刻度,从中取出 ,用
,用 溶液进行滴定,当滴入
溶液进行滴定,当滴入 溶液时恰好完全反应。已知:
溶液时恰好完全反应。已知: (未配平)。
(未配平)。
计算软锰矿中 的质量分数(写出计算过程)
的质量分数(写出计算过程)_______ 。
 可用于医药、食品、造纸、催化剂等行业。工业上可以用软锰矿(主要成分是
可用于医药、食品、造纸、催化剂等行业。工业上可以用软锰矿(主要成分是 、含有
、含有 、
、 、
、 、
、 、
、 等少量杂质)和还原剂(主要为有机物,如纤维素等)为原料制备。其工业流程如下:
等少量杂质)和还原剂(主要为有机物,如纤维素等)为原料制备。其工业流程如下:
(1)酸浸时加入稍过量
 溶液的目的是
溶液的目的是(2)操作1中,加入
 氧化
氧化 ,反应的离子方程式为
,反应的离子方程式为(3)滤渣2的主要成分是
(4)为测定某软锰矿中
 的质量分数,准确称量
的质量分数,准确称量 软锰矿样品,加入
软锰矿样品,加入 固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到
固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到 容量瓶中用蒸馏水稀释至刻度,从中取出
容量瓶中用蒸馏水稀释至刻度,从中取出 ,用
,用 溶液进行滴定,当滴入
溶液进行滴定,当滴入 溶液时恰好完全反应。已知:
溶液时恰好完全反应。已知: (未配平)。
(未配平)。计算软锰矿中
 的质量分数(写出计算过程)
的质量分数(写出计算过程)
您最近一年使用:0次



