名校
1 . 下列实验中的现象及现象过程中与氧化还原反应无关的是
| 选项 | A | B | C | D |
| 实验 | 过量的硫酸亚铁溶液加入到高锰酸钾溶液中 | 向碳酸钠溶液中边振荡边滴加稀盐酸直至过量 | 漂白粉长期暴露在潮湿的空气中 | 紫色石蕊试液滴入新制氯水中 |
| 现象及现象过程中 | 紫色褪去,溶液最终变为浅黄色 | 最初没有现象,继续滴加稀盐酸产生气泡 | 白色粉末失效最终变成团块,无法均匀地溶解在水中 | 最初没有现象,继续滴加稀盐酸产生气泡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列关于Na2O和Na2O2的叙述正确的是
| A.将Na2O与Na2O2分别加入滴有酚酞的水中,二者现象相同 |
| B.在Na2O2与水的反应中,氧化产物与还原产物物质的量之比为1:4 |
| C.将Na2O2分别加入FeCl3和FeCl2溶液中最终所得沉淀颜色相同 |
| D.等质量的Na2O与Na2O2投入等量且足量水中充分反应后所得溶液物质的量浓度相等 |
您最近一年使用:0次
2023-06-20更新
|
424次组卷
|
3卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题
名校
3 . 向 100 mL 3.0 mol/L 的FeBr2溶液中逐渐通入Cl2,其中 n(Fe3+)、n(Fe2+)、n(Br-) 随通入Cl2的物质的量 n(Cl2)变化如图所示,下列说法错误的是
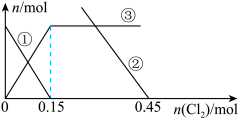
注意:②代表离子的物质的量变化图没有完全画出

注意:②代表离子的物质的量变化图没有完全画出
| A.②代表Br-,③代表Fe3+ |
| B.还原性强弱:Fe2+>Br- |
| C.n(Cl2)=0.5 mol时,总的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| D.n(Cl2)=0.35 mol时,溶液中c(Fe3+)=c(Br-) |
您最近一年使用:0次
解题方法
4 . 下列离子方程式正确的是
A.NaHCO3溶液中加入少量的石灰水HCO +Ca2++OH-=CaCO3↓+H2O +Ca2++OH-=CaCO3↓+H2O |
| B.FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| C.次氯酸钙溶液中通入二氧化硫:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
D.氯气与水反应:Cl2+H2O 2H++Cl-+ClO- 2H++Cl-+ClO- |
您最近一年使用:0次
解题方法
5 . Ⅰ)下表是某儿童在饶河县医院临床检验结果报告单的部分数据:
根据上表的数据,回答下列问题。
(1)该儿童_______ 元素含量偏低(填元素名称)。
(2)报告单中“mol·L-1”是_______ (填“质量”、“体积”或“浓度”)的单位。
Ⅱ)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
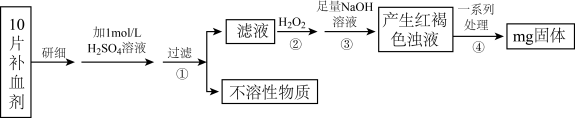
请回答下列问题:
(3)步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有_______ (填离子符号)。
(4)步骤②加入过量H2O2的目的是_______ 。步骤②反应的离子方程式为_______ 。
(5)服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的_______ 。(填“氧化性”或“还原性”)。
(6)由FeSO4·7H2O固体配制500mL0.10 mol/L FeSO4溶液,以下操作会导致所配溶液浓度偏低的是_______ 。(填序号)
A.容量瓶中原有少量蒸馏水 B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线 D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
E.用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
(7)若向FeSO4溶液中加入足量Na2O2,观察到的现象是_______ 。
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | mol·L-l | 66-120 |
| 2 | 铁(Fe) | 6.95 | mmol·L-1 | 7.52-11.82 |
| 3 | 钙(Ca) | 1.78 | mmol·L-1 | 1.55-2.10 |
(1)该儿童
(2)报告单中“mol·L-1”是
Ⅱ)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(3)步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有
(4)步骤②加入过量H2O2的目的是
(5)服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的
(6)由FeSO4·7H2O固体配制500mL0.10 mol/L FeSO4溶液,以下操作会导致所配溶液浓度偏低的是
A.容量瓶中原有少量蒸馏水 B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线 D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
E.用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
(7)若向FeSO4溶液中加入足量Na2O2,观察到的现象是
您最近一年使用:0次
名校
6 . 某酸性溶液中可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 和
和 。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是

 、
、 、
、 、
、 、
、 、
、 、
、 、
、 和
和 。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
。某同学为了确认其成分,设计并完成了如图实验。下列叙述正确的是
A.反应①发生反应的离子方程式为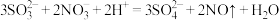 |
B.溶液中至少有6种离子大量存在,其中 一定存在,且 一定存在,且 |
C.溶液中可能含有 ,一定含有 ,一定含有 ,可取少量原溶液加入 ,可取少量原溶液加入 溶液检验 溶液检验 |
D. 、 、 、 、 一定存在, 一定存在, 、 、 一定不存在 一定不存在 |
您最近一年使用:0次
2022-11-17更新
|
1333次组卷
|
10卷引用:黑龙江省海伦市第一中学2022-2023学年高三上学期1月期末考试化学试题
黑龙江省海伦市第一中学2022-2023学年高三上学期1月期末考试化学试题百师联盟2023届高三上学期一轮复习联考(全国卷)化学试题宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题辽宁省葫芦岛市四校2022-2023学年高三上学期期中联考化学试题(已下线)专题03 离子反应方程式和离子共存(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题三 离子反应-实战高考·二轮复习核心突破(已下线)专题卷06 离子共存与离子推断-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)河北省石家庄市正定中学2022- 2023学年高二下学期期末考试化学试题江西省百师联盟2024届高三上学期一轮复习联考化学试题江西省百师联盟2024届高三上学期9月复习联考化学试题
7 . 工业上可用软锰矿(含少量铜化合物的MnO2)和黄铁矿(主要成分是FeS2、SiO2等)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工艺流程如图:

下列说法不正确的是

下列说法不正确的是
| A.研磨矿石、适当升高温度均可提高溶浸工序中原料的浸出率 |
| B.溶浸工序产生的废渣成分为S;净化工序产生的废渣成分为CaF2 |
| C.除铁工序中,试剂的加入顺序是先加软锰矿,再加石灰调节溶液pH |
| D.从沉锰工序中得到纯净MnCO3的操作方法是过滤、洗涤、干燥 |
您最近一年使用:0次
2021-04-29更新
|
1147次组卷
|
4卷引用:黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题
黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题山东省德州市2021届高三第二次模拟考试化学试题(已下线)专题12 工艺流程选择题-备战2022年高考化学真题及地市好题专项集训【山东专用】2021年河北省高考化学试卷变式题1-9题
8 . 某同学用KSCN溶液和FeCl2溶液探究Fe2+的还原性时出现异常现象,实验如下:
下列说法错误的是( )
| ① | ② | ③ |
 | 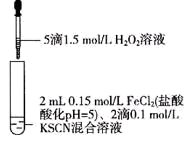 |  |
| 溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀 | 溶液变红且不褪色,有气体生成(经检验为O2),经检验有丁达尔效应。 | 溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,经检验无丁达尔效应。 |
| A.②中红色溶液中含有Fe(OH)3胶体 |
| B.实验②中发生的氧化还原反应只有两种 |
| C.对比①②③,可以判定酸性条件下H2O2可以氧化SCN- |
| D.③中发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O |
您最近一年使用:0次
2020-11-03更新
|
1839次组卷
|
15卷引用:黑龙江省哈尔滨市第六中学2020-2021学年高一12月月考化学试题
黑龙江省哈尔滨市第六中学2020-2021学年高一12月月考化学试题山西省太原市第五中学2020届高三10月月考化学试题2020届高考化学知识点必练——氧化还原反应的本质及相关概念2020届高三化学化学二轮复习——高考常考题:情境下氧化还原反应方程式书写【精编选择26题】北京市延庆区2019届高三第一次模拟考试化学试题山东省师范大学附属中学2021届高三上学期第二次考试化学试题辽宁省大连市一〇三中学2021届高三一模考试化学试题(已下线)【浙江新东方】在线化学13江西省南昌市南昌县莲塘第一中学2021届高三上学期12月质量检测化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)山东省潍坊市实验中学2021-2022学年高三9月单元测试(入学考试)化学试题武汉市第一中学2021-2022学年高三上学期10月月考化学试题重庆市缙云教育联盟2023-2024学年高三下学期8月月考化学试题重庆市乌江新高考协作体2023-2024学年高一上学期11月期中化学试题
名校
解题方法
9 . 某溶液X中可能含有 、
、 、
、 、
、 、
、 、
、 和
和 中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验,下列说法错误的是
中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验,下列说法错误的是

 、
、 、
、 、
、 、
、 、
、 和
和 中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验,下列说法错误的是
中的几种,且所含阴离子的物质的量相等。为确定该溶液X的成分,某学习小组做了如下实验,下列说法错误的是
A.产生气体乙的方程式为: |
| B.气体甲能使湿润的红色石蕊试纸变蓝 |
C. 、 、 一定存在, 一定存在, 和 和 可能都存在 可能都存在 |
D.该溶液中只存在上述离子中的 、 、 、 、 、 、 四种离子 四种离子 |
您最近一年使用:0次
2020-10-26更新
|
685次组卷
|
3卷引用:黑龙江省哈尔滨三中2021届高三上学期期中考试化学试题
名校
解题方法
10 . 焦锑酸钠(NaSbO3·3H2O)可用于搪瓷的乳白剂及铁皮、钢板的抗酸漆。一种利用高砷锑烟灰(主要成分为Sb2O3、As2O3,还含Ag、Cu、Fe的氧化物)生产焦锑酸钠的工艺流程如下:
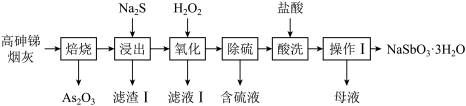
已知:i.Sb2O3、As2O3部分性质如下表:
ii.Ag、Cu、Fe的氧化物不溶于Na2S溶液
iii.Na2SbO4不溶于水;NaSbO3﹒3H2O既不溶于水,也不溶于酸。
请回答下列问题:
(1)“焙烧”的最低温度为_________ (填标号)
a.655℃ b.400℃ c.275℃ d.193℃
(2)“浸出”时,往往采取比常温稍高的浸液温度,且选用较高浓度的Na2S溶液,采取这些措施的目的是_________________________________________ 。“浸出”时,Sb2O3转化为Na3SbS3的化学方程式为__________________________________________ ,滤渣Ⅰ是____________ 。
(3)“氧化”时所用H2O2的电子式为___________ ,氧化产物为Na3SbO4和____________ .
(4)“酸洗”的作用是______________________ 。(用化学方程式表示)
(5)As2O3对应的酸为H3AsO3,测得某工业酸性废液中含H3AsO3和Fe2+,其浓度如表:
已知:iV.Ksp(FeAsO3)>Ksp(FeAsO4)=5.70×10-21。
V.H3AsO3的还原性比Fe2+强。
根据题目信息,则可采用______________ 方法除去该废水中的砷,除去砷后的废液中c(AsO43-)=__________________ (不考虑反应过程中溶液体积的微小变化)

已知:i.Sb2O3、As2O3部分性质如下表:
熔点/℃ | 沸点/℃ | 升华/℃ | |
Sb2O3 | 655 | 1550 | 400 |
As2O3 | 275 | 457 | 193 |
ii.Ag、Cu、Fe的氧化物不溶于Na2S溶液
iii.Na2SbO4不溶于水;NaSbO3﹒3H2O既不溶于水,也不溶于酸。
请回答下列问题:
(1)“焙烧”的最低温度为
a.655℃ b.400℃ c.275℃ d.193℃
(2)“浸出”时,往往采取比常温稍高的浸液温度,且选用较高浓度的Na2S溶液,采取这些措施的目的是
(3)“氧化”时所用H2O2的电子式为
(4)“酸洗”的作用是
(5)As2O3对应的酸为H3AsO3,测得某工业酸性废液中含H3AsO3和Fe2+,其浓度如表:
物质 | H3AsO3 | Fe2+ |
浓度/g·L-1 | 0.378 | 0.840 |
已知:iV.Ksp(FeAsO3)>Ksp(FeAsO4)=5.70×10-21。
V.H3AsO3的还原性比Fe2+强。
根据题目信息,则可采用
您最近一年使用:0次



