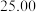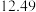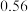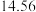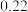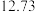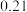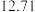1 . 丙烯(分子式为C3H6)是重要的有机化工原料,丙烷(分子式为C3H8)脱氢制丙烯具有显著的经济价值和社会意义。
(1)已知:Ⅰ.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) △H=-238kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g) C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为
C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为_______ kJ·mol-1(用带有a的代数式表示)。
(2)一定温度下,向恒容密闭容器中充入2molC3H8,发生丙烷脱氢制丙烯反应,容器内起始压强为2×10-5Pa。
①欲提高丙烷转化率,采取的措施是_______ (填标号)。
A.升高温度 B.再充入1molC3H8 C.加催化剂 D.及时分离出H2
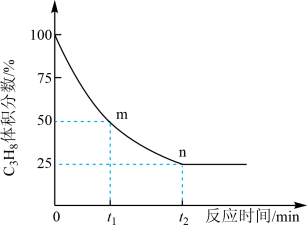
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图所示_______ Pa(Kp是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×物质的量分数)。
(3)若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始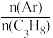 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是_______ 。
(4)以丙烷(C3H8)为燃料制作新型燃料电池,电解质是熔融碳酸盐。则电池负极的电极反应式为_______ 。
(1)已知:Ⅰ.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) △H=-238kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g)
 C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为
C3H6(g)+H2(g)的正反应的活化能为akJ·mol-1,则该反应的逆反应的活化能为(2)一定温度下,向恒容密闭容器中充入2molC3H8,发生丙烷脱氢制丙烯反应,容器内起始压强为2×10-5Pa。
①欲提高丙烷转化率,采取的措施是
A.升高温度 B.再充入1molC3H8 C.加催化剂 D.及时分离出H2
②丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图所示
(3)若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始
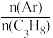 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是(4)以丙烷(C3H8)为燃料制作新型燃料电池,电解质是熔融碳酸盐。则电池负极的电极反应式为
您最近一年使用:0次
23-24高一下·全国·期末
2 . 回答下列问题:
(1)用20% H2SO4浸取软锰矿(主要成分为MnO2、SiO2等)制备高纯MnO2,酸浸时,通常加入FeSO4作催化剂加快反应速率。为提高酸浸速率,还可以采取的措施有______________ (写一种)。
(2)工业上用稀硫酸浸取碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)生产锰酸锂(LiMn2O4),为了提高碳酸锰矿浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_______________ 等。
(3)用NaOH熔盐高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)制备白色颜料TiO2,为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是________________ 。
(1)用20% H2SO4浸取软锰矿(主要成分为MnO2、SiO2等)制备高纯MnO2,酸浸时,通常加入FeSO4作催化剂加快反应速率。为提高酸浸速率,还可以采取的措施有
(2)工业上用稀硫酸浸取碳酸锰矿(主要成分为MnCO3,另含FeO、Fe2O3、CaO等杂质)生产锰酸锂(LiMn2O4),为了提高碳酸锰矿浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③
(3)用NaOH熔盐高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)制备白色颜料TiO2,为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是
您最近一年使用:0次
名校
解题方法
3 . 零价铁活化过硫酸盐耦合类芬顿体系可以产生强氧化性的羟基自由基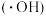 和硫酸根自由基(
和硫酸根自由基( ),被用于氧化降解废水中的抗生素。
),被用于氧化降解废水中的抗生素。
(1)该体系中产生自由基的机理如图所示。 在碱性溶液中可转化为
在碱性溶液中可转化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(2)为探究体系中 和
和 降解抗生素的能力,设计了自由基猝灭实验。
降解抗生素的能力,设计了自由基猝灭实验。 是
是 和
和 的猝灭剂,能与
的猝灭剂,能与 、
、 快速反应;
快速反应;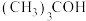 是
是 的猝灭剂,难和
的猝灭剂,难和 反应。零价铁活化过硫酸盐耦合类芬顿体系处理废水时分别加入上述猝灭剂,抗生素残留率与时间的关系如图所示。
反应。零价铁活化过硫酸盐耦合类芬顿体系处理废水时分别加入上述猝灭剂,抗生素残留率与时间的关系如图所示。 反应的原理是
反应的原理是 拔走了甲醇中的一个H原子,生成一个新的自由基,可能产物的相对能量如图所示,该反应最有可能的方程式为
拔走了甲醇中的一个H原子,生成一个新的自由基,可能产物的相对能量如图所示,该反应最有可能的方程式为___________ 。___________ 。
③降解抗生素的自由基主要是哪个,简述理由___________ 。
(3)探究 (PDS)的物质的量分数对抗生素去除率的影响。在
(PDS)的物质的量分数对抗生素去除率的影响。在 的废水中,PDS和H2O2总浓度为
的废水中,PDS和H2O2总浓度为 ,相同时间内,PDS的物质的量分数与抗生素残留率的关系如图所示。
,相同时间内,PDS的物质的量分数与抗生素残留率的关系如图所示。___________ 。
②PDS的物质的量分数降到0%时,抗生素残留率升高的原因是___________ 。
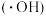 和硫酸根自由基(
和硫酸根自由基( ),被用于氧化降解废水中的抗生素。
),被用于氧化降解废水中的抗生素。(1)该体系中产生自由基的机理如图所示。

① 的结构为
的结构为 ,
, 的结构式为
的结构式为
 在碱性溶液中可转化为
在碱性溶液中可转化为 ,该反应的离子方程式为
,该反应的离子方程式为(2)为探究体系中
 和
和 降解抗生素的能力,设计了自由基猝灭实验。
降解抗生素的能力,设计了自由基猝灭实验。 是
是 和
和 的猝灭剂,能与
的猝灭剂,能与 、
、 快速反应;
快速反应;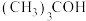 是
是 的猝灭剂,难和
的猝灭剂,难和 反应。零价铁活化过硫酸盐耦合类芬顿体系处理废水时分别加入上述猝灭剂,抗生素残留率与时间的关系如图所示。
反应。零价铁活化过硫酸盐耦合类芬顿体系处理废水时分别加入上述猝灭剂,抗生素残留率与时间的关系如图所示。
 反应的原理是
反应的原理是 拔走了甲醇中的一个H原子,生成一个新的自由基,可能产物的相对能量如图所示,该反应最有可能的方程式为
拔走了甲醇中的一个H原子,生成一个新的自由基,可能产物的相对能量如图所示,该反应最有可能的方程式为
③降解抗生素的自由基主要是哪个,简述理由
(3)探究
 (PDS)的物质的量分数对抗生素去除率的影响。在
(PDS)的物质的量分数对抗生素去除率的影响。在 的废水中,PDS和H2O2总浓度为
的废水中,PDS和H2O2总浓度为 ,相同时间内,PDS的物质的量分数与抗生素残留率的关系如图所示。
,相同时间内,PDS的物质的量分数与抗生素残留率的关系如图所示。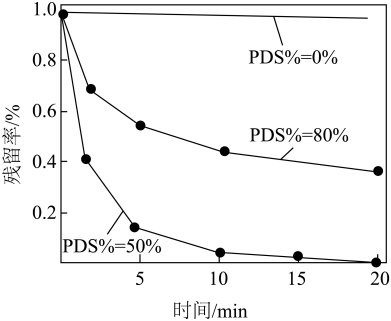
②PDS的物质的量分数降到0%时,抗生素残留率升高的原因是
您最近一年使用:0次
名校
4 . 为改变生橡胶受热发黏遇冷变硬的不良性能,工业上常将橡胶硫化来改善橡胶的性能, 和
和 均为改善橡胶性能的重要化工产品。
均为改善橡胶性能的重要化工产品。
(1)已知下列化学键的键能及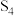 的结构式
的结构式
则反应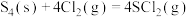 中生成
中生成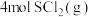 时放出
时放出___________ kJ热量。 的电子式是
的电子式是___________ 。
(3) 易与水发生反应,反应中只有一种元素的化合价发生变化,产生无色有刺激性气味的气体,同时有淡黄色沉淀生成,写出此反应的化学方程式
易与水发生反应,反应中只有一种元素的化合价发生变化,产生无色有刺激性气味的气体,同时有淡黄色沉淀生成,写出此反应的化学方程式___________ ;该反应中被氧化和被还原的元素的质量之比是___________ 。
(4)反应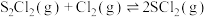 在一定压强下,向10L密闭容器中充入
在一定压强下,向10L密闭容器中充入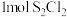 和
和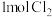 发生上述反应,
发生上述反应, 与
与 的消耗速率与温度的关系如图所示。
的消耗速率与温度的关系如图所示。___________ (填字母)。
②其他条件不变只改变下列一个条件,可以提高 消耗速率的是
消耗速率的是___________ 。
A.升高体系的温度 B.及时从体系中分离
C.恒容充入Ne气 D.使用合适的催化剂
(5) 可以制备亚硫酰氯(
可以制备亚硫酰氯( ),锂、亚硫酰氯(
),锂、亚硫酰氯(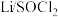 )电池是一种比能量最高的电池,若正极反应为
)电池是一种比能量最高的电池,若正极反应为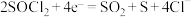 ,负极反应式为
,负极反应式为____________ 。
 和
和 均为改善橡胶性能的重要化工产品。
均为改善橡胶性能的重要化工产品。(1)已知下列化学键的键能及
 的结构式
的结构式| 化学键 |  |  |  |
键能/( ) ) | 266 | 255 | 243 |
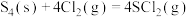 中生成
中生成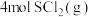 时放出
时放出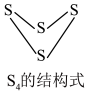
 的电子式是
的电子式是(3)
 易与水发生反应,反应中只有一种元素的化合价发生变化,产生无色有刺激性气味的气体,同时有淡黄色沉淀生成,写出此反应的化学方程式
易与水发生反应,反应中只有一种元素的化合价发生变化,产生无色有刺激性气味的气体,同时有淡黄色沉淀生成,写出此反应的化学方程式(4)反应
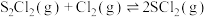 在一定压强下,向10L密闭容器中充入
在一定压强下,向10L密闭容器中充入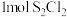 和
和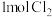 发生上述反应,
发生上述反应, 与
与 的消耗速率与温度的关系如图所示。
的消耗速率与温度的关系如图所示。
②其他条件不变只改变下列一个条件,可以提高
 消耗速率的是
消耗速率的是A.升高体系的温度 B.及时从体系中分离

C.恒容充入Ne气 D.使用合适的催化剂
(5)
 可以制备亚硫酰氯(
可以制备亚硫酰氯( ),锂、亚硫酰氯(
),锂、亚硫酰氯(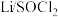 )电池是一种比能量最高的电池,若正极反应为
)电池是一种比能量最高的电池,若正极反应为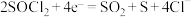 ,负极反应式为
,负极反应式为
您最近一年使用:0次
名校
解题方法
5 . 电化学原理在污染治理方面有着重要的作用。回答下列问题:
Ⅰ.煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示:
已知:两电极为完全相同的惰性电极。______ 极。
(2)电解池工作时,观察到R电极上有无色气体产生,写出电极反应式______ 。
(3)电解过程中,混合溶液中的pH将______ (填“变大”、“变小”或“不变”),理由是______ 。
Ⅱ.电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意如图:______ 。
(5)酸性废水中的 在该电池中发生的离子反应方程式为
在该电池中发生的离子反应方程式为______ 。
Ⅰ.煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示:
已知:两电极为完全相同的惰性电极。

(2)电解池工作时,观察到R电极上有无色气体产生,写出电极反应式
(3)电解过程中,混合溶液中的pH将
Ⅱ.电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意如图:

(5)酸性废水中的
 在该电池中发生的离子反应方程式为
在该电池中发生的离子反应方程式为
您最近一年使用:0次
解题方法
6 . 流化床膜反应器在制氢领域颇具潜力。如图为利用该反应器进行CH4-H2O催化重整的示意图。(反应为:CH4(g)+2H2O(g) CO2(g)+4H2(g)
CO2(g)+4H2(g)  H=164.6 kJ·mol-1)
H=164.6 kJ·mol-1)___________ (选填“高温”、“低温”或“任意温度”)条件下能自发进行。该工艺中原料气无需预热,分析需持续通入少量空气的目的可能是___________ ;图中流化床膜的作用是___________ 。
 CO2(g)+4H2(g)
CO2(g)+4H2(g)  H=164.6 kJ·mol-1)
H=164.6 kJ·mol-1)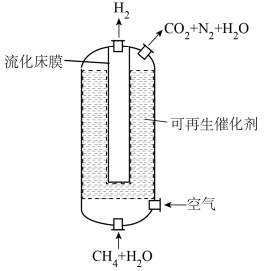
您最近一年使用:0次
7 . 镧镍合金(LaNi5,La-镧、Ni-镍)是解决氢储存问题的重要材料。储氢原理为:LaNi5(s)+3H2(g) LaNi5H6(s)
LaNi5H6(s)  H=–31.77 kJ·mol-1。
H=–31.77 kJ·mol-1。
1.镧镍合金被称为会“呼吸”的金属,根据化学平衡移动原理,让该合金实现“呼出”和“吸入”氢气的控制条件是___________ 。(列举1条)
2.一定温度下,在a g的镧镍合金中通入b g的氢气,发生储氢反应,下图的横坐标为压强,纵坐标的含义可以是___________。
3.LaNi5晶体吸收氢气后成为LaNi5H6,晶体体积基本不变,但晶体中的氢密度可达到1.1×105 g·m-3(氢密度是指单位体积晶体中氢元素的质量),则此时1 m3晶体中所储的氢相当于标准状况下___________ L氢气。
 LaNi5H6(s)
LaNi5H6(s)  H=–31.77 kJ·mol-1。
H=–31.77 kJ·mol-1。1.镧镍合金被称为会“呼吸”的金属,根据化学平衡移动原理,让该合金实现“呼出”和“吸入”氢气的控制条件是
2.一定温度下,在a g的镧镍合金中通入b g的氢气,发生储氢反应,下图的横坐标为压强,纵坐标的含义可以是___________。

| A.曲线I:活化能 | B.曲线I:氢气的转化率 |
| C.曲线Ⅱ:反应放出的总热量 | D.曲线Ⅱ:固体中镧元素质量分数 |
您最近一年使用:0次
名校
8 . 25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)HCOOH、 、HCN的酸性由强到弱的顺序为
、HCN的酸性由强到弱的顺序为______ 。
(2)向 溶液中加入足量HCN,反应的离子方程式为
溶液中加入足量HCN,反应的离子方程式为______ 。
(3)为了测定一元酸HCOOH溶液的浓度,现取25.00mLHCOOH溶液,用1.000mol/L的NaOH标准溶液滴定:
①用NaOH固体配制100mL,1.000mol/L的NaOH溶液,需要用到的仪器 除天平,药匙,烧杯,玻璃棒,胶头滴管,还需要______ 。实验过程中,将25.00mLHCOOH放入锥形瓶,滴入酚酞2-3滴;用标准NaOH溶液进行滴定,滴定过程中,眼睛应注视______ 。
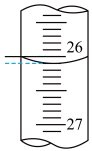
②连续滴定3次,若其中一次滴定结束时,滴定管中的液面如图所示,则终点读数为______ mL。
依据上表数据计算该HCOOH溶液的物质的量浓度为______ mol/L(计算结果保留四位有效数字)。
④下列操作中可能使所测HCOOH溶液的浓度数值偏低的是______ (填字母)。
A.滴定前,用待测液润洗锥形瓶
B.一滴标准溶液附在锥形瓶壁上未洗下
C.选用甲基橙作指示剂
D.配置NaOH溶液时,称量NaOH固体速度过慢
E.读取NaOH溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定法是一种常见的定量实验分析法,常见的滴定有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
①如据反应 ,可以用碘水滴定
,可以用碘水滴定 溶液,可以选
溶液,可以选______ 作指示剂;
②用 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点,当溶液中的
反应生成砖红色沉淀指示滴定终点,当溶液中的 恰好沉淀完全(浓度为
恰好沉淀完全(浓度为 )时,溶液中的
)时,溶液中的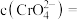
______  。(已知25℃时,
。(已知25℃时, 和AgCl的
和AgCl的 分别为
分别为 和
和 。)
。)
化学式 |
|
|
|
电离平衡常数 |
|
|
|
(1)HCOOH、
 、HCN的酸性由强到弱的顺序为
、HCN的酸性由强到弱的顺序为(2)向
 溶液中加入足量HCN,反应的离子方程式为
溶液中加入足量HCN,反应的离子方程式为(3)为了测定一元酸HCOOH溶液的浓度,现取25.00mLHCOOH溶液,用1.000mol/L的NaOH标准溶液滴定:
①用NaOH固体配制100mL,1.000mol/L的NaOH溶液,需要用到的
②连续滴定3次,若其中一次滴定结束时,滴定管中的液面如图所示,则终点读数为
实验序号 | 待测 |
| ||
滴定前刻度 | 滴定后刻度 | 溶液的体积 | ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
④下列操作中可能使所测HCOOH溶液的浓度数值偏低的是
A.滴定前,用待测液润洗锥形瓶
B.一滴标准溶液附在锥形瓶壁上未洗下
C.选用甲基橙作指示剂
D.配置NaOH溶液时,称量NaOH固体速度过慢
E.读取NaOH溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定法是一种常见的定量实验分析法,常见的滴定有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
①如据反应
 ,可以用碘水滴定
,可以用碘水滴定 溶液,可以选
溶液,可以选②用
 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点,当溶液中的
反应生成砖红色沉淀指示滴定终点,当溶液中的 恰好沉淀完全(浓度为
恰好沉淀完全(浓度为 )时,溶液中的
)时,溶液中的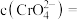
 。(已知25℃时,
。(已知25℃时, 和AgCl的
和AgCl的 分别为
分别为 和
和 。)
。)
您最近一年使用:0次
名校
解题方法
9 . 研发二氧化碳的利用技术具有重要意义。
(1)利用CO2加氢制备CH3OH是人工固碳的途径之一。已知:
反应I:CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH1
CH3OH(g)+ H2O(g) ΔH1
反应Ⅱ:CO2(g)+H2(g) CO(g)+ H2O(g) ΔH2=41 kJ·mol-1
CO(g)+ H2O(g) ΔH2=41 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) ΔH3= -90 kJ·mol-1
CH3OH(g) ΔH3= -90 kJ·mol-1
ΔH1=_______ kJ·mol-1;
(2)CO2浓度小于20%时适宜用化学吸附,下列为室温下化学吸附方法之一,化学方程式为Ca(OH)2+H2CO3=CaCO3+2H2O,反应的平衡常数为_______ 。(已知Ka1(H2CO3)=4×10-7,Ka2(H2CO3)=5×10-11,Ksp[Ca(OH)2]=5×10-6,Ksp(CaCO3)=2×10-9)
(3)利用电解法在碱性条件下将CO2还原为CH4和C2H4的原理如下图所示:
S(X)= ×100% FE(X)=
×100% FE(X)= ×100%
×100%
① 写出碱性条件下CO2生成CH4的电极反应式:_______ 。
②碱性条件下反应一段时间,实验测得CH4、C2H4的选择性及CH4的法拉第效率如下表所示。则C2H4的法拉第效率FE(C2H4)为_______ 。
(4) 和
和 在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,
在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,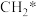 表示活性亚甲基)。
表示活性亚甲基)。 和
和 在镍基催化作用下发生重整反应的化学方程式为
在镍基催化作用下发生重整反应的化学方程式为_______ 。该反应在高温下才能自发进行,判断反应焓变
_______ (填“大于”“小于”或“等于”)0,判断理由是_______ 。
(1)利用CO2加氢制备CH3OH是人工固碳的途径之一。已知:
反应I:CO2(g)+3H2(g)
 CH3OH(g)+ H2O(g) ΔH1
CH3OH(g)+ H2O(g) ΔH1 反应Ⅱ:CO2(g)+H2(g)
 CO(g)+ H2O(g) ΔH2=41 kJ·mol-1
CO(g)+ H2O(g) ΔH2=41 kJ·mol-1反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g) ΔH3= -90 kJ·mol-1
CH3OH(g) ΔH3= -90 kJ·mol-1 ΔH1=
(2)CO2浓度小于20%时适宜用化学吸附,下列为室温下化学吸附方法之一,化学方程式为Ca(OH)2+H2CO3=CaCO3+2H2O,反应的平衡常数为
(3)利用电解法在碱性条件下将CO2还原为CH4和C2H4的原理如下图所示:

S(X)=
 ×100% FE(X)=
×100% FE(X)= ×100%
×100%① 写出碱性条件下CO2生成CH4的电极反应式:
②碱性条件下反应一段时间,实验测得CH4、C2H4的选择性及CH4的法拉第效率如下表所示。则C2H4的法拉第效率FE(C2H4)为
| CH4 | C2H4 | |
| S(X) | 2% | 8% |
| FE(X) | 12.5% |
(4)
 和
和 在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,
在镍基催化作用下重整模型如图所示(已知:*表示催化剂活性位点,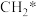 表示活性亚甲基)。
表示活性亚甲基)。
 和
和 在镍基催化作用下发生重整反应的化学方程式为
在镍基催化作用下发生重整反应的化学方程式为
您最近一年使用:0次
10 . 2024年河南某地中考理化生实验操作考试的化学题目之一是配制50g溶质质量分数为2%的氯化钠溶液,配制该溶液需要1g氯化钠固体和_______ mL水;电解饱和食盐水生成一种碱、氯气( )和一种可燃性气体,请写出该反应的化学方程式:
)和一种可燃性气体,请写出该反应的化学方程式:______ 。
 )和一种可燃性气体,请写出该反应的化学方程式:
)和一种可燃性气体,请写出该反应的化学方程式:
您最近一年使用:0次

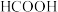

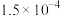
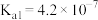
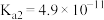

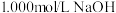 的体积
的体积