1 . 氨是化肥工业和基本有机化工的重要原料,合成氨反应是化学上最重要的反应之一

(1)N2和H2在常温常压下反应极慢,为提高合成氨反应的速率,工业上除采取增大压强以提高浓度外,还可采取的措施是____________ (答一条即可)
(2)已知反应N2(g)+3H2(g) 2NH3(g)的反应速率与时间的变化关系如图a所示,浓度随时间的变化如图b所示
2NH3(g)的反应速率与时间的变化关系如图a所示,浓度随时间的变化如图b所示
①图a中N点对应的时间是图b中的____________ (填“t1”“t2”或“t3”)
②图b中,0~t1内平均速率v正(N2)=mol•L-1•min-1,则t1~t2内平均速率v正(N2)应____________ (填标号)mol•L-1•min-1
A.大于uB.等于uC.小于u
(3)往恒温恒容密闭容器中通入1molN2和3molH2,充分反应后,测得压强为起始时压强的75%,N2的转化率为____________ 。
(4)某兴趣小组同学设计了如图所示装置模拟工业上合成氨。

①流经橡胶管处的气体成分为____________ (填化学式)
②能说明有氨生成的现象是____________ 。

(1)N2和H2在常温常压下反应极慢,为提高合成氨反应的速率,工业上除采取增大压强以提高浓度外,还可采取的措施是
(2)已知反应N2(g)+3H2(g)
 2NH3(g)的反应速率与时间的变化关系如图a所示,浓度随时间的变化如图b所示
2NH3(g)的反应速率与时间的变化关系如图a所示,浓度随时间的变化如图b所示①图a中N点对应的时间是图b中的
②图b中,0~t1内平均速率v正(N2)=mol•L-1•min-1,则t1~t2内平均速率v正(N2)应
A.大于uB.等于uC.小于u
(3)往恒温恒容密闭容器中通入1molN2和3molH2,充分反应后,测得压强为起始时压强的75%,N2的转化率为
(4)某兴趣小组同学设计了如图所示装置模拟工业上合成氨。

①流经橡胶管处的气体成分为
②能说明有氨生成的现象是
您最近一年使用:0次
2020-08-09更新
|
145次组卷
|
4卷引用:甘肃省白银市靖远县2019-2020学年高一下学期期末考试化学试题
解题方法
2 . 氮及氮的化合物有着重要的用途。
(1)氮元素在周期表中的位置是______ ; NH3的电子式是______ 。
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径______ (用化学方程式表示)。
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德•埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下图:

下列说法正确的是______ (选填字母)。
a 图①表示N2、H2分子中均是单键
b 图②→图③需要吸收能量
c 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g)=2NH3(g) △H= -92.4 kJ/mol,2H2(g)+O2(g)=2H2O(g) △H = -483.6kJ/mol,则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是________ 。
(5)水合肼(N2H4•H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,通常在催化剂存在下,用次氯酸钠与氨反应可制备,该反应的化学方程式是________ 。
(1)氮元素在周期表中的位置是
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德•埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下图:

下列说法正确的是
a 图①表示N2、H2分子中均是单键
b 图②→图③需要吸收能量
c 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g)=2NH3(g) △H= -92.4 kJ/mol,2H2(g)+O2(g)=2H2O(g) △H = -483.6kJ/mol,则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是
(5)水合肼(N2H4•H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,通常在催化剂存在下,用次氯酸钠与氨反应可制备,该反应的化学方程式是
您最近一年使用:0次
2019高三·全国·专题练习
解题方法
3 . 氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。

①亚硝酸钠与氯化铵反应的离子方程式为____________________________________ 。
②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、________ 和________ (填化学式)。
(2)最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ属于________________ (填“氧化还原反应”或“非氧化还原反应”)。
②反应Ⅲ中能量转化的方式是____________________ (填“电能转化为化学能”或“化学能转化为电能”)。
(1)实验室可用下图所示装置合成氨。

①亚硝酸钠与氯化铵反应的离子方程式为
②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、
(2)最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ属于
②反应Ⅲ中能量转化的方式是
您最近一年使用:0次
4 . 下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B. C. D. E是非金属单质,且在常温常压下都是气体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
请回答下列问题:
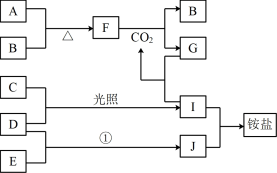
(1)用元素符号表示各物质:A___ 、B____ . C______ . D______ . E______ .F_____ . G____ 、I___ 。
(2)写出下列物质间反应的化学方程式:A和B_____________ ,F和CO2______________ ,D和E________________________ ,I和J ___________________ .
(3)写出化合物G与I反应的离子方程式_______________________________ 。
请回答下列问题:

(1)用元素符号表示各物质:A
(2)写出下列物质间反应的化学方程式:A和B
(3)写出化合物G与I反应的离子方程式
您最近一年使用:0次
解题方法
5 . 氮及其化合物在工农业生产和生命活动中起着重要作用。
(1)氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
哈伯法合成氨技术的相关反应为:N2(g)+3H2(g) 2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①合成氨技术是氮的固定的一种,属于______ (选填“大气固氮”、“生物固氮”“人工固氮”)。
②合成氨反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是_________ 。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
③关于合成氨工艺的下列理解,正确的是_________ 。
A.原料气中N2过量,是因N2相对易得,适度过量有利于提高H2的转化率
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(2)肼(N2H4)是氮的氢化物之一,其制备方法可用次氯酸钠氧化过量的氨气。
①次氯酸钠溶液显碱性,表示原理的离子方程式是_________________________ 。
②常温下,该水解反应的平衡常数为K=1.0×10-6mol/L,则1.0mol/LNaClO溶液的pH=____ 。
③肼与N2O4氧化反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ/mol
请写出肼和N2O4反应的热化学反应方程式_________________________________ 。
(3)在NH4HCO3溶液中,反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=_____ 。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
(1)氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
哈伯法合成氨技术的相关反应为:N2(g)+3H2(g)
 2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。①合成氨技术是氮的固定的一种,属于
②合成氨反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
③关于合成氨工艺的下列理解,正确的是
A.原料气中N2过量,是因N2相对易得,适度过量有利于提高H2的转化率
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(2)肼(N2H4)是氮的氢化物之一,其制备方法可用次氯酸钠氧化过量的氨气。
①次氯酸钠溶液显碱性,表示原理的离子方程式是
②常温下,该水解反应的平衡常数为K=1.0×10-6mol/L,则1.0mol/LNaClO溶液的pH=
③肼与N2O4氧化反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ/mol
请写出肼和N2O4反应的热化学反应方程式
(3)在NH4HCO3溶液中,反应NH4++HCO3-+H2O
 NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
您最近一年使用:0次
2019-04-04更新
|
563次组卷
|
4卷引用:【区级联考】天津市红桥区2019届高三上学期一模考试化学试题
【区级联考】天津市红桥区2019届高三上学期一模考试化学试题2020届高三化学二轮复习—— 《化学反应速率及其影响因素》【精编24题】专题3.2 非金属及其化合物(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题6.3 化学原理题(必考)(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升
名校
解题方法
6 . 已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号和电子排布式:
X____________________ Y___________________
Z____________________ W___________________
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为________________ 。E在催化剂存在的条件下可用于还原汽车尾气中的______ ,以减少对大气的污染。
(1)写出下列元素的元素符号和电子排布式:
X
Z
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为
您最近一年使用:0次
7 . 自然界中存在着很多的物质循环过程。
(1)下图是自然界中碳、氧循环的示意图。

①图一中,转化1是水吸收二氧化碳的过程,反应的化学反应方程式是____________ 。
②图二中,转化1是自然界中碳、氧循环的一个重要反应——绿色植物的光合作用,反应的化学方程式是____________ 。
③上述两个反应中的反应物相同,但得到的产物不同,原因是____________ 。
(2)下图是氮循环示意图,请回答下列问题。
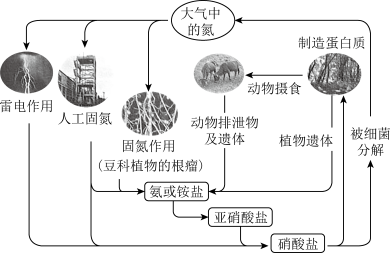
①自然界中的固氮和人工固氮的共同点是将氮元素由游离态转化为____________ 。
②雷电固氮反应的化学方程式是____________ ,其中氮元素被____________ (填“氧化”或“还原”)。
③根据循环图判断下列说法不正确的是____________ 。
a.氮元素均被氧化
b.工业合成氨属于人工固氮
c.含氮无机物和含氮有机物可相互转化
d.碳、氢、氧三种元素也参与了氮循环
(1)下图是自然界中碳、氧循环的示意图。

①图一中,转化1是水吸收二氧化碳的过程,反应的化学反应方程式是
②图二中,转化1是自然界中碳、氧循环的一个重要反应——绿色植物的光合作用,反应的化学方程式是
③上述两个反应中的反应物相同,但得到的产物不同,原因是
(2)下图是氮循环示意图,请回答下列问题。

①自然界中的固氮和人工固氮的共同点是将氮元素由游离态转化为
②雷电固氮反应的化学方程式是
③根据循环图判断下列说法不正确的是
a.氮元素均被氧化
b.工业合成氨属于人工固氮
c.含氮无机物和含氮有机物可相互转化
d.碳、氢、氧三种元素也参与了氮循环
您最近一年使用:0次
8 . 下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。

请填写以下空白:
(1)A的化学式________ ;B的结构式________ ;D的电子式________ ;
(2)写出反应①②的化学方程式:
①________________________________________________ ,
②_________________________________________ 。
(3)写出反应③的离子方程式:________________________________________ 。
(4)J与F反应的化学方程式:_________________________________________ 。
(5)在反应④中,当生成标况下3.36 L G时,转移电子数为__________ mol。

请填写以下空白:
(1)A的化学式
(2)写出反应①②的化学方程式:
①
②
(3)写出反应③的离子方程式:
(4)J与F反应的化学方程式:
(5)在反应④中,当生成标况下3.36 L G时,转移电子数为
您最近一年使用:0次
9 . 农业上有一句俗语“雷雨发庄稼”,该过程发生的下列变化中不正确的是( )
| A.2NO+O2===2NO2 | B.3NO2+H2O===2HNO3+NO |
C.N2+2O2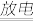 2NO2 2NO2 | D.HNO3与土壤中的矿物作用生成硝酸盐 |
您最近一年使用:0次
2018-09-21更新
|
333次组卷
|
11卷引用:福建省龙海市第二中学2017-2018学年高一下学期第一次(4月)月考化学试题
福建省龙海市第二中学2017-2018学年高一下学期第一次(4月)月考化学试题【全国百强校】黑龙江省鹤岗市第一中学2019届高三上学期第一次月考化学试题(已下线)2018年11月29日 《每日一题》人教必修1-二氧化氮和一氧化氮的性质【全国百强校】宁夏回族自治区育才中学孔德校区2018-2019学年高一下学期3月月考化学试题内蒙古通辽市实验中学2018-2019学年高一下学期第一次月考化学试题黑龙江省伊春市伊美区第二中学2018-2019学年高一上学期期末考试化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP415(1)】【化学】(已下线)【浙江新东方】绍兴qw117广西壮族自治区蒙山中学2020-2021学年高一下学期第一次月考化学试题宁夏大学附属中学2020-2021学年高一上学期期末考试化学试题广西梧州市2020-2021学年高一下学期第一次月考化学试题
10 . A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
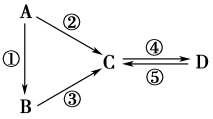
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:______________________________ 。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:__________________________________________________ 。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。单质A能在空气中稳定存在的原因是_______________________________________________________ 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,C是一种矿物胶,可作防火剂,D溶液显碱性,常用于工业生产玻璃。写出②反应的化学方程式:_______________________________________________ 。D的化学式是________ 。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:
____________________________________________________________ 。
(6)若B为淡黄色固体化合物;D属于盐类,其水溶液显碱性,②、③反应均要用到一种无色液体,写出反应⑤的化学方程式:_______________________________________________ 。

(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。单质A能在空气中稳定存在的原因是
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,C是一种矿物胶,可作防火剂,D溶液显碱性,常用于工业生产玻璃。写出②反应的化学方程式:
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:

(6)若B为淡黄色固体化合物;D属于盐类,其水溶液显碱性,②、③反应均要用到一种无色液体,写出反应⑤的化学方程式:
您最近一年使用:0次
2018-09-05更新
|
379次组卷
|
2卷引用:2018-2019学年人教版高中化学必修一:18-19 模块综合测评(B)



