名校
解题方法
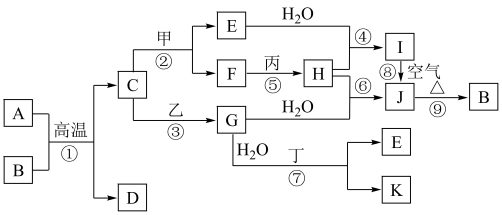
1 . 如图是中学化学常见物质的转化关系,部分物质和反应条件略去。其中A是地壳中含量最多的金属元素的单质,B是一种红棕色粉末;通常情况下,乙为黄绿色气体单质,H是有刺激性气味的气体,在工业上可通过反应⑥在高温高压、催化剂条件下合成;J为难溶于水的红褐色固体;反应⑦在工业上可用于制作印刷电路板。
请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为___________ 。
(2)在反应①~⑨中,不属于氧化还原反应的是___________ 。
(3)写出下列反应的化学方程式:
反应①:___________ 。
反应⑧:___________ 。
(4)写出乙与E在溶液中反应的离子方程式:___________ 。
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:___________ 。
(6)检验G中阳离子的试剂的化学式为___________ ,反应现象为___________ 。

请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为
(2)在反应①~⑨中,不属于氧化还原反应的是
(3)写出下列反应的化学方程式:
反应①:
反应⑧:
(4)写出乙与E在溶液中反应的离子方程式:
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:
(6)检验G中阳离子的试剂的化学式为
您最近一年使用:0次
解题方法
2 . 铁及其化合物在生产、生活中有着重要作用。按要求回答下列问题。
(1)基态Fe原子的价层电子排布式为___________ ;铁元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:
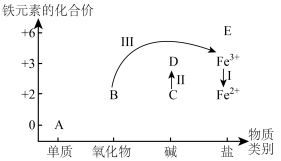
①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:___________ 。
②预测物质E中铁元素具有___________ (填“氧化性”或“还原性”)。
③写出反应Ⅱ的化学方程式:___________ 。
④实现反应Ⅲ的转化,可选择含N元素的试剂为___________ 。
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)
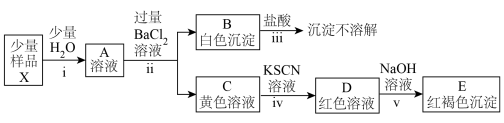
①由步骤ⅰ及其现象可推知铁盐X的物理性质:___________ 。
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为___________ 。
③C溶液呈黄色,不可能是因其体系中含有的___________ 、___________ 、___________ 、___________ (填离子符号)所致;
而可能是因其体系中含有的___________ 、___________ (填粒子的化学式)等所致。
④由步骤iv、v及其现象,体系中与 结合能力最强的离子是
结合能力最强的离子是___________ 。
(1)基态Fe原子的价层电子排布式为
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:

①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:
②预测物质E中铁元素具有
③写出反应Ⅱ的化学方程式:
④实现反应Ⅲ的转化,可选择含N元素的试剂为
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)

①由步骤ⅰ及其现象可推知铁盐X的物理性质:
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为
③C溶液呈黄色,不可能是因其体系中含有的
而可能是因其体系中含有的
④由步骤iv、v及其现象,体系中与
 结合能力最强的离子是
结合能力最强的离子是
您最近一年使用:0次
解题方法
3 . 元素周期表在化学中有举足轻重的地位。请根据提示回答下列问题:
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置_______ 。Fe 分别与硫单质和氯气共热,可以得到两种含铁的二元化合物。请问这两种物质中金属阳离子的未成对电子数之比为_______ 。
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式_______ 。利用铜离子作为中心原子可以形成多种具有良好特性的配合物。我们熟知的是一种深蓝色配合物,向硫酸铜溶液中通入过量氨气,可制备这种深蓝色配合物[Cu(NH3)4]2+。请用适当的化学用语描述该反应过程的实质_______ 。写出[Cu(NH3)4]2+配体的电子式_______ 。
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是_______ 。
(4)CoO 的晶胞如图所示。
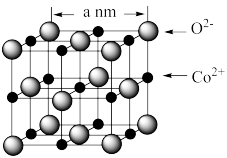
设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为_______ g﹒cm−3(列出计算式即可)
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO 的 VSEPR 模型为
的 VSEPR 模型为_______ ,其中 P 的杂化轨道类型为_______ 。
(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因_______ 。
(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因_______
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因_______ 。
(1)铁在生活生产中用途广泛,写出 Fe 在元素周期表中的位置
(2)古往今来,人类发展的脚步离不开青铜器的冶炼,锻造及使用。如今,铜元素依旧为科研人员所钟爱,请写出铜原子的价电子排布式
(3)I1表示第一电离,I1(Mg)> I1(Al)> I1(Na),原因是
(4)CoO 的晶胞如图所示。

设阿伏加德罗常数的值为 NA,则 CoO 晶体的密度为
(5)磷元素在农药的合成中有着重要作用。了解其化合物的结构有助于我们合成新型农药,提高粮食的产量。PO
 的 VSEPR 模型为
的 VSEPR 模型为(6)配位化学中,硼元素深受研究者的喜爱。其原因在于 B 容易与配体形成配位键,如BF
 、B(OH)
、B(OH) 等,从原子结构分析其原因
等,从原子结构分析其原因(7)溶解度、熔沸点、颜色等是每种物质自身特有的性质,但也存在一定的规律。
①水和 H2S 均可以溶于乙醇,但 H2O 在乙醇中的溶解度大于 H2S 的原因
a.水和乙醇均为分子晶体 b.水和乙醇分子间可以形成氢键 c.水和乙醇可以发生反应
②比较下列锗卤化物的熔点和沸点,分析其变化规律的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约 400 |
您最近一年使用:0次
名校
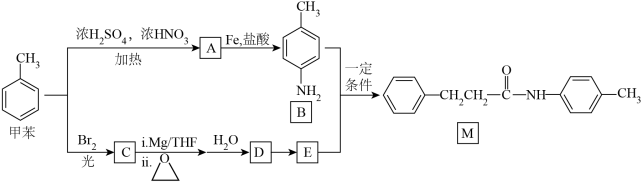
4 . 一种以甲苯为原料合成有机物M的设计路线如下: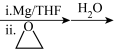
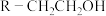
回答下列问题:
(1)B所含官能团的名称是_____ 。
(2)A的名称是_____ ,A→B中加入Fe的目的是_____ 。
(3)甲苯→A的反应类型是_____ ,甲苯→C的化学方程式为_____ 。
(4)在制药行业中常用“成盐修饰”改善物质的理化性质,若用饱和 溶液对E进行“成盐修饰”,可将E转化为
溶液对E进行“成盐修饰”,可将E转化为_____ (用结构简式表示)。
(5)用结构简式表示满足下列条件的D的同分异构体_____ 。
①苯环上只有两个取代基;
②核磁共振氢谱中有6组吸收峰;
③分子中只含有1个手性碳原子
(6)根据已有知识并结合上述合成路线图的相关信息,写出以乙烯为原料,选用必要的无机试剂,合成高分子物质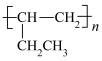 的路线图(请用结构简式表示有机物,用“→”表示转化关系,并在“→”上注明试剂和反应条件)
的路线图(请用结构简式表示有机物,用“→”表示转化关系,并在“→”上注明试剂和反应条件)_____ 。

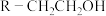
回答下列问题:
(1)B所含官能团的名称是
(2)A的名称是
(3)甲苯→A的反应类型是
(4)在制药行业中常用“成盐修饰”改善物质的理化性质,若用饱和
 溶液对E进行“成盐修饰”,可将E转化为
溶液对E进行“成盐修饰”,可将E转化为(5)用结构简式表示满足下列条件的D的同分异构体
①苯环上只有两个取代基;
②核磁共振氢谱中有6组吸收峰;
③分子中只含有1个手性碳原子
(6)根据已有知识并结合上述合成路线图的相关信息,写出以乙烯为原料,选用必要的无机试剂,合成高分子物质
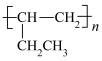 的路线图(请用结构简式表示有机物,用“→”表示转化关系,并在“→”上注明试剂和反应条件)
的路线图(请用结构简式表示有机物,用“→”表示转化关系,并在“→”上注明试剂和反应条件)
您最近一年使用:0次
2023-08-15更新
|
271次组卷
|
4卷引用:期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)
(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)广西桂林市2022-2023学年高二下学期期末考试化学试题广东省珠海市斗门区第一中学2023-2024学年高三上学期阶段性考试化学试题(已下线)题型04 有机合成设计-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)
解题方法
5 . 下表列出了①~⑩十种元素在周期表中的位置:
请按要求回答下列问题
(1)上述元素中,金属性最强的是_______ (填元素名称),最高价氧化物对应水化物酸性最强的是_______ (写出酸的化学式)。
(2)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是:_______ 。(用离子符号表示)
(3)由元素①和④形成的18电子的结构式为_______ ;由元素①、③、⑨形成的离子化合物的电子式为_______ ,由元素⑥和⑨形成化合物乙,请用电子式表示物质乙的形成过程_______ 。
(4)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为:_______
(5)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系_______ 。
(6)可以比较⑤、⑥两元素金属性强弱的实验是_______。
(7)元素③、磷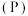 、砷
、砷 、锑
、锑 、铋
、铋 为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置
为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置_______ 。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ | |||||||
(1)上述元素中,金属性最强的是
(2)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是:
(3)由元素①和④形成的18电子的结构式为
(4)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为:
(5)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系
(6)可以比较⑤、⑥两元素金属性强弱的实验是_______。
| A.比较这两种元素最高价氧化物对应的水化物的碱性 |
| B.将⑤的单质投入到⑥的盐溶液中 |
| C.将这两种元素的单质分别放入冷水中 |
| D.比较这两种元素的单质与酸反应时失电子的数目 |
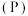 、砷
、砷 、锑
、锑 、铋
、铋 为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置
为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置
您最近一年使用:0次
名校
6 . (一)如图是部分短周期主族元素的原子序数与其最高或最低化合价的关系图(用原子序数代表所对应的元素),已知a为元素周期表中相对原子质量最小的元素,请回答下列问题:
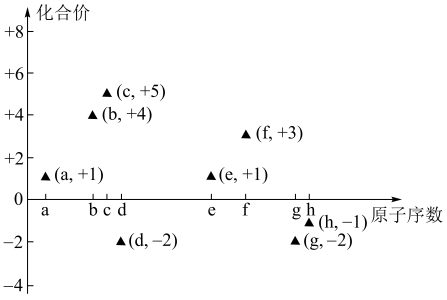
(1)a与c、d分别都可以形成有18个电子的分子甲和乙,甲分子的电子式_____ ,乙分子类型属于____ 分子(填“极性”或“非极性”)。
(2)b元素的一种单质丙可与g元素的最高价含氧酸丁的溶液反应,该反应的化学方程式为_____ ,如果一次性取样分别检验上述反应的生成物,按照最简单的操作顺序写出所用试剂的名称_____ 。
(3)f元素的单质可与e元素的最高价氧化物对应水化物反应放出氢气,该反应的化学方程式为_____ ,f元素的两种盐溶液也可以反应得到f元素最高价氧化物对应的水化物,该反应的离子方程式为_____ 。
(二)过渡金属在社会生产、生活发展中具有重要作用。
(4)原子序数21~30的元素中,基态电子排布未成对电子最多的元素在周期表的位置_____ ,其价电子排布图为____ 。
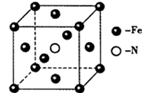
(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为______ 。若该晶体的密度是ρg•cm-3,则两个最近的Fe原子间的距离为_____ cm。(用NA表示阿伏加德罗常数的值)
(6)铁的一种配合物的化学式为Fe[(Htrz)3](ClO4)2,其中Htrz为1,2,4—三氮唑()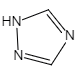 。
。
①配合物中阴离子的空间构型为_____ ,中心原子的杂化方式是_____ 。
② 分子中含σ键与π键个数比为
分子中含σ键与π键个数比为______ 。
③1摩尔1,2,4—三氮唑最多能与_____ molH+结合。
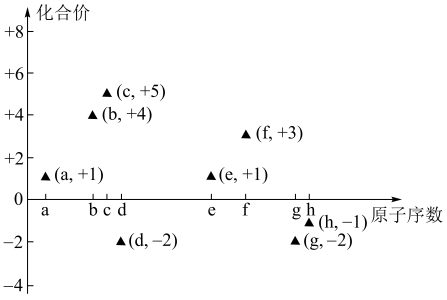
(1)a与c、d分别都可以形成有18个电子的分子甲和乙,甲分子的电子式
(2)b元素的一种单质丙可与g元素的最高价含氧酸丁的溶液反应,该反应的化学方程式为
(3)f元素的单质可与e元素的最高价氧化物对应水化物反应放出氢气,该反应的化学方程式为
(二)过渡金属在社会生产、生活发展中具有重要作用。
(4)原子序数21~30的元素中,基态电子排布未成对电子最多的元素在周期表的位置
(5)铁单质和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,该反应的化学方程式为

(6)铁的一种配合物的化学式为Fe[(Htrz)3](ClO4)2,其中Htrz为1,2,4—三氮唑()
 。
。①配合物中阴离子的空间构型为
②
 分子中含σ键与π键个数比为
分子中含σ键与π键个数比为③1摩尔1,2,4—三氮唑最多能与
您最近一年使用:0次
2022-01-13更新
|
163次组卷
|
2卷引用:天津市耀华中学2021-2022学年高三上学期第二次月考化学试题



