名校
解题方法
1 . 下列事实与硝酸性质的对应关系错误的是
| A.打开浓硝酸的试剂瓶,瓶口有白雾——挥发性 |
| B.用棕色试剂瓶保存浓硝酸——不稳定性 |
| C.稀硝酸使紫色石蕊试液变红——酸性 |
| D.稀硝酸使黑色氧化铜固体溶解——强氧化性 |
您最近一年使用:0次
2021-07-16更新
|
699次组卷
|
3卷引用:2021年1月辽宁省普通高中学业水平合格性考试化学试题
2 . 下列事实与括号中浓硫酸的性质对应关系错误的是
| A.浓硫酸可用来干燥某些气体(吸水性) |
| B.浓硫酸能使蔗糖变黑(脱水性) |
| C.空气中敞口久置的浓硫酸,浓度减小,质量增大(挥发性) |
| D.浓硫酸在加热条件下能与铜反应(氧化性) |
您最近一年使用:0次
2021-05-20更新
|
125次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2020-2021学年高一下学期期中考试化学试题
名校
解题方法
3 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
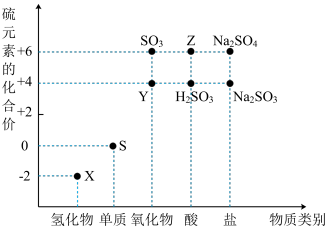
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
2021-04-25更新
|
421次组卷
|
14卷引用:辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题
辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期第一次月考化学试题沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2贵州省岑巩县第四中学2019-2020学年高一上学期期末考试化学试题贵州省施秉县一中2019-2020学年高一上学期期末考试化学试题鲁科版(2019)高一必修第一册第三章第2节 硫的转化 课时4 不同价态硫元素之间的转化酸雨及其防治高一必修第一册(苏教2019版)专题4 第二单元 硫及其化合物的相互转化 课时2 含硫物质之间的转化 氧化还原反应方程式的配平河北省安平中学2020-2021学年高一上学期12月月考化学试题山西省长治市第二中学校2020-2021学年高一下学期期中考试化学试题河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(A卷)江苏省盱眙中学2022-2023学年高一下学期6月阶段测试化学试题黑龙江省双鸭山市第一中学2023-2024学年高二上学期开学考试化学试题
2022高一·全国·专题练习
名校
解题方法
4 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:

(1)质量相同的a和b,物质的量之比为_______ 。将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为_______ 。
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为_______ 。
(3)将足量的a通入BaCl2溶液中,下列说法正确的是_______ (填标号)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2Ag2S + 2H2O。H2S在该反应中_______(填标号)。
(5)已知e为正盐,且能被酸性K2Cr2O7氧化为Na2SO4,Cr2O 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:_______ 。

(1)质量相同的a和b,物质的量之比为
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为
(3)将足量的a通入BaCl2溶液中,下列说法正确的是
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2Ag2S + 2H2O。H2S在该反应中_______(填标号)。
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂也是还原剂 | D.既不是氧化剂也不是还原剂 |
 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:
您最近一年使用:0次
2022-02-22更新
|
935次组卷
|
3卷引用: 辽宁省朝阳市建平县实验中学2021-2022学年高一下学期期中考试化学试题
辽宁省朝阳市建平县实验中学2021-2022学年高一下学期期中考试化学试题(已下线)第03讲 硫酸根离子的检验 含硫物质的转化(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题
名校
5 . 下列物质性质与应用对应关系正确的是
| A.晶体硅熔点高硬度大,可用于制作半导体材料 |
| B.硅胶疏松多孔接触面积大吸水性强,可用作食品干燥剂 |
| C.漂白粉氧化性强,可用于泳池消毒、灭活病毒和漂白食物、纸张 |
| D.SO2还原性强,可用于葡萄酒的抗菌消毒和防腐 |
您最近一年使用:0次
2021-04-07更新
|
300次组卷
|
2卷引用:辽宁省大连市第一中学2020-2021学年高一下学期期中(选择性)考试化学试题
6 . Ⅰ.某同学设计实验探究Cu与98%浓 的反应,装置如图所示,回答下列问题:
的反应,装置如图所示,回答下列问题:
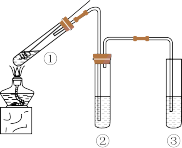
(1)试管①中发生反应的化学方程式为_______ 。
(2)试管②用来检验生成的 ,下列试剂中利用
,下列试剂中利用 的还原性进行检验的是 。
的还原性进行检验的是 。
(3)试管③中盛放______ ,用来吸收 ,防止污染空气。
,防止污染空气。
Ⅱ.如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:
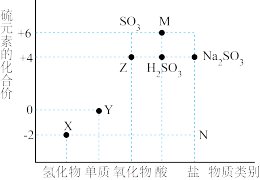
(4)将Z通入紫色石蕊溶液中,实验现象为_______ 。
(5)足量Y与1mol金属铜充分反应,转移电子的物质的量为_______ mol。
(6)将Z通入X的水溶液中,发生反应的化学方程式为_______ 。
(7)碳和M的浓溶液的反应中,氧化剂与还原剂物质的量之比为_______ 。
 的反应,装置如图所示,回答下列问题:
的反应,装置如图所示,回答下列问题:
(1)试管①中发生反应的化学方程式为
(2)试管②用来检验生成的
 ,下列试剂中利用
,下列试剂中利用 的还原性进行检验的是 。
的还原性进行检验的是 。A.酸性 | B.品红溶液 | C.溴水 | D. 溶液 溶液 |
 ,防止污染空气。
,防止污染空气。Ⅱ.如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:

(4)将Z通入紫色石蕊溶液中,实验现象为
(5)足量Y与1mol金属铜充分反应,转移电子的物质的量为
(6)将Z通入X的水溶液中,发生反应的化学方程式为
(7)碳和M的浓溶液的反应中,氧化剂与还原剂物质的量之比为
您最近一年使用:0次
名校
解题方法
7 . 向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2)≤0.015mol时发生的反应是:2NaAlO2+CO2+2H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
A.通入n(CO2)=0mol时,溶液中c(Na+)>c(AlO )+c(OH-) )+c(OH-) |
B.通入n(CO2)=0.01时,溶液中c(Na+)>c(AlO )>c(OH-)>c(CO )>c(OH-)>c(CO ) ) |
C.通入n(CO2)=0.015时,溶液中c(Na+)>c(CO )>c(OH-)>c(HCO )>c(OH-)>c(HCO ) ) |
D.通入n(CO2)=0.03时,溶液中c(Na+)>c(OH-)>c(HCO )>c(H+) )>c(H+) |
您最近一年使用:0次
名校
8 . 非金属元素在化工生产中扮演着重要的角色。在众多的化工原料和产品中,都能见到硫和氮等元素的踪迹。
Ⅰ.利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:
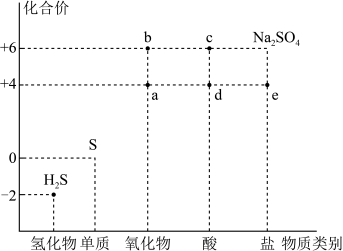
(1)质量相同的a和b,物质的量之比为_______ 。
(2)将足量的a气体通入下列溶液中,始终没有明显反应现象的是_______。
(3)实验室常用质量分数70%的c可以与e的正盐反应制备a,请写出反应的离子方程式_______ 。
(4)已知a转化为b是工业合成c的重要反应,请写出化学反应方程式_______ 。
(5)查阅资料发现:硫酸铜可加快c的稀溶液与锌粒的反应速率,欲通过变量控制法设计以下实验进行探究。
请完成此实验设计,硫酸铜加快该反应速率的原因是_______ ,其中:V1=_______ ,V2=_______ 。
Ⅱ.氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。

(6)写出氧化炉中的化学反应方程式_______ 。
(7)工业制硝酸的尾气是酸性气体,实验室模拟该流程时,为防止环境污染,最好选用_______ (填化学式)溶液吸收。
Ⅰ.利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:

(1)质量相同的a和b,物质的量之比为
(2)将足量的a气体通入下列溶液中,始终没有明显反应现象的是_______。
A. 溶液 溶液 | B. 溶液 溶液 |
| C.H2O2溶液 | D.Na2CO3溶液 |
(4)已知a转化为b是工业合成c的重要反应,请写出化学反应方程式
(5)查阅资料发现:硫酸铜可加快c的稀溶液与锌粒的反应速率,欲通过变量控制法设计以下实验进行探究。
| A组 | B组 | |
| 1.0 mol·L-1 c /mL | 20 | V1 |
| 1.2 mol·L-1CuSO4溶液/mL | 0 | 5 |
| H2O/mL | V2 | 0 |
| 形状、大小几乎相同的Zn粒 | 3粒 | 3粒 |
Ⅱ.氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。

(6)写出氧化炉中的化学反应方程式
(7)工业制硝酸的尾气是酸性气体,实验室模拟该流程时,为防止环境污染,最好选用
您最近一年使用:0次
名校
9 . 受疫情影响,自2020年底,芯片短缺就一直占据汽车行业话题榜首。回答相关问题:
Ⅰ.制备高纯硅的主要工艺流程如图所示:
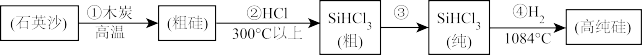
(1)流程①的化学反应方式为___________ 。
(2)流程④的化学反应为置换反应,其化学方程式为___________ 。
Ⅱ.“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(3)硫酸工业排出的尾气(主要含 )有多种处理方式。其中一种方式便是用软锰矿浆
)有多种处理方式。其中一种方式便是用软锰矿浆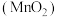 吸收,如图所示。写出“反应1”的化学方程式:
吸收,如图所示。写出“反应1”的化学方程式:___________ 。
为测定排放气中 的含量,可进行了如下实验:将排放气匀速通入一定量酸性高锰酸钾溶液中,进行相关计算,试写出该反应的离子方程式:
的含量,可进行了如下实验:将排放气匀速通入一定量酸性高锰酸钾溶液中,进行相关计算,试写出该反应的离子方程式:___________ 。
(4)在一定条件下, 可将
可将 转化为无污染的物质。写出
转化为无污染的物质。写出 与
与 在一定条件下反应的化学方程式:
在一定条件下反应的化学方程式:___________ 。
Ⅲ.如图是氮元素的几种化合价与物质类别的对应关系:
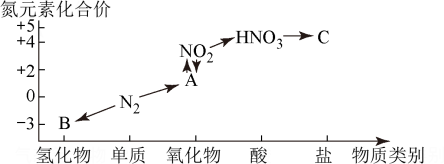
回答下列问题:
(5)实验室制取物质B的化学方程式为___________ 。
(6) 与水反应生成物质A的离子方程式为
与水反应生成物质A的离子方程式为___________ 。
Ⅰ.制备高纯硅的主要工艺流程如图所示:
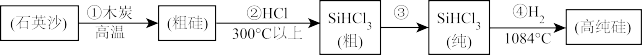
(1)流程①的化学反应方式为
(2)流程④的化学反应为置换反应,其化学方程式为
Ⅱ.“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(3)硫酸工业排出的尾气(主要含
 )有多种处理方式。其中一种方式便是用软锰矿浆
)有多种处理方式。其中一种方式便是用软锰矿浆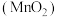 吸收,如图所示。写出“反应1”的化学方程式:
吸收,如图所示。写出“反应1”的化学方程式:
为测定排放气中
 的含量,可进行了如下实验:将排放气匀速通入一定量酸性高锰酸钾溶液中,进行相关计算,试写出该反应的离子方程式:
的含量,可进行了如下实验:将排放气匀速通入一定量酸性高锰酸钾溶液中,进行相关计算,试写出该反应的离子方程式:(4)在一定条件下,
 可将
可将 转化为无污染的物质。写出
转化为无污染的物质。写出 与
与 在一定条件下反应的化学方程式:
在一定条件下反应的化学方程式:Ⅲ.如图是氮元素的几种化合价与物质类别的对应关系:

回答下列问题:
(5)实验室制取物质B的化学方程式为
(6)
 与水反应生成物质A的离子方程式为
与水反应生成物质A的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 表中实验操作、现象与结论对应关系均正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 等体积pH=2的两种酸HX和HY分别与足量的锌反应 | HX溶液中放出的H2多 | HX的酸性比HY强 |
| B | 用广泛pH试纸测定1mol/LNaHSO3溶液的酸碱性 | 测得pH=3.2 | NaHSO3溶液呈酸性,证明HSO 在水中的电离程度小于水解程度 在水中的电离程度小于水解程度 |
| C | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大生成物浓度,平衡逆向移动 |
| D | 向浓度均为0.1mol/L的NaCl和NaI的混合溶液中滴加少量0.1mol/L的AgNO3溶液 | 产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-16更新
|
683次组卷
|
8卷引用:辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校五校协作体2020-2021学年高二上学期期末化学试题
辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校五校协作体2020-2021学年高二上学期期末化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期末考试化学试题湖南省永州市宁远县第一中学2022-2023学年高二上学期期中考试化学试题广东省江门市培英高级中学2022-2023学年高二上学期期中考试化学试题江西省临川第二中学2022-2023学年高二上学期第三次月考化学试题湖南省衡阳县2022-2023学年高二上学期期末考试化学试题广东省梅州市兴宁市沐彬中学2021-2022学年高二下学期期中考试化学试题江西省宜春市宜丰中学2023-2024学年高二上学期10月月考化学试题



