名校
1 . 海洋是一个巨大的化学资源宝库,含有80多种元素,其中含有较高的钠和氯元素。化学家常用廉价氯化钠为原料制备纯碱,也可用于电解法获得金属钠、氯气、氢气等,并进一步将其转化为生产、生活和科学实验中用途更为广泛的新物质,如 、
、 、
、 等。下列物质性质与用途正确且具有对应关系的是
等。下列物质性质与用途正确且具有对应关系的是
 、
、 、
、 等。下列物质性质与用途正确且具有对应关系的是
等。下列物质性质与用途正确且具有对应关系的是A. 溶液显碱性,可用作抗酸药物 溶液显碱性,可用作抗酸药物 |
B. 气体呈黄绿色,可用作自来水消毒剂 气体呈黄绿色,可用作自来水消毒剂 |
C. 具有还原性,可置换出 具有还原性,可置换出 溶液中的 溶液中的 单质 单质 |
| D.NaClO具有强氧化性,可用作漂白液 |
您最近一年使用:0次
2 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向蓝色石荔试纸上滴加新制氯水,试纸边缘呈红色,中间为白色 | 氯水既有酸性又有还原性 |
| B | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | 气体X一定具有强氧化性 |
| C | 向胆矾晶体上滴加浓硫酸,晶体变白 | 浓硫酸具有脱水性 |
| D | 向淀粉碘化钾溶液中滴加几滴溴水,溶液变蓝 | 氧化性Br2>I2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 高铁酸钾( )是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾微溶于浓
)是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾微溶于浓 溶液,极易溶于水而成浅紫红色溶液,静置后会分解放出氧气,并生成
溶液,极易溶于水而成浅紫红色溶液,静置后会分解放出氧气,并生成 胶体,因杀菌消毒和除污能力全面优于氯水,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于
胶体,因杀菌消毒和除污能力全面优于氯水,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于 、
、 等。工业上湿法制备
等。工业上湿法制备 的流程如下:
的流程如下:

下列关于 的说法不正确的是
的说法不正确的是
 )是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾微溶于浓
)是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾微溶于浓 溶液,极易溶于水而成浅紫红色溶液,静置后会分解放出氧气,并生成
溶液,极易溶于水而成浅紫红色溶液,静置后会分解放出氧气,并生成 胶体,因杀菌消毒和除污能力全面优于氯水,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于
胶体,因杀菌消毒和除污能力全面优于氯水,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于 、
、 等。工业上湿法制备
等。工业上湿法制备 的流程如下:
的流程如下:
下列关于
 的说法不正确的是
的说法不正确的是A. 在浓 在浓 溶液中的溶解度低于 溶液中的溶解度低于 |
B.将 与盐酸混合使用,可增强其杀菌消毒效果 与盐酸混合使用,可增强其杀菌消毒效果 |
C. 溶液具有除污能力是因为其生成的 溶液具有除污能力是因为其生成的 胶体有吸附作用 胶体有吸附作用 |
D.可用丁达尔效应鉴别 和 和 两种紫红色溶液 两种紫红色溶液 |
您最近一年使用:0次
2024-02-13更新
|
128次组卷
|
2卷引用:江苏省镇江中学2023-2024学年高一下学期3月阶段性检测化学试题
解题方法
4 . 高铁酸钾 是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓
是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓 溶液,能与水反应生成
溶液,能与水反应生成 胶体和
胶体和 ,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于
,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于 、
、 等。工业上湿法制备
等。工业上湿法制备 的流程如下。
的流程如下。

下列关于 的说法正确的是
的说法正确的是
 是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓
是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓 溶液,能与水反应生成
溶液,能与水反应生成 胶体和
胶体和 ,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于
,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于 、
、 等。工业上湿法制备
等。工业上湿法制备 的流程如下。
的流程如下。
下列关于
 的说法正确的是
的说法正确的是A.该条件下, 溶解度大于 溶解度大于 |
B.与水反应,每消耗 转移 转移 电子 电子 |
C.将 与盐酸混合使用,可增强其杀菌消毒效果 与盐酸混合使用,可增强其杀菌消毒效果 |
D.可用丁达尔效应鉴别 和 和 两种紫红色溶液 两种紫红色溶液 |
您最近一年使用:0次
5 . 高铁酸钾 是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓
是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓 溶液,能与水反应生成
溶液,能与水反应生成 胶体和
胶体和 ,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于
,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于 、
、 等。工业上湿法制备
等。工业上湿法制备 的流程如下。
的流程如下。

下列关于 工业制备的说法
工业制备的说法不正确 的是
 是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓
是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓 溶液,能与水反应生成
溶液,能与水反应生成 胶体和
胶体和 ,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于
,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于 、
、 等。工业上湿法制备
等。工业上湿法制备 的流程如下。
的流程如下。
下列关于
 工业制备的说法
工业制备的说法A.工业上可采用无隔膜电解饱和食盐水制取 溶液 溶液 |
B.“制备”时,氧化剂和还原剂的物质的量之比为 |
C.滤液中大量存在的离子有: 、 、 、 、 、 、 、 、 |
| D.用异丙醇洗涤晶体可减少高铁酸钾溶解损失 |
您最近一年使用:0次
6 . 高铁酸钾( )是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓KOH溶液,且能与水反应放出氧气,并生成
)是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓KOH溶液,且能与水反应放出氧气,并生成 胶体,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下其氧化性强于
胶体,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下其氧化性强于 、
、 等。下列关于
等。下列关于 的说法不正确的是
的说法不正确的是
 )是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓KOH溶液,且能与水反应放出氧气,并生成
)是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓KOH溶液,且能与水反应放出氧气,并生成 胶体,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下其氧化性强于
胶体,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下其氧化性强于 、
、 等。下列关于
等。下列关于 的说法不正确的是
的说法不正确的是A.将 与盐酸混合使用,可增强其杀菌消毒效果 与盐酸混合使用,可增强其杀菌消毒效果 |
B.与水反应,每消耗1mol  转移3mol电子 转移3mol电子 |
C. 用作水处理剂时,既能杀菌消毒,又能吸附悬浮杂质 用作水处理剂时,既能杀菌消毒,又能吸附悬浮杂质 |
D. 中,基态 中,基态 的核外电子排布为 的核外电子排布为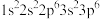 |
您最近一年使用:0次
名校
7 . 下列有关物质的性质与应用相对应的是( )
| A.碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 |
| B.铝易发生钝化,可用于作飞机、火箭的结构材料 |
| C.炭具有还原性,可用于冶炼钠、镁、铝等金属 |
| D.浓硫酸具有强氧化性,可用于干燥二氧化硫气体 |
您最近一年使用:0次
2016-12-09更新
|
123次组卷
|
2卷引用:2017届江苏省丹阳高级中学高三下学期期初考试化学试卷
8 . 亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。

【背景素材】
①2NO+Na2O2===2NaNO2;
②NO能被酸性KMnO4氧化成NO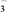 ,MnO
,MnO 被还原为Mn2+。
被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-
④HNO2不稳定,只能存在于极稀的冷溶液中。
【制备NaNO2】
(1)装置A三颈烧瓶中发生反应的化学方程式为__________ 。
(2)B装置的目的是①__________ ,②________________________________ 。
(3)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是__________ (填序号)。
A. P2O5 B. 碱石灰 C. 无水CaCl2 D. 生石灰
(4)E装置发生反应的离子方程式是_____________ 。
【测定NaNO2纯度】
(5)本小题可供选择的试剂有:
A. 稀硫酸 B. c1 mol·L-1KI溶液 C. 淀粉溶液 D. c2 mol·L-1 Na2S2O3溶液
E. c3 mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是___________ (填序号)。
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解___________ (请补充完整实验步骤)。

【背景素材】
①2NO+Na2O2===2NaNO2;
②NO能被酸性KMnO4氧化成NO
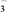 ,MnO
,MnO 被还原为Mn2+。
被还原为Mn2+。③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-
④HNO2不稳定,只能存在于极稀的冷溶液中。
【制备NaNO2】
(1)装置A三颈烧瓶中发生反应的化学方程式为
(2)B装置的目的是①
(3)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是
A. P2O5 B. 碱石灰 C. 无水CaCl2 D. 生石灰
(4)E装置发生反应的离子方程式是
【测定NaNO2纯度】
(5)本小题可供选择的试剂有:
A. 稀硫酸 B. c1 mol·L-1KI溶液 C. 淀粉溶液 D. c2 mol·L-1 Na2S2O3溶液
E. c3 mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解
您最近一年使用:0次
2016-12-09更新
|
306次组卷
|
4卷引用:2017届江苏省扬中、六合等七校高三上期中化学试卷
解题方法
9 . 氮和硫是参与自然界循环的重要元素,不同价态的硫、氮化合物可相互转化.如反硝化细菌能将 转化为
转化为 。
。 是温室气体之一,目前消除
是温室气体之一,目前消除 的主要方法是直接催化分解法,该过程中发生的反应:
的主要方法是直接催化分解法,该过程中发生的反应: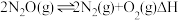 .实验室中可用次氯酸钠溶液吸收
.实验室中可用次氯酸钠溶液吸收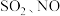 尾气。
尾气。
下列硫及其化合物的性质与用途具有对应关系的是
 转化为
转化为 。
。 是温室气体之一,目前消除
是温室气体之一,目前消除 的主要方法是直接催化分解法,该过程中发生的反应:
的主要方法是直接催化分解法,该过程中发生的反应: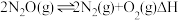 .实验室中可用次氯酸钠溶液吸收
.实验室中可用次氯酸钠溶液吸收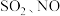 尾气。
尾气。下列硫及其化合物的性质与用途具有对应关系的是
A.S有氧化性,可用于生产 | B. 溶液显碱性,可用于吸收少量 溶液显碱性,可用于吸收少量 |
C. 有还原性,可用于纸浆漂白 有还原性,可用于纸浆漂白 | D.浓 有脱水性,可用作干燥剂 有脱水性,可用作干燥剂 |
您最近一年使用:0次
2022-11-10更新
|
191次组卷
|
2卷引用:江苏省镇江市2022-2023学年高三上学期期中调研考试化学试题
名校
解题方法
10 . 下列氮及其化合物的性质与用途具有对应关系的是
| A.N2难溶于水,可用作瓜果保护气 | B.浓硝酸具有强氧化性,可用于钝化铁、铝 |
| C.NH3具有还原性,可用作制冷剂 | D.HNO3具有强氧化性,可用于制硝酸铵 |
您最近一年使用:0次



