名校
1 . 无水四氯化锡( )常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备
)常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备 并测定产品中
并测定产品中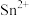 含量。
含量。 熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成
熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成 ),且熔融Sn与
),且熔融Sn与 反应生成
反应生成 时放出大量的热。
时放出大量的热。
②Sn熔点为232℃,无水 熔点为246℃、沸点为652℃。
熔点为246℃、沸点为652℃。
回答下列问题:
(1)a管的作用是___________ 。
(2)装置B、C中的试剂分别为___________ 、___________ (填名称)。
(3)为了获得较纯的产品,当D处具支试管中___________ 时,再点燃D处酒精灯。反应制得的产品中可能会含有杂质 ,为加快反应速率并防止产品中混有
,为加快反应速率并防止产品中混有 ,除了通入过量
,除了通入过量 外,还应控制反应的最佳温度范围为
外,还应控制反应的最佳温度范围为___________ 。
(4)甲同学欲证明装置A产生的气体中含有HCl,设计如图装置进行实验。___________ 。
(5)碘氧化法滴定分析产品中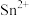 的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b
的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b  碘标准溶液滴定,发生反应:
碘标准溶液滴定,发生反应: 。滴定终点消耗碘标准溶液V mL,则产品中
。滴定终点消耗碘标准溶液V mL,则产品中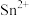 的质量分数为
的质量分数为___________ (用含a、b、V的代数式表示)。
 )常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备
)常用作媒染剂和部分有机合成的催化剂。某化学兴趣小组利用如图装置(部分加热装置略)制备 并测定产品中
并测定产品中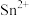 含量。
含量。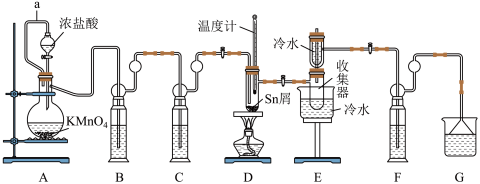
 熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成
熔点为-33℃,沸点为114.1℃,在潮湿空气中极易潮解(水解生成 ),且熔融Sn与
),且熔融Sn与 反应生成
反应生成 时放出大量的热。
时放出大量的热。②Sn熔点为232℃,无水
 熔点为246℃、沸点为652℃。
熔点为246℃、沸点为652℃。回答下列问题:
(1)a管的作用是
(2)装置B、C中的试剂分别为
(3)为了获得较纯的产品,当D处具支试管中
 ,为加快反应速率并防止产品中混有
,为加快反应速率并防止产品中混有 ,除了通入过量
,除了通入过量 外,还应控制反应的最佳温度范围为
外,还应控制反应的最佳温度范围为(4)甲同学欲证明装置A产生的气体中含有HCl,设计如图装置进行实验。

(5)碘氧化法滴定分析产品中
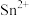 的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b
的含量。准确称取ag产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b  碘标准溶液滴定,发生反应:
碘标准溶液滴定,发生反应: 。滴定终点消耗碘标准溶液V mL,则产品中
。滴定终点消耗碘标准溶液V mL,则产品中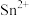 的质量分数为
的质量分数为
您最近一年使用:0次
2023-12-05更新
|
261次组卷
|
5卷引用:安徽省淮南第二中学2024届高三上学期第四次段考化学试题
名校
解题方法
2 . Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为_______ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。
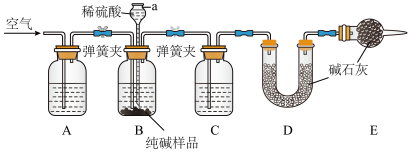
(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若_______ ,说明装置不漏气。
(3)装置A中的试剂为_______ ,装置C中的试剂为_______ 。装置E的作用是_______ 。
(4)实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为_______ (保留一位小数);若缺少E装置,会使测定结果_______ (填“偏高”或“偏低”)。

已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。

(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若
(3)装置A中的试剂为
(4)实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
2023-11-26更新
|
225次组卷
|
3卷引用:安徽省合肥市六校联盟2023-2024学年高一上学期1月期末化学试题
解题方法
3 .  加热到
加热到 以上迅速分解生成
以上迅速分解生成 和
和 .可采用量气法测定样品中
.可采用量气法测定样品中 的含量,量气装置如右图所示(假设杂质不产生气体).
的含量,量气装置如右图所示(假设杂质不产生气体).
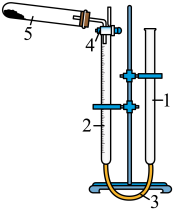
1.水准管;2.量气管;3.乳胶连接管;4.三通活塞;5.装有样品的试管
(1)下列关于使用量气装置的注意事项中,正确的是____________ (填标号)。
A.使用前需要检漏
B.初始读数时量气管与水准管液面要齐平
C.实验结束停止加热后立即读数
D.读数时视线与溶液的凹液面相切
E.最终读数时量气管与水准管液面不需齐平
(2)某同学准确称量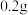 烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到
烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到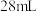 气体(已换算成标准状况).计算样品中
气体(已换算成标准状况).计算样品中 的质量分数
的质量分数________ (写出计算过程)。
 加热到
加热到 以上迅速分解生成
以上迅速分解生成 和
和 .可采用量气法测定样品中
.可采用量气法测定样品中 的含量,量气装置如右图所示(假设杂质不产生气体).
的含量,量气装置如右图所示(假设杂质不产生气体).
1.水准管;2.量气管;3.乳胶连接管;4.三通活塞;5.装有样品的试管
(1)下列关于使用量气装置的注意事项中,正确的是
A.使用前需要检漏
B.初始读数时量气管与水准管液面要齐平
C.实验结束停止加热后立即读数
D.读数时视线与溶液的凹液面相切
E.最终读数时量气管与水准管液面不需齐平
(2)某同学准确称量
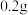 烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到
烘干恒重后的过氧化钙样品置于试管中加热使其完全分解,收集到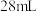 气体(已换算成标准状况).计算样品中
气体(已换算成标准状况).计算样品中 的质量分数
的质量分数
您最近一年使用:0次
4 . 铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al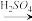 Al3+
Al3+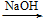
 Al(OH)3↓
Al(OH)3↓
方案2:Al AlO
AlO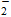
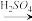 Al(OH)3↓
Al(OH)3↓
方案3: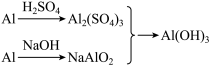
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________ 。
(Ⅱ)工业上冶炼铝的流程图如图所示:
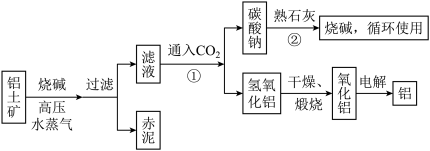
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:
(1)书写化学方程式,反应①________ ,反应②________ 。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________ 。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________ t。
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al
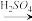 Al3+
Al3+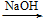
 Al(OH)3↓
Al(OH)3↓方案2:Al
 AlO
AlO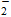
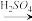 Al(OH)3↓
Al(OH)3↓方案3:
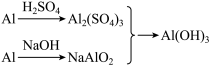
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案
(Ⅱ)工业上冶炼铝的流程图如图所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:
Al2O3 | Fe2O3 | 其他杂质 | |
铝土矿 | 55% | 16% | |
赤泥 | 15% | 48% |
(2)电解氧化铝生产铝时,阳极的电极反应式为
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿
您最近一年使用:0次
2019-06-21更新
|
726次组卷
|
5卷引用:2010-2011学年安徽省天长市关塘中学高二下学期月考化学试题
(已下线)2010-2011学年安徽省天长市关塘中学高二下学期月考化学试题(已下线)2011届四川省南充市高三第二次诊断性考试(理综)化学部分云南省通海三中2018-2019学年高一6月份考试化学试题苏教版高中化学必修2专题四《化学科学与人类文明》测试卷苏教版高一化学必修2专题4《化学科学与人类文明》测试卷
名校
解题方法
5 . 亚氯酸钠有强氧化性,是一种重要的含氯消毒剂,实验室可通过以下原理制备亚氯酸钠:
制备方法:在A装置制备 气体,并将
气体,并将 气体导入B装置中进一步反应得到亚氯酸钠
气体导入B装置中进一步反应得到亚氯酸钠
溶液,最后对B中溶液进行结晶操作获得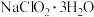 晶体。
晶体。____________ 。
(2)装置A中反应的离子方程式为____________ 。
(3)装置B中 在反应中为
在反应中为____________ (填氧化剂或还原剂),其电子式为______ ,若实验中 气体的流速过快可能会导致产品中混有较多的
气体的流速过快可能会导致产品中混有较多的______ 杂质。
(4)利用上述原理制备出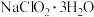 晶体的样品,可以用“间接碘量法”测定样品(杂质与
晶体的样品,可以用“间接碘量法”测定样品(杂质与 和
和 都不反应)的纯度。测定时进行如下实验:准确称取m g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:
都不反应)的纯度。测定时进行如下实验:准确称取m g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应: ,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol⋅L
,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol⋅L
 标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:
标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知: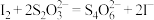 )。
)。
①所称取的样品中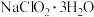 的质量分数为
的质量分数为______ (用含c、V、m的代数式表示)。
②若滴定时其它操作正确,盛装 标准液的滴定管滴定前尖嘴处有气泡而滴定后气泡消失,则所测得
标准液的滴定管滴定前尖嘴处有气泡而滴定后气泡消失,则所测得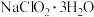 晶体纯度
晶体纯度______ (填偏高、偏低或无影响)。
制备方法:在A装置制备
 气体,并将
气体,并将 气体导入B装置中进一步反应得到亚氯酸钠
气体导入B装置中进一步反应得到亚氯酸钠溶液,最后对B中溶液进行结晶操作获得
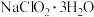 晶体。
晶体。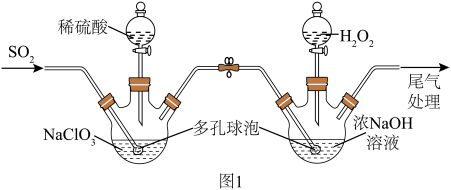
(2)装置A中反应的离子方程式为
(3)装置B中
 在反应中为
在反应中为 气体的流速过快可能会导致产品中混有较多的
气体的流速过快可能会导致产品中混有较多的(4)利用上述原理制备出
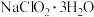 晶体的样品,可以用“间接碘量法”测定样品(杂质与
晶体的样品,可以用“间接碘量法”测定样品(杂质与 和
和 都不反应)的纯度。测定时进行如下实验:准确称取m g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:
都不反应)的纯度。测定时进行如下实验:准确称取m g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应: ,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol⋅L
,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用c mol⋅L
 标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:
标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知: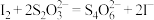 )。
)。①所称取的样品中
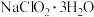 的质量分数为
的质量分数为②若滴定时其它操作正确,盛装
 标准液的滴定管滴定前尖嘴处有气泡而滴定后气泡消失,则所测得
标准液的滴定管滴定前尖嘴处有气泡而滴定后气泡消失,则所测得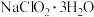 晶体纯度
晶体纯度
您最近一年使用:0次
7日内更新
|
31次组卷
|
2卷引用:安徽省江南十校2023-2024学年高二下学期5月阶段联考化学B试题
名校
6 . 磷酸氢二铵 常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备(NH4)2HPO4,装置如图所示(夹持和搅拌装置已省略)。
常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备(NH4)2HPO4,装置如图所示(夹持和搅拌装置已省略)。
(1)实验室用NH4Cl(s)和Ca(OH)2(s)制备氨气的化学方程式为_______
(2)请为尾气处理选择合适的装置及相应的试剂_______(选填字母)。
(3)现有浓H3PO4质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的H3PO4溶液,则需浓H3PO4_______ mL(保留一位小数)。
(4)装置中活塞K2的作用为_______ 。
(5)当溶液pH为8.0~9.0时,停止通NH3,即可制得(NH4)2HPO4溶液。若继续通入NH3,当pH>10.0时,溶液中OH-、_______ 和_______ (填离子符号)浓度明显增加。
(6)氨的催化氧化:已知NH3在Pt催化和加热条件下与氧气反应,如图是探究氨的催化氧化简易装置,观察到锥形瓶中铂丝保持红热,有红棕色气体或白烟产生,请写出氨的催化氧化的化学方程式:_______ ,白烟为_______ (填化学式)
 常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备(NH4)2HPO4,装置如图所示(夹持和搅拌装置已省略)。
常用于干粉灭火剂。某研究小组用磷酸吸收氨气制备(NH4)2HPO4,装置如图所示(夹持和搅拌装置已省略)。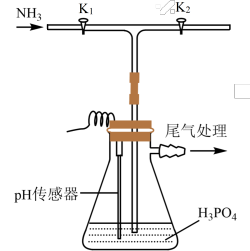
(1)实验室用NH4Cl(s)和Ca(OH)2(s)制备氨气的化学方程式为
(2)请为尾气处理选择合适的装置及相应的试剂_______(选填字母)。
| A.球形干燥管装碱石灰 | B.烧杯装稀硫酸 |
| C.球形干燥管装氧化钙 | D.球形干燥管装CaCl2 |
(3)现有浓H3PO4质量分数为85%,密度为1.7g/mL。若实验需100mL1.7mol/L的H3PO4溶液,则需浓H3PO4
(4)装置中活塞K2的作用为
(5)当溶液pH为8.0~9.0时,停止通NH3,即可制得(NH4)2HPO4溶液。若继续通入NH3,当pH>10.0时,溶液中OH-、
(6)氨的催化氧化:已知NH3在Pt催化和加热条件下与氧气反应,如图是探究氨的催化氧化简易装置,观察到锥形瓶中铂丝保持红热,有红棕色气体或白烟产生,请写出氨的催化氧化的化学方程式:
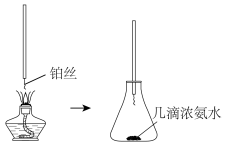
您最近一年使用:0次
名校
7 . 部分含硫物质的类别与相应化合价及部分物质间转化关系如图。下列说法错误的是
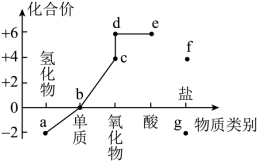
| A.c可以使滴有酚酞的NaOH溶液褪色,适量c可做食品添加剂 |
| B.b附着在试管壁上可以用热的浓NaOH溶液洗涤 |
| C.a在O2中燃烧可以生成d |
| D.e的浓溶液长时间暴露在空气中,质量增大,质量分数减小 |
您最近一年使用:0次
2024-04-10更新
|
317次组卷
|
3卷引用:安徽省六安第二中学河西校区2023-2024学年高一下学期期中考试化学试题
8 . 工业上以磷矿石[主要成分: 、
、 、
、 和有机碳等]为原料生产磷酸和石膏(
和有机碳等]为原料生产磷酸和石膏(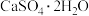 ),流程示意图如下:
),流程示意图如下:
回答下列问题:
(1)为提高酸浸速率,可采取的措施有_______ 。(写出1条即可)
(2)生成的HF与 反应,生成二元强酸
反应,生成二元强酸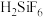 的离子方程式是:
的离子方程式是:_______ 。
(3)酸浸时 与
与 反应的化学方程式是:
反应的化学方程式是:_______ 。
(4)粗磷酸中的有机碳被 氧化为
氧化为 脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析
脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析 时有机碳脱除率最高的原因:
时有机碳脱除率最高的原因:_______ 。
(5)脱氟过程中发生的化学反应方程式是:_______ ,若按物质的量之比 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,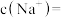
_______ 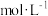 ;
;
(6)脱硫过程中,分批加入一定量的 达到脱硫的目的,其反应离子方程式是
达到脱硫的目的,其反应离子方程式是_______ 。
(7)该工艺中通常使用一定浓度的 溶液洗涤磷石膏(
溶液洗涤磷石膏(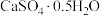 ),原因是
),原因是_____ 。
(8) 浓度(以
浓度(以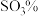 计)、
计)、 浓度(以
浓度(以 计)。一定温度下,石膏存在形式与溶液中
计)。一定温度下,石膏存在形式与溶液中 和
和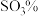 的关系如图所示,下列条件能实现
的关系如图所示,下列条件能实现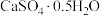 转化为
转化为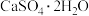 的是
的是_______ (填字母)。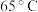 、
、 、
、
B. 、
、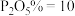 、
、
C.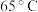 、
、 、
、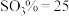
(9)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用 溶液滴定至终点时生成
溶液滴定至终点时生成 ,消耗
,消耗 溶液
溶液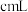 ,精制磷酸中
,精制磷酸中 的质量分数是
的质量分数是_______ 。
 、
、 、
、 和有机碳等]为原料生产磷酸和石膏(
和有机碳等]为原料生产磷酸和石膏(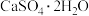 ),流程示意图如下:
),流程示意图如下:
| 物质 | 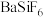 | 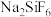 |  |  |  |
 |  |  |  | 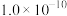 |  |
(1)为提高酸浸速率,可采取的措施有
(2)生成的HF与
 反应,生成二元强酸
反应,生成二元强酸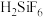 的离子方程式是:
的离子方程式是:(3)酸浸时
 与
与 反应的化学方程式是:
反应的化学方程式是:(4)粗磷酸中的有机碳被
 氧化为
氧化为 脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析
脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析 时有机碳脱除率最高的原因:
时有机碳脱除率最高的原因:温度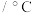 | 40 | 50 | 60 | 70 | 80 | 85 | 90 |
有机碳脱出率约为 | 72 | 75 | 78 | 80 | 82 | 78 | 75 |
 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,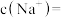
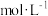 ;
;(6)脱硫过程中,分批加入一定量的
 达到脱硫的目的,其反应离子方程式是
达到脱硫的目的,其反应离子方程式是(7)该工艺中通常使用一定浓度的
 溶液洗涤磷石膏(
溶液洗涤磷石膏(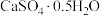 ),原因是
),原因是(8)
 浓度(以
浓度(以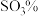 计)、
计)、 浓度(以
浓度(以 计)。一定温度下,石膏存在形式与溶液中
计)。一定温度下,石膏存在形式与溶液中 和
和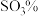 的关系如图所示,下列条件能实现
的关系如图所示,下列条件能实现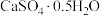 转化为
转化为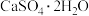 的是
的是
 、
、 、
、
B.
 、
、 、
、
C.
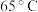 、
、 、
、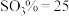
(9)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用
 溶液滴定至终点时生成
溶液滴定至终点时生成 ,消耗
,消耗 溶液
溶液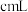 ,精制磷酸中
,精制磷酸中 的质量分数是
的质量分数是
您最近一年使用:0次
名校
解题方法
9 . 铅酸蓄电池由于其技术成熟、安全性高、电压稳定及价格低廉等优势,在电池市场占据主导地位。以方铅可矿(PbS,含少量 )为原料制取
)为原料制取 的流程如图所示:
的流程如图所示:
(1)“酸浸”时温度一般控制在65~90℃,理由是___________ ,酸浸时发生反应的离子方程式为___________ 。
(2)从“酸浸”所得滤渣中回收的 ,可用于
,可用于___________ (任写两种)。
(3)“氧化”时参加反应的氧化剂与还原剂的物质的量之比为___________ 。
(4)若以100kg方铅矿(PbS的质量分数为70%)为原料,最终制得 59.75kg(假设反应过程中Pb无损失),则
59.75kg(假设反应过程中Pb无损失),则 的产率(产率
的产率(产率 )为
)为___________ (保留一位小数)。
(5)铅酸蓄电池为可充电电池,充放电时反应为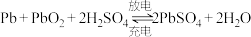 。
。
①放电时 电极的电极反应式为
电极的电极反应式为___________ 。
②充电时 电极发生
电极发生___________ (填“氧化”或“还原”)反应。
 )为原料制取
)为原料制取 的流程如图所示:
的流程如图所示: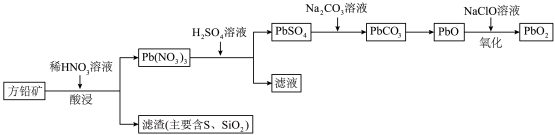
(1)“酸浸”时温度一般控制在65~90℃,理由是
(2)从“酸浸”所得滤渣中回收的
 ,可用于
,可用于(3)“氧化”时参加反应的氧化剂与还原剂的物质的量之比为
(4)若以100kg方铅矿(PbS的质量分数为70%)为原料,最终制得
 59.75kg(假设反应过程中Pb无损失),则
59.75kg(假设反应过程中Pb无损失),则 的产率(产率
的产率(产率 )为
)为(5)铅酸蓄电池为可充电电池,充放电时反应为
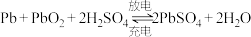 。
。①放电时
 电极的电极反应式为
电极的电极反应式为②充电时
 电极发生
电极发生
您最近一年使用:0次
2024-05-07更新
|
110次组卷
|
2卷引用:安徽省太和中学2023-2024学年高一下学期4月期中考试化学试题
名校
10 . 大连理工大学课题组通过CuO/ 催化,使NO-CO-
催化,使NO-CO- 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: (未配平),
(未配平), 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是
 催化,使NO-CO-
催化,使NO-CO- 反应体系在温和条件下产生
反应体系在温和条件下产生 ,为NO和CO的烟气处理提供了新的途径,其相关的反应为:
,为NO和CO的烟气处理提供了新的途径,其相关的反应为: (未配平),
(未配平), 是阿伏加德罗常数的值,下列有关说法正确的是
是阿伏加德罗常数的值,下列有关说法正确的是A.标准状况下,1.12L NO中含有电子数为1.5 |
B.将 个 个 溶于100mL水中,所得溶液的质量分数约为29.9% 溶于100mL水中,所得溶液的质量分数约为29.9% |
C.生成22g  能消除NO的数目为0.2 能消除NO的数目为0.2 |
D.若NO和CO混合气体的平均相对分子质量为29,则含有CO的数目为0.5 |
您最近一年使用:0次
2024-03-13更新
|
304次组卷
|
4卷引用:安徽省江南十校2023-2024学年高一下学期5月阶段联考化学试题



