1 . Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如图所示实验。
Ⅰ.实验探究
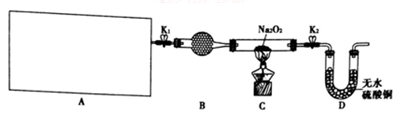
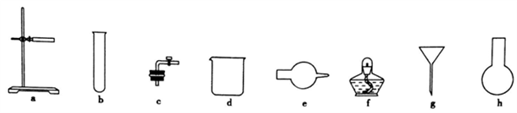
(1)图中A是制取氢气的装置,从图所示的仪器中选择一部分组装成一套能随开随停的装置,选择的仪器编号是_________ 。
(2)装置A中用粗锌和稀盐酸制取氢气,B装置中所盛放的试剂是_________ ,其作用是________ 。
(3)下面是实验过程中的重要操作,正确的顺序是_________ (填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间 B.用小试管收集气体并检验其纯度
C.打开K1、K2 通入氢气 D.停止加热,充分冷却,关闭K1、K2
(4)实验过程中观察到淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推出Na2O2与H2反应的化学方程式为___________________________________________________ 。
Ⅱ.数据处理
(5)实验结束后,该同学欲测定C 装置硬质玻璃管内白色固体中未反应完的Na2O2含量。其操作流程如下:
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和_________ ,操作2的名称是_________ 。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_________ (填“偏 大” “偏小”或“不变”)。
Ⅰ.实验探究


(1)图中A是制取氢气的装置,从图所示的仪器中选择一部分组装成一套能随开随停的装置,选择的仪器编号是
(2)装置A中用粗锌和稀盐酸制取氢气,B装置中所盛放的试剂是
(3)下面是实验过程中的重要操作,正确的顺序是
A.加热至Na2O2逐渐熔化,反应一段时间 B.用小试管收集气体并检验其纯度
C.打开K1、K2 通入氢气 D.停止加热,充分冷却,关闭K1、K2
(4)实验过程中观察到淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推出Na2O2与H2反应的化学方程式为
Ⅱ.数据处理
(5)实验结束后,该同学欲测定C 装置硬质玻璃管内白色固体中未反应完的Na2O2含量。其操作流程如下:

①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数
您最近一年使用:0次
名校
2 . 钪(Sc)及其化合物具有优良的性质,在军工、电化学、光学等领域应用广泛,被视为重要的战略资源。锆冶炼废酸中钪的含量可高达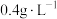 ,具有很高的回收价值。一种从锆冶炼废酸中回收
,具有很高的回收价值。一种从锆冶炼废酸中回收 的流程如图。
的流程如图。
(1)基态Sc原子的价层电子排布式为___________ 。
(2)“萃取”时需要用到的玻璃仪器有烧杯、___________ 。
(3)写出“草酸沉钪”时发生反应的离子方程式:___________ 。草酸钪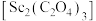 在空气中“煅烧”生成
在空气中“煅烧”生成 的化学方程式为
的化学方程式为___________ 。
(4)某锆冶炼废酸中钪的含量为 ,Sc元素的总回收率为90%,则处理1L。该废酸可回收
,Sc元素的总回收率为90%,则处理1L。该废酸可回收 的质量为
的质量为___________ mg。
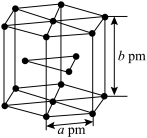
(5) 可通过铝热反应制备单质钪,其化学方程式为
可通过铝热反应制备单质钪,其化学方程式为___________ 。金属钪晶体的部分结构如图所示,则一个晶胞中所含钪原子的个数为___________ ;设 为阿伏加德罗常数的值,晶体的密度
为阿伏加德罗常数的值,晶体的密度
___________  。
。
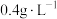 ,具有很高的回收价值。一种从锆冶炼废酸中回收
,具有很高的回收价值。一种从锆冶炼废酸中回收 的流程如图。
的流程如图。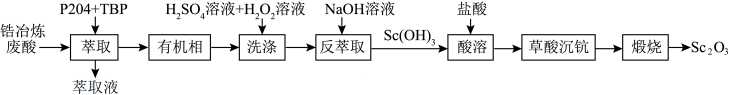
(1)基态Sc原子的价层电子排布式为
(2)“萃取”时需要用到的玻璃仪器有烧杯、
(3)写出“草酸沉钪”时发生反应的离子方程式:
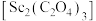 在空气中“煅烧”生成
在空气中“煅烧”生成 的化学方程式为
的化学方程式为(4)某锆冶炼废酸中钪的含量为
 ,Sc元素的总回收率为90%,则处理1L。该废酸可回收
,Sc元素的总回收率为90%,则处理1L。该废酸可回收 的质量为
的质量为(5)
 可通过铝热反应制备单质钪,其化学方程式为
可通过铝热反应制备单质钪,其化学方程式为 为阿伏加德罗常数的值,晶体的密度
为阿伏加德罗常数的值,晶体的密度
 。
。
您最近一年使用:0次
2024-09-15更新
|
42次组卷
|
3卷引用:广西防城港市实验高级中学2024-2025学年高三上学期第一次月考化学试卷
名校
解题方法
3 . 下列玻璃仪器选择合理且能完成相应实验(夹持装置略去)的是
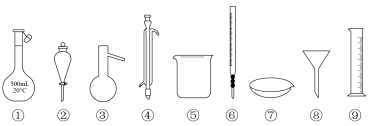
| A.配制500mL 40%的硫酸溶液:①④⑤⑨ |
| B.分离四氯化碳和碘单质的混合物:③④⑥ |
C.测定 晶体中结晶水的含量:③⑤⑦⑧ 晶体中结晶水的含量:③⑤⑦⑧ |
| D.用饱和碳酸钠溶液提纯乙酸乙酯(含少量乙酸):②⑤ |
您最近一年使用:0次
2024-09-15更新
|
74次组卷
|
3卷引用:广西防城港市实验高级中学2024-2025学年高三上学期第一次月考化学试卷
4 . 如图所示的体检指标中,表示总胆红素指标的物理量是( )
| 项目名称 | 结果 | 单位 | 参考值 | |
| 1 | 谷丙转氨酶 | 7 | U/L |  |
| 2 | 谷草转氨酶 | 16 | U/L | 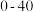 |
| 3 | 谷酰转肽酶 | 15 | U/L | 0-50 |
 | 碱性磷酸酶 | 77 | U/L | 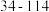 |
| 5 | 总胆红素 | 12.3 | umol/L | 0-19 |
| 6 | 总蛋白 | 70.06 | g/L | 60-80 |
| 7 | 白蛋白 | 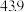 | g/L | 35-55 |
| 8 | 球蛋白 | 26.7 | g/L | 20-30 |
| 9 | 白球化 | 1.6 | 1.5-2.5 | |
| 10 | 乳酸脱氢酶 | 161 | U/L |  |
| 11 | 磷酸肌酸激酶 | 56 | U/L | 25-200 |
| 12 | 甘油三酯 | 0.52 | mmol/L | 0-1.71 |
| 13 | 总胆固醇 | 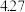 | mmol/L | 3.6-5.18 |
 | 高密度脂蛋白胆固醇 | 1.57 | mmol/L | 1.0-1.6 |
| 15 | 低密度脂蛋白胆固醇 |  | mmol/L | 0-3.36 |
| 16 | 葡萄糖 | 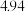 | mmol/L | 3.61-6.11 |
| 送检日期: | 2002-09-16 | 报告日期: | 2002-09-16 | |
| A.质量分数 | B.溶解度 | C.物质的量浓度 | D.摩尔质量 |
您最近一年使用:0次
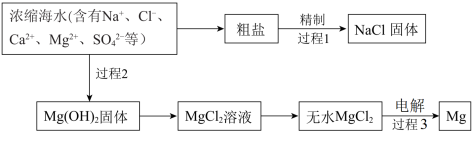
5 . 浩瀚的海洋中蕴藏着丰富的资源。_______ 、_______ 。(填写两种)
②过程1是粗盐的精制。除去粗盐中的 、
、 、
、 杂质时,粗盐溶解后加入试剂:
杂质时,粗盐溶解后加入试剂:
a.过量的 溶液 b.过量的
溶液 b.过量的 溶液
溶液
c.过量的 溶液 d.适量稀盐酸
溶液 d.适量稀盐酸
加入试剂的顺序正确的是_______ (填序号)。
A.bcad B.dacb C.cbad D.badc
(2)浓缩海水可用于提取镁。
①为使浓缩海水中的 转化为
转化为 ,从原料来源及经济效益角度考虑,试剂最好选用
,从原料来源及经济效益角度考虑,试剂最好选用_______ 。
a.氨水 b.氧化钙 c.氢氧化钠
②过程3的化学方程式为_______ 。
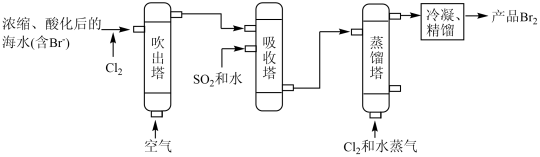
(3)海水提溴。
主要工业生产流程如图所示: ,利用了
,利用了 的
的_______ ,吸收塔中吸收 ,利用了
,利用了 的
的_______ (填序号)。
a.氧化性 b.还原性 c.挥发性
②吸收塔中 将
将 转化为
转化为 的离子方程式是
的离子方程式是_______ 。
③若进入蒸馏塔的海水中溴的含量为 ,欲提取
,欲提取 该浓度的海水,理论通入蒸馏塔中参与反应的氯气体积为
该浓度的海水,理论通入蒸馏塔中参与反应的氯气体积为_______ L(标标准状况下)。
②过程1是粗盐的精制。除去粗盐中的
 、
、 、
、 杂质时,粗盐溶解后加入试剂:
杂质时,粗盐溶解后加入试剂:a.过量的
 溶液 b.过量的
溶液 b.过量的 溶液
溶液c.过量的
 溶液 d.适量稀盐酸
溶液 d.适量稀盐酸加入试剂的顺序正确的是
A.bcad B.dacb C.cbad D.badc
(2)浓缩海水可用于提取镁。
①为使浓缩海水中的
 转化为
转化为 ,从原料来源及经济效益角度考虑,试剂最好选用
,从原料来源及经济效益角度考虑,试剂最好选用a.氨水 b.氧化钙 c.氢氧化钠
②过程3的化学方程式为
(3)海水提溴。
主要工业生产流程如图所示:
 ,利用了
,利用了 的
的 ,利用了
,利用了 的
的a.氧化性 b.还原性 c.挥发性
②吸收塔中
 将
将 转化为
转化为 的离子方程式是
的离子方程式是③若进入蒸馏塔的海水中溴的含量为
 ,欲提取
,欲提取 该浓度的海水,理论通入蒸馏塔中参与反应的氯气体积为
该浓度的海水,理论通入蒸馏塔中参与反应的氯气体积为
您最近一年使用:0次
2022-07-05更新
|
874次组卷
|
4卷引用:广西壮族自治区防城港市2023-2024学年高一下学期7月期末考试化学试题
6 . 新冠肺炎疫情出现以来,一系列举措体现了中国力量。下列有关说法错误的是
| A.新型冠状病毒主要由 C、H、O、N、S等元素组成,常用质量分数为75% 的医用酒精杀灭新型冠状病毒 |
| B.N95型口罩的核心材料是聚丙烯,属于有机高分子材料 |
| C.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃 |
| D.防疫时期很多家庭都备有水银温度计,若不慎打破,应立即用硫磺粉末覆盖 |
您最近一年使用:0次
2020-06-17更新
|
172次组卷
|
2卷引用:广西防城港市防城中学2020届高三上学期10月月考化学试题
名校
解题方法
7 . 在一定温度下的定容容器中,当下列物理量不再发生变化时,能说明I2(g)+H2(g)⇌2HI(g)能说明达到平衡状态的是:
①混合气体的压强
②混合气体的密度
③混合气体的总物质的量
④混合气体的平均相对分子质量
⑤混合气体的颜色
⑥各反应物或生成物的浓度之比等于化学计量数之比
⑦某种气体的百分含量
①混合气体的压强
②混合气体的密度
③混合气体的总物质的量
④混合气体的平均相对分子质量
⑤混合气体的颜色
⑥各反应物或生成物的浓度之比等于化学计量数之比
⑦某种气体的百分含量
| A.⑤⑦ | B.①② | C.④⑥⑦ | D.②④⑥⑦ |
您最近一年使用:0次
2020-11-29更新
|
512次组卷
|
6卷引用:广西防城港市实验高级中学2020-2021学年高二上学期期中考试化学试题
名校
8 . 实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
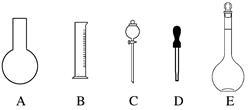
(1)①如图所示的仪器中配制溶液肯定不需要的是____________________ (填字母),
②配制上述溶液还需用到的玻璃仪器是__________________ (填仪器名称)。
③下列有关容量瓶使用说法不正确的是( )
a.容量瓶使用前一定要检查是否漏液。其操作为装水盖上瓶塞→倒立观察是否漏夜→正立→玻璃塞旋转180°→再倒立观察是否漏夜。
b.不能作为反应容器或长期贮存溶液的容器;但是可以配制任意体积的溶液。
c.不能将固体或浓溶液直接在容量瓶中溶解或稀释;不能加入过冷或过热的液体 。
d.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________ g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___________ (填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯和玻璃棒→洗涤液移入容量瓶→定容,则所得溶液浓度___________ (填“>”、“<”或“=”) 0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为__________ (计算结果保留一位小数)mL;
②如果实验室有15 mL、50 mL、100 mL量筒,应选用___________ mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________ 。

(1)①如图所示的仪器中配制溶液肯定不需要的是
②配制上述溶液还需用到的玻璃仪器是
③下列有关容量瓶使用说法不正确的是
a.容量瓶使用前一定要检查是否漏液。其操作为装水盖上瓶塞→倒立观察是否漏夜→正立→玻璃塞旋转180°→再倒立观察是否漏夜。
b.不能作为反应容器或长期贮存溶液的容器;但是可以配制任意体积的溶液。
c.不能将固体或浓溶液直接在容量瓶中溶解或稀释;不能加入过冷或过热的液体 。
d.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯和玻璃棒→洗涤液移入容量瓶→定容,则所得溶液浓度
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
②如果实验室有15 mL、50 mL、100 mL量筒,应选用
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是
您最近一年使用:0次
2019-01-30更新
|
259次组卷
|
9卷引用:广西防城港市2020—2021学年高一上学期期中测试化学试题
广西防城港市2020—2021学年高一上学期期中测试化学试题2016-2017学年黑龙江大庆铁人中学高一阶段考一化学卷【全国百强校】宁夏回族自治区银川一中2019届高三第一次月考化学试题云南省楚雄州大姚第一中学2019届高三第一次月考化学试题河南省驻马店经济开发区高级中学2019届高三上学期第一次月考化学试题【全国百强校】宁夏回族自治区石嘴山市第三中学2018-2019学年高一上学期第二次(12月)月考化学试题黑龙江省大庆市铁人中学2019-2020学年高一10月月考化学试题宁夏银川一中2019-2020学年高一上学期期中考试化学试题河南省洛阳市第一中学2020-2021学年高一上学期第一次月考化学试题
9 . 一定温度下在容积不变的密闭容器中发生可逆反应2X(g)  Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
 Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是| A.密闭容器内的压强不再变化 |
| B.反应容器中Y的质量分数不变 |
| C.X的分解速率与Y的生成速率相等 |
| D.单位时间内生成1mol Y的同时生成2molX |
您最近一年使用:0次
2019-05-15更新
|
227次组卷
|
2卷引用:广西防城港市防城中学2020-2021学年高一下学期期中考试化学试题
10 . 我国著名的化学家、教育家徐光宪先胜因在稀土金属等研究领域做出杰出贡献,荣获了2008年度“国家最高科学技术奖”。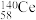 是地壳中含量最高的稀土金属饰元素。下列关于
是地壳中含量最高的稀土金属饰元素。下列关于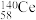 的说法错误的是( )
的说法错误的是( )
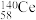 是地壳中含量最高的稀土金属饰元素。下列关于
是地壳中含量最高的稀土金属饰元素。下列关于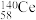 的说法错误的是( )
的说法错误的是( )| A.质量数为140 | B.中子数为82 |
| C.质子数为58 | D.核外电子数为198 |
您最近一年使用:0次



