名校
1 . 氮是自然界中生物体生命活动不可缺少的重要元素,其化合物种类丰富。
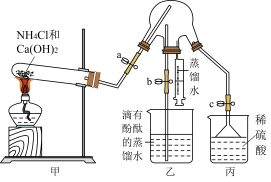
Ⅰ.氨是重要的化工原料,某同学设计如图装置制备氨气并进行氨气的性质检验,部分夹持装置己省略,请回答下列问题: 的电子式为
的电子式为___________ 。
(2)试管内发生反应的化学方程式为___________ 。
(3)①实验之前先检验装置的气密性,然后放入试剂,打开止水夹a、c,关闭止水夹b,再点燃酒精灯,实验过程中丙装置的作用是___________ 。
②一段时间后, 充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为
充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为___________ 。
③为提高乙装置中实验的成功率,将盛放有___________ 的干燥管连接在甲、乙装置之间。
Ⅱ.研究氮的循环和转化对生产、生活有重要的价值,某工厂制硝酸的流程如图所示。___________ (填“ⅰ”“ⅱ”或“ⅲ”)。
(5)写出“氧化炉”中反应的化学方程式___________ 。
(6)“吸收塔”排出的尾气中会含有NO、 等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与
等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与 反应的化学方程式补充完整:
反应的化学方程式补充完整:______ 。
 ___________
___________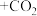 。
。
Ⅰ.氨是重要的化工原料,某同学设计如图装置制备氨气并进行氨气的性质检验,部分夹持装置己省略,请回答下列问题:
 的电子式为
的电子式为(2)试管内发生反应的化学方程式为
(3)①实验之前先检验装置的气密性,然后放入试剂,打开止水夹a、c,关闭止水夹b,再点燃酒精灯,实验过程中丙装置的作用是
②一段时间后,
 充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为
充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为③为提高乙装置中实验的成功率,将盛放有
Ⅱ.研究氮的循环和转化对生产、生活有重要的价值,某工厂制硝酸的流程如图所示。
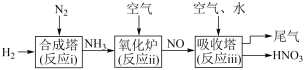
(5)写出“氧化炉”中反应的化学方程式
(6)“吸收塔”排出的尾气中会含有NO、
 等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与
等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与 反应的化学方程式补充完整:
反应的化学方程式补充完整: ___________
___________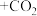 。
。
您最近一年使用:0次
名校
2 . 下列实验目的、操作、现象及结论合理的是
| 实验目的 | 实验操作 | 现象及结论 | |
| A | 检验CO还原Fe2O3的生成物中是否含有Fe3O4 | 取反应后的固体溶于稀盐酸,滴加KSCN溶液 | 若溶液变红色,则还原产物中含有Fe3O4 |
| B | 比较Fe3+和I2氧化性强弱 | 向FeCl3溶液中滴加淀粉碘化钾溶液 | 若溶液变蓝色,则氧化性:Fe3+>I2 |
| C | 检验FeCl3溶液中是否含有Fe2+ | 向溶液中滴加酸性KMnO4溶液 | 若紫红色退去,则溶液中含有Fe2+ |
| D | 检验溶液中是否含有CO | 取少量溶液于试管中,滴加稀盐酸 | 若产生的气体能使澄清石灰水变浑浊,则溶液中含有CO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-02更新
|
803次组卷
|
4卷引用:广西防城港市实验高级中学2022-2023学年高一下学期期中考试化学试题
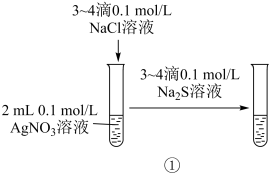
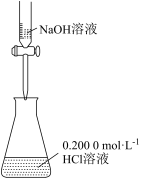
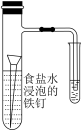
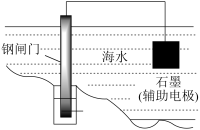
3 . 用下列仪器或装置(图中夹持装置略)进行相应实验,能达到实验目的的是
| A | B | C | D |
| 验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 | 酸碱中和滴定实验 | 验证铁的吸氧腐蚀 | 减缓钢闸门的腐蚀 |
|
|
|
|
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-17更新
|
124次组卷
|
2卷引用:广西防城港市实验高级中学2023-2024学年高二下学期期中考试化学试题
4 . 下列实验操作及现象能够达成相应实验目的的是
| 实验目的 | 实验操作及现象 | |
| A | 除去铜中的氧化铜 | 加入稀硝酸,溶解过滤、洗涤干燥 |
| B | 证明Ksp(AgCl)>Ksp(AgI) | 向含等浓度的NaCl、NaI混合溶液中滴加硝酸银溶液,首先生成黄色沉淀 |
| C | 证明碳的非金属性强于硅 | 将浓盐酸滴入碳酸钠固体中,生成的气体通入盛有水玻璃的试管中,出现浑浊 |
| D | 证明SO2具有漂白性 | 将SO2 通入酸性KMnO4 溶液中,溶液紫色褪去 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 下列根据实验操作和现象所得出的结论正确的是
| 实验操作 | 现象 | 解释或结论 | |
| A | 向酸性KMnO4溶液中通入SO2 | 溶液紫红色褪去 | SO2具有漂白性 |
| B | 在镁、铝为电极,氢氧化钠为电解质的原电池装置 | 镁表面有气泡 | 金属活动性:Al>Mg |
| C | 测定等物质的量浓度的NaCl与Na2CO3溶液的pH | 后者较大 | 非金属性:Cl>C |
| D | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HB酸性比HA强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-06-01更新
|
781次组卷
|
3卷引用:广西防城港市防城中学2020届高三上学期10月月考化学试题
名校
解题方法
6 . 二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0°C,浓度高时极易爆炸。某研究小组在实验室按如图所示的装置,用干燥的氯气与固体亚氯酸钠制备二氧化氯,请回答下列问题:

(1)B装置使用的试液X为___________ ,其作用是___________ 。
(2)装置E的作用是___________ 。
(3)装置D中冰水的主要作用是___________ ,往D中通入氯气的同时还通入干燥的空气,其主要目的是___________ 。
(4)装置D内发生反应的化学方程式为___________ 。
(5)工业上可在酸性条件下用双氧水与NaClO3反应制备ClO2,该反应的离子方程式为___________ 。

(1)B装置使用的试液X为
(2)装置E的作用是
(3)装置D中冰水的主要作用是
(4)装置D内发生反应的化学方程式为
(5)工业上可在酸性条件下用双氧水与NaClO3反应制备ClO2,该反应的离子方程式为
您最近一年使用:0次
7 . 第VA族元素单质及其化合物在生产、生活中有重要的用途。
(1)下列说法正确的是__________ (填序号)。
a.含氧酸的酸性:HNO3>H3PO4>H3AsO4 b.原子半径:S >P>As
c.氢化物的稳定性NH3>PH3> AsH3d.AsH3电子式是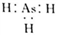
(2)雌黄(As2S3 )和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
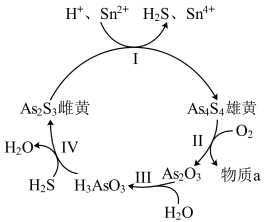
①Ⅱ中若1molAs4S4反应转移28mole-,a物质是__________ 。
②Ⅰ中反应的离子方程式是____________________________________ 。
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示。
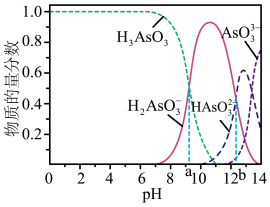
①人体血液的pH在7.35~7.45 之间,用药后人体中含砷元素的主要微粒是___________ 。
②H3AsO3的一级电离常数是6×10-10mol·L-1,n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液的pH=___________ (列出计算式即可)。
(4)由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如图所示:
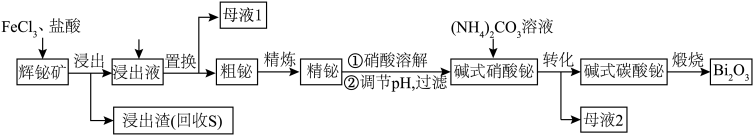
①“浸出”时Bi2S3与FeCl3 溶液反应的离子方程式为________________________________ 。
②“置换”时生成单质铋的离子方程式为____________________________________ 。
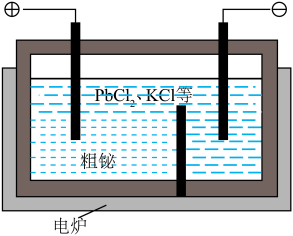
③“粗铋”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,其装置示意图如所示。电解后阳极底部留下的为精铋。写出阳极电极反应的方程式__________________________ 。
(1)下列说法正确的是
a.含氧酸的酸性:HNO3>H3PO4>H3AsO4 b.原子半径:S >P>As
c.氢化物的稳定性NH3>PH3> AsH3d.AsH3电子式是
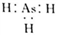
(2)雌黄(As2S3 )和雄黄(As4S4)都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。

①Ⅱ中若1molAs4S4反应转移28mole-,a物质是
②Ⅰ中反应的离子方程式是
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH关系如图所示。

①人体血液的pH在7.35~7.45 之间,用药后人体中含砷元素的主要微粒是
②H3AsO3的一级电离常数是6×10-10mol·L-1,n(H3AsO3)∶n(H2AsO3-)=1∶1时,溶液的pH=
(4)由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如图所示:

①“浸出”时Bi2S3与FeCl3 溶液反应的离子方程式为
②“置换”时生成单质铋的离子方程式为
③“粗铋”中含有的杂质主要是Pb,通过熔融盐电解精炼可达到除杂的目的,其装置示意图如所示。电解后阳极底部留下的为精铋。写出阳极电极反应的方程式

您最近一年使用:0次