名校
解题方法
1 . 1869年,俄国化学家门捷列夫制作了第一张元素周期表,下表是元素周期表的一部分,表中①~⑧代表8种元素。
回答下列问题:
(1)②的元素名称是______ 。
(2)画出⑥的原子结构示意图______ ,写出③与⑦形成的离子化合物的电子式______ 。
(3)③④⑧对应的简单离子半径最小的是______ (用离子符号表示)。
(4)写出⑤的单质与③的最高价氧化物对应水化物反应的离子方程式______ 。
(5)下列说法能证明非金属性⑧强于⑦的是______ (填字母)。
a.简单阴离子的还原性:⑧>⑦ b.简单氢化物的稳定性:⑧>⑦
c.氧化物对应的水化物的酸性:⑧>⑦
(6)由①⑧组成的化合物是______ (填“离子化合物”或“共价化合物”),该化合物的某浓溶液的密度为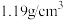 ,溶质质量分数为36.5%,其物质的量浓度为
,溶质质量分数为36.5%,其物质的量浓度为______ mol/L。
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)②的元素名称是
(2)画出⑥的原子结构示意图
(3)③④⑧对应的简单离子半径最小的是
(4)写出⑤的单质与③的最高价氧化物对应水化物反应的离子方程式
(5)下列说法能证明非金属性⑧强于⑦的是
a.简单阴离子的还原性:⑧>⑦ b.简单氢化物的稳定性:⑧>⑦
c.氧化物对应的水化物的酸性:⑧>⑦
(6)由①⑧组成的化合物是
 ,溶质质量分数为36.5%,其物质的量浓度为
,溶质质量分数为36.5%,其物质的量浓度为
您最近一年使用:0次
2024-01-22更新
|
109次组卷
|
2卷引用:四川省眉山市2023-2024学年高一上学期期末教学质量检测化学试题
名校
2 . 某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是
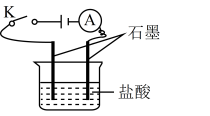

| A.闭合开关K,电流表计指针发生偏转,证明盐酸是电解质 |
| B.闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流表指针不发生变化 |
| C.闭合开关K,向溶液中加入少量NaOH固体,电流表示数基本不变 |
| D.用等体积、且与上述盐酸含有相同微粒数的醋酸溶液,电流表的示数相同 |
您最近一年使用:0次
2023-11-02更新
|
97次组卷
|
2卷引用:四川省眉山市仁寿县铧强中学 眉山天府新区实验中学2023-2024学年高二上学期11月期中联考化学试题
名校
解题方法
3 . 下列有关分散系说法正确的是
| A.从外观上无法区分FeCl3溶液和Fe(OH)3胶体 |
| B.丁达尔效应是胶体和溶液的本质区别 |
| C.将碳酸钙经过特殊加工制成纳米碳酸钙,化学性质没有明显变化 |
| D.Fe(OH)3胶体电泳的实验中,阴极附近颜色加深,阳极附近颜色变浅,证明Fe(OH)3胶体带正电 |
您最近一年使用:0次
2020-11-21更新
|
700次组卷
|
8卷引用:四川省眉山市仁寿县龙正中学、清水中学2021-2022学年高一上学期期中联考化学试题
四川省眉山市仁寿县龙正中学、清水中学2021-2022学年高一上学期期中联考化学试题河北省衡水中学2021届高三上学期期中考试化学 试题(已下线)2021年秋季高三化学开学摸底考试卷02(山东专用)上海交通大学附属中学2021-2022学年高一下学期开学摸底考试化学试题新疆生产建设兵团第十师北屯高级中学2021-2022学年高一上学期9月月考化学试题辽宁省锦州市黑山县黑山中学2022-2023学年高三上学期9月月考化学试题(已下线)专题01 物质的组成与分类 传统文化-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)河北省唐山市开滦第一中学2022-2023学年高三上学期11月期中考试化学试题
4 . 临床证明磷酸氯喹对治疗新冠肺炎有一定的疗效,磷酸氯喹常温下为固体,化学式为C18H32ClN3O8P2。NA表示阿伏加德罗常数的值,下列关于磷酸氯喹的说法正确的是
| A.磷酸氯喹的摩尔质量为515.5 |
| B.含0.3NA个P原子的C18H32ClN3O8P2物质的量为0.1mol |
| C.标准状况下,4.48LC18H32CIN3O8P2含有0.2NA个氯原子 |
| D.10g磷酸氯喹中m(H):m(O)=1:4 |
您最近一年使用:0次
2021-09-20更新
|
427次组卷
|
6卷引用:四川省仁寿县第二中学2021-2022学年高一上学期第一次教学质量检测化学试题
20-21高三·山东·开学考试
名校
解题方法
5 . 临床证明磷酸氯喹对治疗“新冠肺炎”有良好的疗效,4,7-二氯喹啉是合成磷酸氯喹的一种中间体,其结构简式如图所示。下列有关该物质的说法正确的是
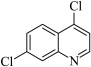

| A.1mol4,7-二氯喹啉最多能和4molH2发生加成反应 |
| B.分子中所有原子在同一平面上 |
| C.分子式为C9H6NCl2 |
| D.4,7-二氯喹啉的一溴代物有7种 |
您最近一年使用:0次
2021-08-27更新
|
345次组卷
|
5卷引用:四川省眉山市仁寿第一中学南校区2021-2022学年高二上学期入学考试化学试题
6 . 下列有关实验说法正确的是
| A.萃取Br2时,向盛有溴水的分液漏斗中加入CCl4,振荡、静置分层后,打开旋塞,先将水层从下口放出 |
| B.做焰色反应前,铂丝用稀盐酸清洗并灼烧至与原来的火焰颜色相同为止 |
| C.将混有泥沙、Na2SO4、CaCl2等杂质的粗盐通过溶解、过滤、蒸发结晶可得到纯净的NaCl |
| D.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ |
您最近一年使用:0次
2021-02-01更新
|
157次组卷
|
3卷引用:四川省眉山市2020-2021学年高一上期期末考试化学试题
解题方法
7 . 研究含氮、含氯物质的转化是工业、农业、医药、环保等领域的重要课题,以下是其中两类常见研究。
I.研究氨催化氧化制硝酸,其流程示意图如下:
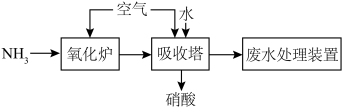
(1)“氧化炉”中还原剂为___________ (填化学式)。
(2)“吸收塔”中生成硝酸的化学方程式为___________ 。(写出一个即可)
(3)为避免硝酸工业废气中 污染环境,常用NaOH溶液吸收,其反应原理如下:
污染环境,常用NaOH溶液吸收,其反应原理如下:
①
②
现有一定条件下0.5mol 和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为
和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为___________ mol/L。
II.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题
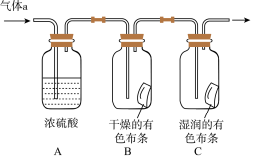
(4)浓硫酸的作用是___________ 。
(5)证明氯气和水反应的实验现象为___________ 。
(6)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是___________ 。
(7)漂白粉溶于水后,遇到空气中的 ,即产生漂白、杀菌作用,反应的化学方程式是
,即产生漂白、杀菌作用,反应的化学方程式是___________ 。
I.研究氨催化氧化制硝酸,其流程示意图如下:

(1)“氧化炉”中还原剂为
(2)“吸收塔”中生成硝酸的化学方程式为
(3)为避免硝酸工业废气中
 污染环境,常用NaOH溶液吸收,其反应原理如下:
污染环境,常用NaOH溶液吸收,其反应原理如下:①

②

现有一定条件下0.5mol
 和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为
和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为II.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题

(4)浓硫酸的作用是
(5)证明氯气和水反应的实验现象为
(6)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是
(7)漂白粉溶于水后,遇到空气中的
 ,即产生漂白、杀菌作用,反应的化学方程式是
,即产生漂白、杀菌作用,反应的化学方程式是
您最近一年使用:0次
解题方法
8 . 钛、钒、铬、铁、镍、铜等过渡金属及其化合物在工业上有重要用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态 原子价层电子排布式为
原子价层电子排布式为___________ 。
②基态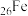 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种。
(2)Ti的四卤化物熔点如下表所示,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是___________ 。
(3)制备 的反应为
的反应为 。
。
①上述化学方程式中非金属元素电负性由小到大的顺序为___________ (用元素符号表示)。
② 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中π键和σ键的个数比为
分子中π键和σ键的个数比为___________ ,中心原子的杂化方式为___________ 。
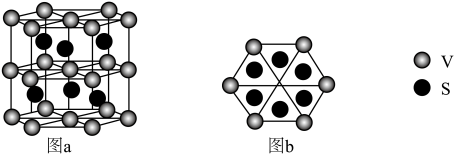
(4)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:___________ 。
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是___________ 。
③能准确证明该钒的硫化物是晶体的最可靠的科学方法是___________ 。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态
 原子价层电子排布式为
原子价层电子排布式为②基态
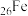 原子核外电子的运动状态有
原子核外电子的运动状态有(2)Ti的四卤化物熔点如下表所示,自
 至
至 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  |  |
| 熔点/℃ | -24.12 | 38.3 | 155 |
(3)制备
 的反应为
的反应为 。
。①上述化学方程式中非金属元素电负性由小到大的顺序为
②
 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中π键和σ键的个数比为
分子中π键和σ键的个数比为(4)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是
③能准确证明该钒的硫化物是晶体的最可靠的科学方法是
您最近一年使用:0次
9 . 下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
(1)可以证明醋酸是弱酸的事实是_____ (填字母序号)
A.醋酸和水能以任意比例混溶
B.在醋酸水溶液中还含有未电离的醋酸分子
C.醋酸与 溶液反应放出
溶液反应放出 气体
气体
D. 的醋酸水溶液能使紫色石蕊溶液变红色
的醋酸水溶液能使紫色石蕊溶液变红色
E.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,最强的酸是_____ (用化学式表示)。
②下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是_____ 。
A.升高温度 B.加水稀释 C.加少量的 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式_____ 。
(3)已知水溶液中 和
和 的关系如图所示:
的关系如图所示:
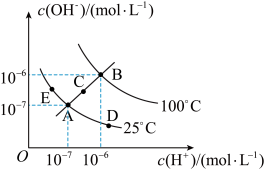
①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是_____ 。
②若A点到E点,可采用的措施是_____ (填序号,下同);促进水的电离平衡正向移动的措施是_____ 。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
③室温下,在由水电离产生的 浓度为
浓度为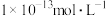 的溶液中,一定能大量共存的离子组是
的溶液中,一定能大量共存的离子组是_____ 。
a. 、
、 、
、 、
、 b.
b. 、
、 、
、 、
、
c. 、
、 、
、 、
、 d.
d. 、
、 、
、 、
、
e. 、
、 、
、 、
、
| 酸 |  |  | HCN | HClO |
电离平衡常数( ) ) |  |  | 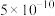 |  |
(1)可以证明醋酸是弱酸的事实是
A.醋酸和水能以任意比例混溶
B.在醋酸水溶液中还含有未电离的醋酸分子
C.醋酸与
 溶液反应放出
溶液反应放出 气体
气体D.
 的醋酸水溶液能使紫色石蕊溶液变红色
的醋酸水溶液能使紫色石蕊溶液变红色E.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,最强的酸是
②下列能使醋酸溶液中
 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是A.升高温度 B.加水稀释 C.加少量的
 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式
(3)已知水溶液中
 和
和 的关系如图所示:
的关系如图所示:
①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是
②若A点到E点,可采用的措施是
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
③室温下,在由水电离产生的
 浓度为
浓度为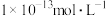 的溶液中,一定能大量共存的离子组是
的溶液中,一定能大量共存的离子组是a.
 、
、 、
、 、
、 b.
b. 、
、 、
、 、
、
c.
 、
、 、
、 、
、 d.
d. 、
、 、
、 、
、
e.
 、
、 、
、 、
、
您最近一年使用:0次
10 . 元素周期表反映元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分,请回答下列问题:

(1)元素②、③、⑥的简单离子半径由大到小的排序为_______ (填离子符号)。
(2)②和④组成的物质中含有_______ 键,可以证明该化合物含有此类型化学键的实验事实为_________ 。
(3)⑤的氧化物和⑥的最高价氧化物对应的水化物反应的离子方程式为_____________ 。
(4)已知④的单质与①的最高价氧化物A在点燃条件下能反应生成黑色单质,推测③的单质______ (填“能”或“不能”)与A反应,说明推测的理由________ 。

(1)元素②、③、⑥的简单离子半径由大到小的排序为
(2)②和④组成的物质中含有
(3)⑤的氧化物和⑥的最高价氧化物对应的水化物反应的离子方程式为
(4)已知④的单质与①的最高价氧化物A在点燃条件下能反应生成黑色单质,推测③的单质
您最近一年使用:0次



