1 . 下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如图实验装置并分析实验原理,判断下列说法错误的是
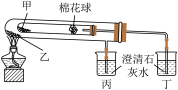

| A.此实验设计巧妙,对比实验,现象明显 |
| B.要证明物质受热能产生水,可在两支试管内塞上沾有无水硫酸铜粉末的棉花球 |
| C.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊 |
D.甲为 ,乙为 ,乙为 |
您最近一年使用:0次
名校
解题方法
2 . 活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于水的杂质)制备ZnO,工艺流程图所示:___________ ,常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释___________ 。
(2)加入H2O2的目的是___________ ;“调pH”时除ZnO外还可以选用的物质是___________ 。
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了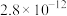 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为___________ 。证明Fe3+已除尽的化学方法是___________ 。
(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:___________ 。
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。

(2)加入H2O2的目的是
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了
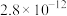 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。
| A.粗锌作阳极,纯锌作阴极,电解质溶液是硫酸锌溶液 |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Al3+、Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu |
您最近一年使用:0次
3 . 下列实验操作或装置能达到相应目的的是
| A | B | C | D |
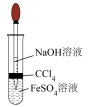 | 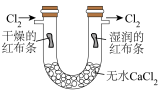 | 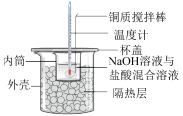 |  |
制备 | 验证干燥的氯气是否有漂白性 | 中和反应反应热的测定 | 证明化学反应存在一定的限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 恒温恒容,4A(s)+3B(g) 2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是
2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是
 2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是
2C(g)+D(g)经2min,B的浓度减少0.6mol•L-1,下列说法正确的是| A.用A表示的反应速率是0.4mol•L-1•min-1 |
| B.气体的密度不再变化,则证明反应已经达到平衡状态 |
| C.2min末的反应速率v(B)=0.3mol•L-1•min-1 |
| D.分别用B、C表示反应的速率,其关系是:3v(B)=2v(C) |
您最近一年使用:0次
2023-04-22更新
|
281次组卷
|
2卷引用:四川省巴中市恩阳区2022-2023学年高二上学期1月期末化学试题
名校
解题方法
5 . 下列关于醋酸性质的描述,不能证明它是弱电解质的是
| A.0.1mol·L-1的醋酸溶液中H+浓度约为10-3mol·L-1 |
| B.醋酸溶液中存在CH3COOH分子 |
| C.CH3COONa溶液pH大于7 |
| D.5mL0.1mol·L-1的醋酸溶液与5mL0.1mol·L-1的KOH溶液恰好完全中和 |
您最近一年使用:0次
2022-11-02更新
|
336次组卷
|
5卷引用:四川省巴中市恩阳区2022-2023学年高二上学期1月期末化学试题
四川省巴中市恩阳区2022-2023学年高二上学期1月期末化学试题福建省仙游一中、莆田二中、莆田四中2020-2021学年高二上学期期末联考化学试题(已下线)第三章 第一节 弱电解质的电离(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)广东省化州市第一中学2020-2021学年高二上学期10月月考化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)
名校
解题方法
6 . 下列有关实验操作、实验现象和所得结论均正确的是
| 实验操作 | 实验现象 | 结论 | |
| A | 在2mL5%的H2O2溶液中加入1mL饱和FeCl3溶液 | 产生大量气泡 | Fe3+能催化H2O2的分解 |
| B | 向某溶液中先滴入稀HNO3溶液酸化,再滴入Ba(NO3)2溶液 | 出现白色沉淀 | 溶液中有 存在 存在 |
| C | 向Na2CO3溶液中滴入稀盐酸,再将气体通入Na2SiO3溶液中 | Na2SiO3溶液中有白色沉淀生成 | 酸性: 盐酸>H2CO3>H2SiO3 |
| D | 往某溶液中先滴NaOH溶液并加热 | 产生能使润湿的无色酚酞试纸变红的气体 | 证明原溶液中有 存在 存在 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-21更新
|
145次组卷
|
3卷引用:四川省巴中市第三中学2021-2022学年高二上学期期中考试化学试题
7 . NaNbO3是一种很好的压电和介电材料,一种以铌铁矿(主要成分为SiO2、Nb2O3、MnO2和少量的FeO、CaO、MgO)为原料的制取工艺流程如下:
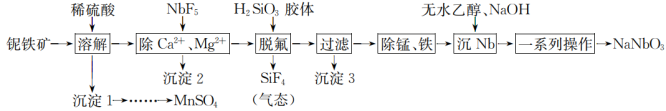
回答下列问题:
(1)为了加速“溶解”,可采取的措施有_______ (写出两种)该过程中MnO2与FeO反应生成MnSO4和Fe2(SO4)3的离子方程式为_______ 。
(2)“除Ca2+、Mg2+时,若溶液酸度过高,沉淀不完全,其原因是_______ ;当溶液中c(Ca2+)= 1×10-6mol·L-1时,溶液中c(Mg2+ )的最大值为_______ mol·L-1 (已知Ksp(CaF2)=2.5×10-11,Ksp(MgF2)= 6.4×10-9)
(3)“脱氟”过程发生反应的化学方程式为_______ 。
(4)“一系列操作”包括过滤、洗涤、干燥,其中证明NaNbO3洗涤干净的操作是_______ 。
(5)电解MnSO4溶液可制备Mn和MnO2,阳极电极反应式为_______ 。

回答下列问题:
(1)为了加速“溶解”,可采取的措施有
(2)“除Ca2+、Mg2+时,若溶液酸度过高,沉淀不完全,其原因是
(3)“脱氟”过程发生反应的化学方程式为
(4)“一系列操作”包括过滤、洗涤、干燥,其中证明NaNbO3洗涤干净的操作是
(5)电解MnSO4溶液可制备Mn和MnO2,阳极电极反应式为
您最近一年使用:0次
解题方法
8 . 硫酸是重要的实验试剂。根据相关实验填空:
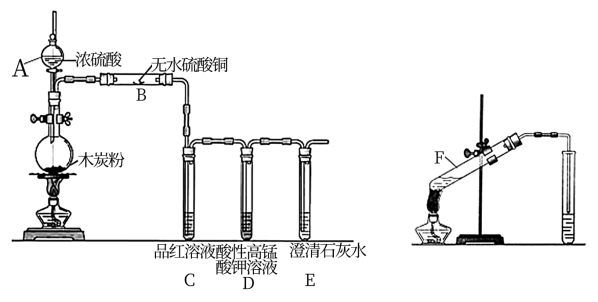
(1)仪器 的名称是
的名称是_______ ;装置 中的现象为
中的现象为_______ ,证明产物中含有_______ (填分子式);装置 作用为
作用为_______ ;圆底烧瓶中发生反应的化学方程式为_______ 。
(2)利用乙醇、浓硫酸和乙酸制取乙酸乙酯。向试管 中首先加入的试剂是
中首先加入的试剂是_______ ,实验中浓硫酸的作用为_______ 。
(3)淀粉在稀硫酸催化下,水解为葡萄糖,化学反应方程式为_______ 。

(1)仪器
 的名称是
的名称是 中的现象为
中的现象为 作用为
作用为(2)利用乙醇、浓硫酸和乙酸制取乙酸乙酯。向试管
 中首先加入的试剂是
中首先加入的试剂是(3)淀粉在稀硫酸催化下,水解为葡萄糖,化学反应方程式为
您最近一年使用:0次
名校
解题方法
9 . X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)元素X的原子中能量最高的是_______ 能级,其电子云在空间有_______ 个伸展方向,它的氢化物的电子式是_______ 。
(2)元素Y位于元素周期表的第三周期_______ 族。该原子的价电子排布式为_______ 。
(3)元素Z的原子最外层共有_______ 种不同运动状态的电子。
(4)W的基态原子核外电子排布式是_______ 。
(5)元素Y与元素Z相比,非金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ 。
a.Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c. 的电负性大于Y
的电负性大于Y
d. 的氢化物比Y的氢化物稳定
的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f. 元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且最高能级是半充满状态 |
| Y | 第三周期元素,它的单质是良好的半导体材料 |
| Z | Z和Y同周期,Z是本周期原子半径最小的主族元素 |
| W | W的一种核素的质量数为63,中子数为34 |
(2)元素Y位于元素周期表的第三周期
(3)元素Z的原子最外层共有
(4)W的基态原子核外电子排布式是
(5)元素Y与元素Z相比,非金属性较强的是
a.Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.
 的电负性大于Y
的电负性大于Yd.
 的氢化物比Y的氢化物稳定
的氢化物比Y的氢化物稳定e.在反应中,Y原子得电子数比Z原子得电子数多
f.
 元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
您最近一年使用:0次
2021-04-15更新
|
522次组卷
|
8卷引用:四川省通江中学2021-2022学年高二下学期3月月考理综化学试题
四川省通江中学2021-2022学年高二下学期3月月考理综化学试题宁夏回族自治区银川市宁夏大学附属中学2020-2021学年高二上学期第一次月考化学试题(已下线)第01章 原子结构与元素性质(A卷基础强化篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)(已下线)第一单元 原子结构(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)福建省泉州科技中学2020-2021学年高二下学期第一次月考化学试题福建省福州教育学院附属中学2021-2022学年高二下学期3月月考化学试题第二节 原子结构与元素的性质 第2课时 元素周期律——原子半径、电离能、电负性的递变规律辽宁省沈阳市辽中区第一私立高级中学2023-2024学年高二上学期12月月考化学试题
名校
10 . 某兴趣小组采用以下装置进行铁粉和水蒸气的实验,并对反应后的产物进行探究.
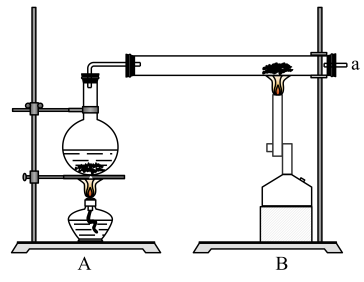
(1)铁粉与水蒸气反应的化学方程式为______ ;烧瓶中加入沸石的目的是_______
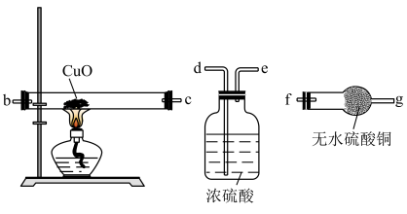
(2)用下图装置检验生成气体,连接顺序为(用字母表示)a
_______ 。
(3)证明反应后的固体中存在二价铁(限选试剂:1mol/LH2SO4、2mol/LHNO3、3%H2O2、0.01mol/LKMnO4、NaOH稀溶液、20%KSCN溶液、Fe2(SO4)3溶液)
步骤一:取反应后固体浸入Fe2(SO4)3溶液,充分反应后过滤并洗涤固体,其目的是_______ ;
步骤二:取过滤后所得固体加入过量_______ ,过滤;
步骤三:___________ 。
(4)取B中反应后的固体加足量稀硫酸溶解,再先后滴加KSCN溶液和氯水,溶液红色加深。请从平衡角度解释红色变深的原因_________ 。

(1)铁粉与水蒸气反应的化学方程式为
(2)用下图装置检验生成气体,连接顺序为(用字母表示)a


(3)证明反应后的固体中存在二价铁(限选试剂:1mol/LH2SO4、2mol/LHNO3、3%H2O2、0.01mol/LKMnO4、NaOH稀溶液、20%KSCN溶液、Fe2(SO4)3溶液)
步骤一:取反应后固体浸入Fe2(SO4)3溶液,充分反应后过滤并洗涤固体,其目的是
步骤二:取过滤后所得固体加入过量
步骤三:
(4)取B中反应后的固体加足量稀硫酸溶解,再先后滴加KSCN溶液和氯水,溶液红色加深。请从平衡角度解释红色变深的原因
您最近一年使用:0次
2018-01-29更新
|
220次组卷
|
2卷引用:四川省巴中市巴中中学、南江中学2021-2022学年高二上学期半期联考化学试题



