名校
解题方法
1 . 已知 的浓硫酸与亚硫酸钠反应可以制备
的浓硫酸与亚硫酸钠反应可以制备 。实验室可用如下装置(略去部分夹持仪器)制取
。实验室可用如下装置(略去部分夹持仪器)制取 并验证其性质。
并验证其性质。
 溶液的仪器名称为
溶液的仪器名称为___________ 。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若___________ ,则整个装置气密性良好。
(2)装置B的作用之一是通过观察产生气泡的多少判断 生成的快慢,其中的液体最好选择___________(填字母)。
生成的快慢,其中的液体最好选择___________(填字母)。
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为___________ 。
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验
方案Ⅰ 向第一份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案Ⅱ 向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ 向第三份溶液中加入 溶液,产生白色沉淀。
溶液,产生白色沉淀。
上述方案合理的是方案___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”);试管D中发生反应的离子方程式___________ 。
(5)装置E的作用是___________ 。装置F中为___________ 溶液。
 的浓硫酸与亚硫酸钠反应可以制备
的浓硫酸与亚硫酸钠反应可以制备 。实验室可用如下装置(略去部分夹持仪器)制取
。实验室可用如下装置(略去部分夹持仪器)制取 并验证其性质。
并验证其性质。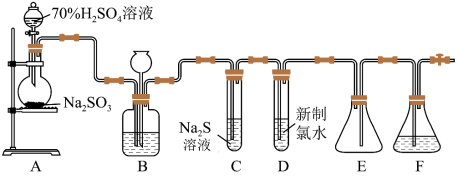

 溶液的仪器名称为
溶液的仪器名称为(2)装置B的作用之一是通过观察产生气泡的多少判断
 生成的快慢,其中的液体最好选择___________(填字母)。
生成的快慢,其中的液体最好选择___________(填字母)。| A.蒸馏水 | B.饱和 溶液 溶液 | C.饱和 溶液 溶液 | D.饱和NaOH溶液 |
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验
方案Ⅰ 向第一份溶液中加入
 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;方案Ⅱ 向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ 向第三份溶液中加入
 溶液,产生白色沉淀。
溶液,产生白色沉淀。上述方案合理的是方案
(5)装置E的作用是
您最近一年使用:0次
名校
2 . 下列实验目的、方案设计和现象、结论都正确的是
| 选项 | 实验目的 | 方案设计和现象 | 结论 |
| A | 探究钠在空气中久置后所得固体成分 | 取少量固体,加入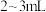 蒸馏水,有气体产生 蒸馏水,有气体产生 | 固体中一定含 |
| B | 比较 、 、 和 和 的氧化性 的氧化性 | 向酸性 溶液中滴入 溶液中滴入 溶液,紫红色溶液变浅并伴有黄绿色气体产生 溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性: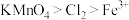 |
| C | 检验某溶液中是否含有 | 取少量待检液于试管中,滴加新制氯水后滴加 溶液,溶液变为红色 溶液,溶液变为红色 | 该溶液含有 |
| D | 验证某固体是 还是 还是 | 室温下取少量固体于试管中,插入温度计,加几滴水,温度升高 | 该固体是 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 为了研究外界条件对H2O2分解速率的影响,有同学利用实验室提供的仪器和试剂设计如下实验。注意:设计实验时,必须控制只有一个变量!
试剂:4%H2O2溶液,12%H2O2溶液,1mol/LFeCl3溶液
仪器:试管、带刻度的胶头滴管、酒精灯
(1)实验1:实验目的:温度对化学反应速率的影响
实验步骤:分别向甲、乙两支试管中加入5ml4%H2O2溶液,再分别加入3滴1molLFeCl3溶液,待两支试管中均有适量气泡出现时,将试管甲放入5℃水浴中,将试管乙放入40℃水浴中。
实验现象:试管___ (填甲或乙)中产生气泡的速率快,说明___ 。
(2)实验2:实验目的:浓度对化学反应速率的影响
实验步骤:向试管甲中加入5ml4%H2O2溶液,向试管乙中加入5ml12%H2O2溶液,
实验现象:试管甲、乙中均有少量气体缓慢产生
该实验现象不明显,你如何改进实验方案,使实验现象支持“浓度改变会影响化学反应速率”
这一理论预测:___ 。
(3)实验3:实验目的:__
实验步骤:在试管甲中加入5ml4%H2O2溶液,在试管乙中加入5mL4%H2O2溶液再加入1mL1mol/LFeCl3溶液.
你认为方案3的设计是否严谨?__ (填是或否),说明理由__ 。
(4)实验4:催化效果:Cu2+<Fe3+
实验步骤:在试管甲中加入5mL4%H2O2溶液和1mL、1mol/LCuSO4溶液,在试管乙中加入5mL4%H2O2溶液和1mL1mol/LFeCl3溶液,发现加入的试管中产生气泡速更快
你认为实验4的设计是否严谨?___ (填是或否),说明理由___ 。
试剂:4%H2O2溶液,12%H2O2溶液,1mol/LFeCl3溶液
仪器:试管、带刻度的胶头滴管、酒精灯
(1)实验1:实验目的:温度对化学反应速率的影响
实验步骤:分别向甲、乙两支试管中加入5ml4%H2O2溶液,再分别加入3滴1molLFeCl3溶液,待两支试管中均有适量气泡出现时,将试管甲放入5℃水浴中,将试管乙放入40℃水浴中。
实验现象:试管
(2)实验2:实验目的:浓度对化学反应速率的影响
实验步骤:向试管甲中加入5ml4%H2O2溶液,向试管乙中加入5ml12%H2O2溶液,
实验现象:试管甲、乙中均有少量气体缓慢产生
该实验现象不明显,你如何改进实验方案,使实验现象支持“浓度改变会影响化学反应速率”
这一理论预测:
(3)实验3:实验目的:
实验步骤:在试管甲中加入5ml4%H2O2溶液,在试管乙中加入5mL4%H2O2溶液再加入1mL1mol/LFeCl3溶液.
你认为方案3的设计是否严谨?
(4)实验4:催化效果:Cu2+<Fe3+
实验步骤:在试管甲中加入5mL4%H2O2溶液和1mL、1mol/LCuSO4溶液,在试管乙中加入5mL4%H2O2溶液和1mL1mol/LFeCl3溶液,发现加入的试管中产生气泡速更快
你认为实验4的设计是否严谨?
您最近一年使用:0次
2019高二下·全国·专题练习
名校
4 . 实验室制取乙酸乙酯:CH3COOH + C2H5OH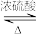 CH3COOC2H5 +H2O。下列操作或装置能达到实验目的的是
CH3COOC2H5 +H2O。下列操作或装置能达到实验目的的是
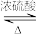 CH3COOC2H5 +H2O。下列操作或装置能达到实验目的的是
CH3COOC2H5 +H2O。下列操作或装置能达到实验目的的是| A | B | C | D |
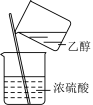 | 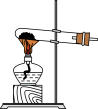 | 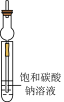 |  |
| 混合反应物 | 生成乙酸乙酯 | 收集乙酸乙酯 | 分离乙酸乙酯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-04-20更新
|
539次组卷
|
8卷引用:四川省巴中市2020-2021学年高一下学期期末学情检测化学试题
四川省巴中市2020-2021学年高一下学期期末学情检测化学试题(已下线)2019年4月21日 《每日一题》选修5——每周一测(已下线)2019年10月28日 《每日一题》2020年高考一轮复习-酯化反应湖南省常德市第一中学2020-2021学年高二上学期期中考试化学试题山西省长治市第二中学校2021-2022学年高一下学期期末考试化学试题甘肃省永昌县第一高级中学2021-2022学年高二下学期期末考试化学试题四川省成都市实验外国语学校(西区)2021-2022学年高一下学期第二次月考化学试题河南省沁阳市第一中学2023届高一下学期5月月考化学试题
5 . 为了探究 、
、 同时通入
同时通入 中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。 、
、 气体,现采用
气体,现采用 固体与
固体与 的硫酸为原料制取
的硫酸为原料制取 ,采用
,采用 和浓盐酸(
和浓盐酸(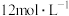 )为原料制取
)为原料制取 。在此实验中,F仪器的作用是
。在此实验中,F仪器的作用是___________ ;发生装置B应选择以下三种装置中的___________ (填①或②或③)。___________ ,写出气体发生装置B中主要反应的离子方程式___________ 。
(3)将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。上述现象体现了浓硫酸的___________ (填序号)①酸性②吸水性③脱水性④强氧化性,请写出“体积膨胀,并放出有刺激性气味的气体”对应的化学方程式:___________ 。
(4)为验证通入D装置中的气体是 过量还是
过量还是 过量,兴趣小组的同学准备了以下试剂:a.氯化铁溶液b.氯化亚铁溶液c.硫氰化钾溶液d.氯化钡溶液e.品红溶液f.酸性高锰酸钾溶液;
过量,兴趣小组的同学准备了以下试剂:a.氯化铁溶液b.氯化亚铁溶液c.硫氰化钾溶液d.氯化钡溶液e.品红溶液f.酸性高锰酸钾溶液;
若 过量,取适量D中溶液滴加至盛有
过量,取适量D中溶液滴加至盛有___________ (选填一个序号)试剂的试管内,再加入___________ (选填一个序号)试剂,发生的现象是___________ 。
 、
、 同时通入
同时通入 中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。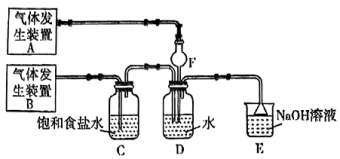
 、
、 气体,现采用
气体,现采用 固体与
固体与 的硫酸为原料制取
的硫酸为原料制取 ,采用
,采用 和浓盐酸(
和浓盐酸(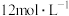 )为原料制取
)为原料制取 。在此实验中,F仪器的作用是
。在此实验中,F仪器的作用是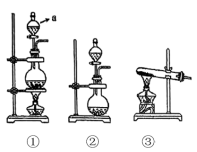
(3)将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。上述现象体现了浓硫酸的
(4)为验证通入D装置中的气体是
 过量还是
过量还是 过量,兴趣小组的同学准备了以下试剂:a.氯化铁溶液b.氯化亚铁溶液c.硫氰化钾溶液d.氯化钡溶液e.品红溶液f.酸性高锰酸钾溶液;
过量,兴趣小组的同学准备了以下试剂:a.氯化铁溶液b.氯化亚铁溶液c.硫氰化钾溶液d.氯化钡溶液e.品红溶液f.酸性高锰酸钾溶液;若
 过量,取适量D中溶液滴加至盛有
过量,取适量D中溶液滴加至盛有
您最近一年使用:0次
名校
6 . 化学教材上提出:当火灾现场存放有大量活泼金属时,不能用水而需要用干燥的沙土来灭火。王老师上课讲到, 能在
能在 中剧烈燃烧。某化学小组对
中剧烈燃烧。某化学小组对 在
在 气体中燃烧的产物进行了实验探究。
气体中燃烧的产物进行了实验探究。
【提出猜想】 与
与 反应可能生成4种物质:
反应可能生成4种物质: 、
、 、
、 和
和
【查阅资料】①向 溶液中通入
溶液中通入 ,能产生黑色沉淀
,能产生黑色沉淀 ;
;
②将酚酞溶液分别滴入 、
、 、
、 、
、 四种溶液中的现象如下:
四种溶液中的现象如下:
【设计实验、验证猜想】某化学小组设计了如图所示装置(部分夹持仪器已略去);
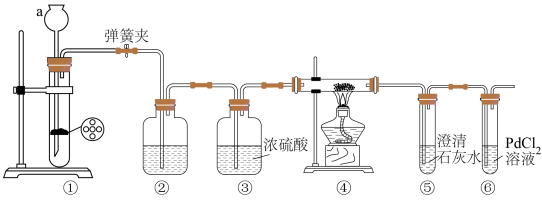
实验步骤及实验记录:
(1)检查装置气密性。装置①气密性检查的方法是___________ ,则装置气密性良好。
(2)装入药品。②中应装入___________ 。
(3)打开弹簧夹,由长颈漏斗注入稀盐酸,①中产生大量气泡,①中反应的离子方程式是___________ 。
(4)当⑤中出现浑浊时,点燃酒精灯。④中 剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有
剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有___________ 。⑥中产生黑色沉淀的化学方程式是___________ 。
(5)关闭弹簧夹,待玻璃管冷却后,拆卸装置。取④中白色固体于试管中,加水完全溶解,再加入过量 溶液,产生白色沉淀,则产物中还有
溶液,产生白色沉淀,则产物中还有___________ 。过滤,向滤液中滴加几滴酚酞溶液,溶液未变红,则产物中不含 。加入过量
。加入过量 溶液的目的是
溶液的目的是___________ 。
【实验讨论】能在 气体中剧烈燃烧。
气体中剧烈燃烧。
(6)若 在
在 气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出
气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出 在
在 气体中燃烧的化学反应方程式
气体中燃烧的化学反应方程式___________ 。
 能在
能在 中剧烈燃烧。某化学小组对
中剧烈燃烧。某化学小组对 在
在 气体中燃烧的产物进行了实验探究。
气体中燃烧的产物进行了实验探究。【提出猜想】
 与
与 反应可能生成4种物质:
反应可能生成4种物质: 、
、 、
、 和
和
【查阅资料】①向
 溶液中通入
溶液中通入 ,能产生黑色沉淀
,能产生黑色沉淀 ;
;②将酚酞溶液分别滴入
 、
、 、
、 、
、 四种溶液中的现象如下:
四种溶液中的现象如下:| 溶液 |  |  |  |  |
| 现象 | 无变化 | 无变化 | 溶液变为红色 | 溶液变为红色 |

实验步骤及实验记录:
(1)检查装置气密性。装置①气密性检查的方法是
(2)装入药品。②中应装入
(3)打开弹簧夹,由长颈漏斗注入稀盐酸,①中产生大量气泡,①中反应的离子方程式是
(4)当⑤中出现浑浊时,点燃酒精灯。④中
 剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有
剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有(5)关闭弹簧夹,待玻璃管冷却后,拆卸装置。取④中白色固体于试管中,加水完全溶解,再加入过量
 溶液,产生白色沉淀,则产物中还有
溶液,产生白色沉淀,则产物中还有 。加入过量
。加入过量 溶液的目的是
溶液的目的是【实验讨论】能在
 气体中剧烈燃烧。
气体中剧烈燃烧。(6)若
 在
在 气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出
气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出 在
在 气体中燃烧的化学反应方程式
气体中燃烧的化学反应方程式
您最近一年使用:0次
名校
7 . 硫代硫酸钠(Na2S2O3)在工业、医药等领域应用广泛。下图为实验室制取硫代硫酸钠的装置,反应过程中需通过pH传感器控制pH为7-8。
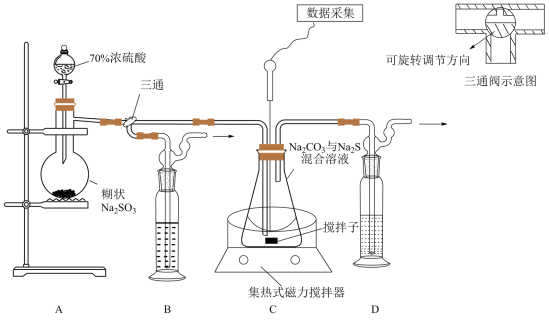
(1)盛Na2SO3的仪器名称为___________ 。
(2)为了确保硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是___________ 。
(3)若n(Na2CO3):n(Na2S)=1:2,则装置C中的化学反应方程式为:___________ 。
(4)当数据采集处pH接近7时,应采取的操作为___________ 。
(5)装置B中的药品可以选择下列物质中的___________(填字母)。
(6)现使用“碘量法”测定脱碳液中V2O5的含量:取mg脱碳液于锥形瓶中,向锥形瓶中加入适量盐酸和足量KI溶液,发生反应为V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O,此时溶液颜色为棕色,使用0.1000mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液VmL,该过程的反应为I2+2Na2S2O3=2NaI+Na2S4O6。(已知有色离子仅有VO2+,其颜色为蓝色)
①滴定终点的现象为:___________ 。
②若滴定时,滴定管未用标准液润洗,则测得V2O5的含量___________ (填“偏大”、“偏小”、“无影响”)。
③脱碳液中V2O5的质量分数为___________ %。

(1)盛Na2SO3的仪器名称为
(2)为了确保硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是
(3)若n(Na2CO3):n(Na2S)=1:2,则装置C中的化学反应方程式为:
(4)当数据采集处pH接近7时,应采取的操作为
(5)装置B中的药品可以选择下列物质中的___________(填字母)。
| A.饱和NaHCO3溶液 | B.饱和NaHSO3溶液 |
| C.NaOH溶液 | D.酸性KMnO4溶液 |
(6)现使用“碘量法”测定脱碳液中V2O5的含量:取mg脱碳液于锥形瓶中,向锥形瓶中加入适量盐酸和足量KI溶液,发生反应为V2O5+6HCl+2KI=2VOCl2+2KCl+I2+3H2O,此时溶液颜色为棕色,使用0.1000mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液VmL,该过程的反应为I2+2Na2S2O3=2NaI+Na2S4O6。(已知有色离子仅有VO2+,其颜色为蓝色)
①滴定终点的现象为:
②若滴定时,滴定管未用标准液润洗,则测得V2O5的含量
③脱碳液中V2O5的质量分数为
您最近一年使用:0次
2023-03-21更新
|
868次组卷
|
4卷引用:四川省巴中市2023届高三一诊考试理综化学试题
8 . 某研究性学习小组在学习SO2 的性质时,通过查阅文献、理性分析、实验验证与CO2 的性质进行了比较。试根据研究主题和过程,回答下列问题。
(1)水溶液的酸性
①常温常压下,纯水的 pH=7,而酸雨的 pH<5.6.形成酸雨的主要物质是 SO2 和氮的氧化物。把 pH<5.6 的雨水称为酸雨,而不是 pH<7,可能的原因是___________ 。
②查阅文献知: 常温下,H2SO3 的电离常数Ka1 =1.2×10-2 ,Ka2 =6.3×10-3 ,H2CO3的电离常数 Ka1 =4.4×10-7 ,Ka2 =4.7×10-11 。选用下面的药品和装置验证 H2SO3 和H2CO3 的酸性强弱,其连接顺序:A→___________ (按气流方向用大写字母表示即可)。D装置的主要作用是___________ 。
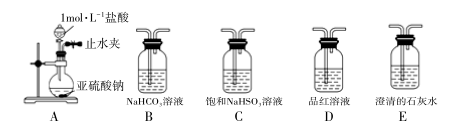
③根据②中的数据可知,配置相同物质的量浓度的NaHSO3 和NaHCO3 溶液,其pH值大小关系为pH(NaHSO3)___________ pH(NaHCO3 )(填“>”、“<”或“=”)。
(2)二氧化硫的还原性
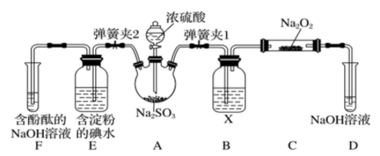
若按图示装置进行实验(部分固定装置未画出)。请你在实验前根据预设的操作,推测可能的实验现象及其对应的原因。
(1)水溶液的酸性
①常温常压下,纯水的 pH=7,而酸雨的 pH<5.6.形成酸雨的主要物质是 SO2 和氮的氧化物。把 pH<5.6 的雨水称为酸雨,而不是 pH<7,可能的原因是
②查阅文献知: 常温下,H2SO3 的电离常数Ka1 =1.2×10-2 ,Ka2 =6.3×10-3 ,H2CO3的电离常数 Ka1 =4.4×10-7 ,Ka2 =4.7×10-11 。选用下面的药品和装置验证 H2SO3 和H2CO3 的酸性强弱,其连接顺序:A→

③根据②中的数据可知,配置相同物质的量浓度的NaHSO3 和NaHCO3 溶液,其pH值大小关系为pH(NaHSO3)
(2)二氧化硫的还原性
若按图示装置进行实验(部分固定装置未画出)。请你在实验前根据预设的操作,推测可能的实验现象及其对应的原因。

| 预设的操作步骤 | 预期的实验现象 | 推测可能的原因 |
| 关闭弹簧夹2,打开弹簧夹1,将硫酸注入三颈烧瓶至浸没固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为① |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应:2SO2+2Na2O2=2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E、F中 | E中② | E中反应的离子方程式③ |
| F中④ | F中反应为2OH- + SO2=SO + H2O + H2O |
您最近一年使用:0次
解题方法
9 . 某同学在实验室探究硝酸的制备和性质,设计了如图所示装置。
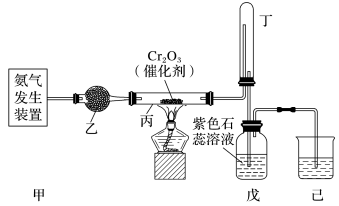
(1)某同学想用下列装置及试剂方便快速地制取少量氨气。
化学试剂:①NH4Cl固体、②浓氨水、③CaO固体。
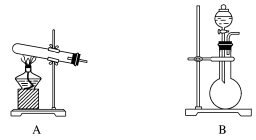
应选择的装置是______ (填字母),选用的试剂是______ (填序号)。
简述快速制取氨气的原理___________ 。
实验过程中,制气时的实验操作是_________ 。
(2)乙装置的作用是______ ;写出受热时丙装置中发生反应的化学方程式:____ 。
(3)当戊中观察到_______ 现象,则说明已制得硝酸。某同学按上图组装仪器并检验装置气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因是:____ ,如何改进装置:___________ 。
(4)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是_____ 。

(1)某同学想用下列装置及试剂方便快速地制取少量氨气。
化学试剂:①NH4Cl固体、②浓氨水、③CaO固体。

应选择的装置是
简述快速制取氨气的原理
实验过程中,制气时的实验操作是
(2)乙装置的作用是
(3)当戊中观察到
(4)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是
您最近一年使用:0次
解题方法
10 . 硫酸是重要的实验试剂。根据相关实验填空:
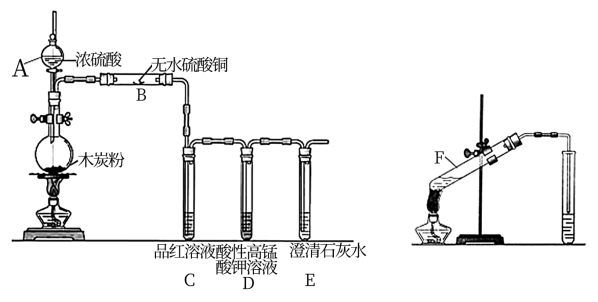
(1)仪器 的名称是
的名称是_______ ;装置 中的现象为
中的现象为_______ ,证明产物中含有_______ (填分子式);装置 作用为
作用为_______ ;圆底烧瓶中发生反应的化学方程式为_______ 。
(2)利用乙醇、浓硫酸和乙酸制取乙酸乙酯。向试管 中首先加入的试剂是
中首先加入的试剂是_______ ,实验中浓硫酸的作用为_______ 。
(3)淀粉在稀硫酸催化下,水解为葡萄糖,化学反应方程式为_______ 。

(1)仪器
 的名称是
的名称是 中的现象为
中的现象为 作用为
作用为(2)利用乙醇、浓硫酸和乙酸制取乙酸乙酯。向试管
 中首先加入的试剂是
中首先加入的试剂是(3)淀粉在稀硫酸催化下,水解为葡萄糖,化学反应方程式为
您最近一年使用:0次



