名校
1 . 关于下列有机物的说法错误的是
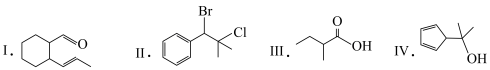
| A.Ⅰ能使溴水和酸性高锰酸钾溶液褪色 | B.Ⅱ的一氟代物只有3种 |
| C.Ⅲ能发生酯化反应 | D.Ⅳ的分子式为C8H12O |
您最近一年使用:0次
2024-04-23更新
|
406次组卷
|
3卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
解题方法
2 . 某研究小组制备配合物顺式一二甘氨酸合铜[(H2NCH2COO)2Cu]并测定所得产品中铜的含量。回答下列问题:
Ⅰ.制备Cu(OH)2
如图所示,向装有CuSO4溶液的三颈烧瓶中滴加氨水,先出现蓝色沉淀,后蓝色沉淀消失,溶液变为深蓝色。再加入过量的NaOH溶液,过滤,洗涤,干燥。_____ 价。
(2)写出少量的氨水和硫酸铜溶液反应的离子方程式:__________________ 。
Ⅱ.制备顺式一二甘氨酸合铜[(H2NCH2COO)2Cu]
将制得的Cu(OH)2固体置于烧杯中,加入甘氨酸,水浴加热至65~70℃,搅拌,充分反应后趁热过滤,往滤液中加入10mL95%的乙醇溶液,冷却结晶,过滤、洗涤、干燥,得产品。
(3)写出Cu(OH)2与甘氨酸反应的化学方程式:___________ 。
(4)下列说法中正确的是________ (填标号)。
a.实验Ⅰ中不用CuSO4溶液直接与NaOH反应的原因可能是防止生成碱式硫酸铜沉淀
b.实验Ⅱ中,趁热过滤的目的是除去Cu(OH)2的同时减少产物的析出
c.加入95%的乙醇溶液能增大顺式一二甘氨酸合铜的溶解度
Ⅲ.产品中Cu元素含量的测定
实验流程如下:
A.用分析天平称量产品xg,配制成100mL样品溶液;
B.用移液管移取20.00mL溶液到碘量瓶中,加入过量KI固体,在暗处静置5分钟,用标准Na2S2O3溶液滴定至溶液呈浅黄色,加入适量NH4SCN溶液,剧烈振荡碘量瓶,加入淀粉溶液,用标准Na2S2O3溶液滴定至终点;再取20.00mL溶液进行一次平行实验。
已知:ⅰ.2Cu2++4I-=2CuI↓+I2,2 +I2=2I-+
+I2=2I-+ ;
;
ⅱ.CuI固体能吸附溶液中的少量碘单质;
ⅲ.Ksp(CuSCN)<Ksp(CuI)。
(5)①配制100mL样品溶液时,需要的玻璃仪器有烧杯、玻璃棒、________ 。
②滴定终点的现象是________ 。
③若两次平行实验,平均消耗0.1050mol·L-1 Na2S2O3溶液20.00mL,则xg产品中含Cu的质量为______ g。
Ⅰ.制备Cu(OH)2
如图所示,向装有CuSO4溶液的三颈烧瓶中滴加氨水,先出现蓝色沉淀,后蓝色沉淀消失,溶液变为深蓝色。再加入过量的NaOH溶液,过滤,洗涤,干燥。

(2)写出少量的氨水和硫酸铜溶液反应的离子方程式:
Ⅱ.制备顺式一二甘氨酸合铜[(H2NCH2COO)2Cu]
将制得的Cu(OH)2固体置于烧杯中,加入甘氨酸,水浴加热至65~70℃,搅拌,充分反应后趁热过滤,往滤液中加入10mL95%的乙醇溶液,冷却结晶,过滤、洗涤、干燥,得产品。
(3)写出Cu(OH)2与甘氨酸反应的化学方程式:
(4)下列说法中正确的是
a.实验Ⅰ中不用CuSO4溶液直接与NaOH反应的原因可能是防止生成碱式硫酸铜沉淀
b.实验Ⅱ中,趁热过滤的目的是除去Cu(OH)2的同时减少产物的析出
c.加入95%的乙醇溶液能增大顺式一二甘氨酸合铜的溶解度
Ⅲ.产品中Cu元素含量的测定
实验流程如下:
A.用分析天平称量产品xg,配制成100mL样品溶液;
B.用移液管移取20.00mL溶液到碘量瓶中,加入过量KI固体,在暗处静置5分钟,用标准Na2S2O3溶液滴定至溶液呈浅黄色,加入适量NH4SCN溶液,剧烈振荡碘量瓶,加入淀粉溶液,用标准Na2S2O3溶液滴定至终点;再取20.00mL溶液进行一次平行实验。
已知:ⅰ.2Cu2++4I-=2CuI↓+I2,2
 +I2=2I-+
+I2=2I-+ ;
;ⅱ.CuI固体能吸附溶液中的少量碘单质;
ⅲ.Ksp(CuSCN)<Ksp(CuI)。
(5)①配制100mL样品溶液时,需要的玻璃仪器有烧杯、玻璃棒、
②滴定终点的现象是
③若两次平行实验,平均消耗0.1050mol·L-1 Na2S2O3溶液20.00mL,则xg产品中含Cu的质量为
您最近一年使用:0次
2024-04-21更新
|
149次组卷
|
2卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
解题方法
3 . 氮及其化合物在生产、环保研究等方面用途非常广泛,回答下列问题:
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0kJ/mol
4NO(g)+2H2O(g)+3O2(g)=4HNO3(g) △H=_______ kJ/mol。
(2)FeSO4(aq)+NO(g)=Fe(NO)SO4(aq)(棕黄色),下列叙述正确的是_______。(填标号)
(3)向一恒容密闭容器中充入适量NH3和O2,在一定条件下发生反应,氧化产物是N2、NO、NO2、N2O中的一种,达到平衡时改变温度,各物质的浓度与温度关系如图所示。________ (填化学式),写出该反应的化学方程式:_____________ 。
②正反应△H______ (填“>”“<”或“=”)0,判断依据是__________ 。
③T3K时NH3的平衡转化率为__________ 。
(1)硝酸厂尾气可以回收制备硝酸。已知:
①2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ/mol
②3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0kJ/mol
4NO(g)+2H2O(g)+3O2(g)=4HNO3(g) △H=
(2)FeSO4(aq)+NO(g)=Fe(NO)SO4(aq)(棕黄色),下列叙述正确的是_______。(填标号)
| A.溶液颜色不变,反应达到平衡状态 |
| B.其他条件不变,充入少量O2,平衡不移动 |
| C.其他条件不变,加少量FeSO4,溶液颜色加深 |
| D.其他条件不变,微热,溶液颜色加深 |
(3)向一恒容密闭容器中充入适量NH3和O2,在一定条件下发生反应,氧化产物是N2、NO、NO2、N2O中的一种,达到平衡时改变温度,各物质的浓度与温度关系如图所示。
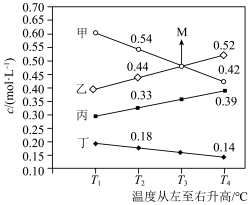
②正反应△H
③T3K时NH3的平衡转化率为
您最近一年使用:0次
2024-04-21更新
|
107次组卷
|
2卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
4 . 以废铁屑﹑低品位软锰矿[主要成分有MnO2、Al2O3、Fe2O3、Cu(OH)2CO3、CaCO3、SiO2等]为原料,制备硫酸锰,进一步电解制备金属锰,工艺流程如图所示:
Ⅱ.几种化合物的溶解性或溶度积(Ksp)如表:
(1)“浸出”时,Fe2O3与废铁屑、稀H2SO4反应的离子方程式为_________ 。
(2)为去除废铁屑表面的油污可采用的方法为__________ ;“浸出”后浸出液中的+2价金属阳离子有Cu2+、Fe2+、________ 。
(3)锰的浸出率结果如图所示。由图可知,影响锰浸出率的因素有____________ 。_________________ 。
(5)“除铜”过程中,当铜离子恰好完全沉淀(当离子浓度小于或等于10-5mol·L-1时视为完全沉淀)时,溶液中c(S2-)=_____________ mol·L-1。
(6)用惰性电极电解中性MnSO4溶液可以制得金属Mn。装置如图所示。________ (填“增加”或“减少”)_______ mol。
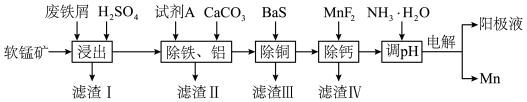
| 金属阳离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Cu2+ |
| 开始沉淀的pH | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
| 沉淀完全的pH | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
| 化合物 | MnF2 | CaS | MnS | FeS | CuS |
| 溶解性或溶度积(Ksp) | 溶于水 | 溶于水 | 2.5×10-13 | 6.3×10-18 | 6.3×10-36 |
(2)为去除废铁屑表面的油污可采用的方法为
(3)锰的浸出率结果如图所示。由图可知,影响锰浸出率的因素有
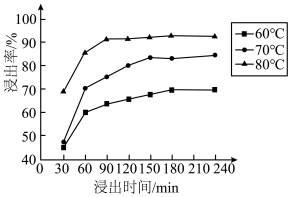
(5)“除铜”过程中,当铜离子恰好完全沉淀(当离子浓度小于或等于10-5mol·L-1时视为完全沉淀)时,溶液中c(S2-)=
(6)用惰性电极电解中性MnSO4溶液可以制得金属Mn。装置如图所示。
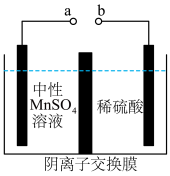
您最近一年使用:0次
2024-04-21更新
|
194次组卷
|
2卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
解题方法
5 . 某大学研究团队推出一种新型Zn-NO2电池。该电池能有效地捕获NO2,将其转化为 ,再将产生的
,再将产生的 电解制氨,过程如图所示。下列说法正确的是
电解制氨,过程如图所示。下列说法正确的是
 ,再将产生的
,再将产生的 电解制氨,过程如图所示。下列说法正确的是
电解制氨,过程如图所示。下列说法正确的是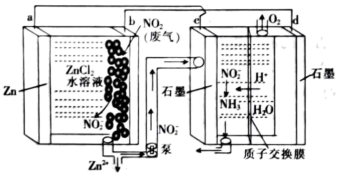
| A.d电极的电势比c电极的电势高 |
| B.Zn极为原电池正极 |
C.c极的电极反应为 -6e-+7H+=NH3+2H2O -6e-+7H+=NH3+2H2O |
| D.电路中转移0.2mole-时,理论上能得到1.12LO2 |
您最近一年使用:0次
2024-04-21更新
|
181次组卷
|
2卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
6 . 屈恶昔康(F)可治疗骨关节炎,其合成路线如图,回答下列问题:__________ ;B中官能团的名称为__________ 。
(2)A→B所用的试剂X为___________ (填名称),该反应的反应类型为__________ 。
(3)D的结构简式为__________ 。
(4)写出D→E的化学方程式:___________ 。
(5)已知化合物H是E的同分异构体,则符合下列条件的H的结构有__________ 种(不考虑立体异构);其中核磁共振氢谱有五组峰(氢原子数之比为4∶2∶2∶1∶1)的结构简式为__________ (填1种即可)。
①苯环上有三个取代基,其中两个为—CH2CN②能发生银镜反应
(6)写出以 和乙二酸为原料合成
和乙二酸为原料合成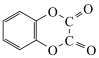 的路线
的路线________ (其他无机试剂任选)。
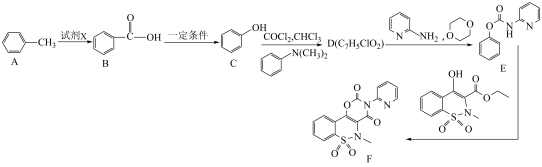
(2)A→B所用的试剂X为
(3)D的结构简式为
(4)写出D→E的化学方程式:
(5)已知化合物H是E的同分异构体,则符合下列条件的H的结构有
①苯环上有三个取代基,其中两个为—CH2CN②能发生银镜反应
(6)写出以
 和乙二酸为原料合成
和乙二酸为原料合成 的路线
的路线
您最近一年使用:0次
2024-03-27更新
|
258次组卷
|
4卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
2024届青海省海东市高三下学期二模理科综合试卷-高中化学贵州省黔东南州2024届高三下学期模拟统测(二模)化学试题青海省西宁市湟中区2024届高三下学期一模理综化学试题(已下线)化学(天津卷02)-2024年高考化学押题预测卷
7 . C、N化合物对人类生存环境有重要影响。
Ⅰ.汽车尾气中的NO和CO在催化剂作用下可生成无毒无害的气体,工业废气中的NO可被NH3在高温催化作用下还原为N2和H2O。
(1)原子序数为N元素两倍的元素的基态原子的外围电子排布图为_________ 。
(2)C、N、O三种元素的第一电离能由小到大的顺序为_________ 。
(3)键角:NH3__________ (填“>“<”或“=”)H2O;NH3的VSEPR模型为_________ 。
Ⅱ.NO与血红蛋白中的[Fe(H2O)6]2+结合生成[Fe(NO)(H2O)5]2+可导致人体的血红蛋白丧失携氧能力。
(4)Fe2+的配位数为_________ 。
(5)在[Fe(NO)(H2O)5]2+中,配体NO提供配位的原子为_________ (填元素符号),原因是_________ 。
Ⅲ.C元素与N元素形成的一种超硬晶体的晶胞结构如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),设晶胞参数为anm,NA为阿伏加德罗常数的值,1号原子的坐标为(0,0,0)、3号原子的坐标为(1,1,1)。_________ 。
②2号原子的坐标为_________ 。
③该晶体的密度为__________ g/cm3。
Ⅰ.汽车尾气中的NO和CO在催化剂作用下可生成无毒无害的气体,工业废气中的NO可被NH3在高温催化作用下还原为N2和H2O。
(1)原子序数为N元素两倍的元素的基态原子的外围电子排布图为
(2)C、N、O三种元素的第一电离能由小到大的顺序为
(3)键角:NH3
Ⅱ.NO与血红蛋白中的[Fe(H2O)6]2+结合生成[Fe(NO)(H2O)5]2+可导致人体的血红蛋白丧失携氧能力。
(4)Fe2+的配位数为
(5)在[Fe(NO)(H2O)5]2+中,配体NO提供配位的原子为
Ⅲ.C元素与N元素形成的一种超硬晶体的晶胞结构如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),设晶胞参数为anm,NA为阿伏加德罗常数的值,1号原子的坐标为(0,0,0)、3号原子的坐标为(1,1,1)。
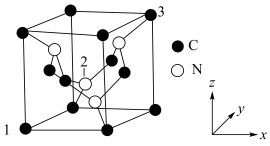
②2号原子的坐标为
③该晶体的密度为
您最近一年使用:0次
2024-03-27更新
|
339次组卷
|
4卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
2024届青海省海东市高三下学期二模理科综合试卷-高中化学2024届陕西省榆林市高三下学期第二次模拟检测理科综合试题-高中化学青海省西宁市湟中区2024届高三下学期一模理综化学试题(已下线)化学(北京卷01)-2024年高考押题预测卷
8 . 短周期主族元素X、Y、Z、W的原子序数依次增大,Z2W2Y5常作食品抗氧化剂、漂白剂。Y原子最外层电子数是电子层数的3倍。Y和W位于同主族,Z是短周期元素中金属性最强的元素。该四种元素的原子最外层电子数之和等于18。下列叙述正确的是
| A.简单离子半径:Z>X>Y | B.简单氢化物稳定性:X>Y>W |
| C.Z2W2Y5中含有离子键和共价键 | D.工业上电解熔融Z2Y制备Z单质 |
您最近一年使用:0次
2024-03-27更新
|
238次组卷
|
3卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
9 . 常温下,在MoS2催化下可实现CH4向CH3OH的直接转化。原理如图。下列说法正确的是
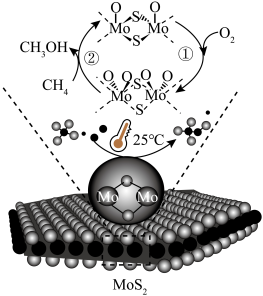
| A.反应过程中,Mo的化合价未发生变化 | B.生成甲醇的总反应为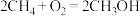 |
| C.MoS2降低了总反应的焓变 | D.反应过程中有非极性键的断裂和形成 |
您最近一年使用:0次
2024-03-19更新
|
548次组卷
|
4卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
2024届青海省海东市高三下学期二模理科综合试卷-高中化学辽宁省辽阳市2024届高三第一次模拟考试化学试卷青海省西宁市湟中区2024届高三下学期一模理综化学试题(已下线)化学(辽宁卷01)-2024年高考押题预测卷
名校
解题方法
10 . 化学与生活密切相关,下列不涉及化学变化的是
| A.植物油制作奶油 | B.太阳能电池发电 |
| C.土豆片遇碘变蓝 | D.鸡蛋加热后凝固 |
您最近一年使用:0次
2024-03-19更新
|
396次组卷
|
5卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
2024届青海省海东市高三下学期二模理科综合试卷-高中化学辽宁省辽阳市2024届高三第一次模拟考试化学试卷2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题青海省西宁市湟中区2024届高三下学期一模理综化学试题(已下线)山东省名校联盟2024届高三下学期5月模拟考试化学试题



