名校
解题方法
1 . I.甲醇是重要的化工原料,发展前景广阔。
温度为T1时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g) + H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) 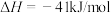 。相关数据如下:
。相关数据如下:
(1)甲容器中,反应在t1 min 内的平均速率v(H2)= ___________ mol/(L·min)。
(2)甲容器中,平衡时,反应放出的热量___________ kJ。
(3)T1时,反应的平衡常数K甲=___________ 。
(4)乙容器中,a=___________ mol。
II.实验探究
兴趣小组同学为探究影响化学反应速率及化学平衡的因素,设计以下实验:___________ 。
(6)利用实验II探究浓度对化学平衡的影响。
已知:Cr2O (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ 推测B试管中实验现象为
(黄色)+2H+ 推测B试管中实验现象为___________ ,用平衡移动原理解释原因:___________ 。
(7)该小组同学继续用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
已知: 。
。
①由实验i、实验ii可得出的结论是___________ 。
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组同学提出了猜想:反应中生成的Mn2+对反应有催化作用。利用下列提供的试剂设计实验iii,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸, MnSO4固体,蒸馏水。
补全实验iii的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,___________ ,最后加入5mL0.1mol/L草酸溶液。
温度为T1时,向容积为2L的密闭容器甲、乙中分别充入一定量的CO和H2O(g),发生反应:CO(g) + H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g) 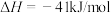 。相关数据如下:
。相关数据如下:| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| 达到平衡的时间(min) | t1 | t2 | ||
(2)甲容器中,平衡时,反应放出的热量
(3)T1时,反应的平衡常数K甲=
(4)乙容器中,a=
II.实验探究
兴趣小组同学为探究影响化学反应速率及化学平衡的因素,设计以下实验:

(6)利用实验II探究浓度对化学平衡的影响。
已知:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+ 推测B试管中实验现象为
(黄色)+2H+ 推测B试管中实验现象为(7)该小组同学继续用酸性KMnO4溶液和草酸(H2C2O4)溶液进行实验,实验操作及现象如下表:
| 编号 | 实验操作 | 实验现象 |
| i | 向一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入5mL0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅,30min后几乎变为无色 |
| ii | 向另一支试管中先加入5mL0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,最后加入5mL0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
 。
。①由实验i、实验ii可得出的结论是
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组同学提出了猜想:反应中生成的Mn2+对反应有催化作用。利用下列提供的试剂设计实验iii,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸, MnSO4固体,蒸馏水。
补全实验iii的操作:向试管中先加入5mL0.01mol/L酸性KMnO4溶液,
您最近一年使用:0次
2 . 配合物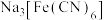 可用于离子检验,下列说法不正确的是
可用于离子检验,下列说法不正确的是
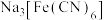 可用于离子检验,下列说法不正确的是
可用于离子检验,下列说法不正确的是| A.此配合物中存在离子键、配位键、极性键、非极性键 |
B.配体为 ,与N2、CO互为等电子体 ,与N2、CO互为等电子体 |
| C.1mol配合物中π键数目为12NA |
| D.该配合物为离子化合物,易电离,1mol该配合物电离得到阴、阳离子的数目共4NA |
您最近一年使用:0次
3 . 下列说法不正确的是
| A.干冰和冰都是由分子的密堆积形成的晶体 |
| B.某元素气态基态原子的逐级电离能(kJ·mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+ |
| C.臭氧是空间结构为V形的极性分子,在水中的溶解度大于氧气 |
| D.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数 |
您最近一年使用:0次
名校
解题方法
4 . “类推”是一种重要的学习方法,但有时会产生错误,下列类推得到的结论正确的是
| A.第二周期元素简单氢化物的稳定性顺序是HF>H2O>NH3;则第三周期元素简单氢化物的稳定性顺序也是HCl>H2S>PH3 |
| B.CO2是分子晶体;则SiO2也是分子晶体 |
| C.根据对角线规则,元素Li和Mg的某些性质相似,则元素C和P的某些性质也相似 |
D. 和P4都为正四面体形结构, 和P4都为正四面体形结构, 中键角为109°28′,P4中键角也为109°28′ 中键角为109°28′,P4中键角也为109°28′ |
您最近一年使用:0次
5 . 完成下列问题。
(1)一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸中直接加入纯化后的甲醇(CH3OH),同时向一个电极通入空气。
①此电池的正极发生的电极反应为_______ 。
②电解液中H+向_____ 极移动。
(2)如图所示,该装置通电5 min后,电极5的质量增加2.16 g,回答下列问题:____ 极,A池阴极电极反应:______ ,C池阳极电极反应:_______ 。
②如果B槽中共收集到224 mL气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为______ 。
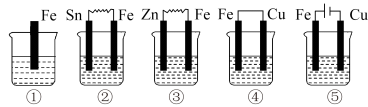
(3)下图各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由大到小的顺序为_____ 。______ 。
(1)一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸中直接加入纯化后的甲醇(CH3OH),同时向一个电极通入空气。
①此电池的正极发生的电极反应为
②电解液中H+向
(2)如图所示,该装置通电5 min后,电极5的质量增加2.16 g,回答下列问题:
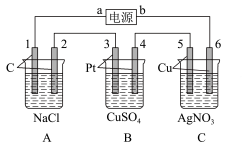
②如果B槽中共收集到224 mL气体(标准状况)且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为
(3)下图各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由大到小的顺序为
您最近一年使用:0次
解题方法
6 . 在-50 ℃时,液氨的电离跟水的电离相似,存在如下电离平衡:2NH3(l) 
 +
+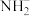 ,
, 的平衡浓度为1×10-15 mol·L-1,下列说法错误的是
的平衡浓度为1×10-15 mol·L-1,下列说法错误的是

 +
+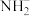 ,
, 的平衡浓度为1×10-15 mol·L-1,下列说法错误的是
的平衡浓度为1×10-15 mol·L-1,下列说法错误的是| A.在液氨中加入NaNH2,可使液氨的离子积变大 |
| B.在液氨中加入NH4Cl,液氨的离子积不变 |
| C.此温度下液氨的离子积K为1×10-30 |
| D.在液氨中加入金属钠可能有NaNH2生成 |
您最近一年使用:0次
7 . 完成下列问题。
(1)某温度下,纯水中的c(OH-)=1×10-6 mol/L,则此时c(H+)为_____ mol/L。若在温度不变时,往其中滴加盐酸使 c(H+)=1×10-4mol/L,则溶液中c(OH-)为_____ mol/L。若将此盐酸稀释 1 000 倍,则溶液的c(H+)约为______ mol/L。
(2)已知:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),Ksp=2×10-20。
Cu2+(aq)+2OH-(aq),Ksp=2×10-20。
①某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要使其生成 Cu(OH)2沉淀,应调整溶液的pH,使之大于_____ 。
②要使0.2 mol·L-1CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为_____ 。
(3)重金属离子会对河流和海洋造成严重污染。某化工厂废水(pH=2.0)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01 mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
①你认为往废水中加入_____ (填字母),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8,处理后废水中c(Pb2+)=_____ 。
(1)某温度下,纯水中的c(OH-)=1×10-6 mol/L,则此时c(H+)为
(2)已知:Cu(OH)2(s)
 Cu2+(aq)+2OH-(aq),Ksp=2×10-20。
Cu2+(aq)+2OH-(aq),Ksp=2×10-20。①某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要使其生成 Cu(OH)2沉淀,应调整溶液的pH,使之大于
②要使0.2 mol·L-1CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为
(3)重金属离子会对河流和海洋造成严重污染。某化工厂废水(pH=2.0)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01 mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 |
| 难溶电解质 | PbI2 | Pb(OH)2 | PbS |
| Ksp | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8,处理后废水中c(Pb2+)=
您最近一年使用:0次
8 . 完成下列问题。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子( ),则Q=
),则Q=______ 。
(2)已知反应aA(g)+bB(g) cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。_____ 。
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为______ 。
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______ 。
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
(4)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
①下列操作中,能提高CH4(g)平衡转化率的是____ (填标号)。
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=____ [写出含有α、b的计算式;对于反应mA(g)+nB(g) pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=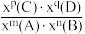 ,x为物质的量分数]。
,x为物质的量分数]。
(1)化学键的键能是形成(或断裂)1 mol化学键时释放(或吸收)的能量。以下是部分共价键键能的数据:H-S:364 kJ·mol-1,S-S:266 kJ·mol-1,S=O:522 kJ·mol-1,H-O:463 kJ·mol-1,试根据这些数据计算下列反应的反应热:2H2S(g)+SO2(g)= 3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是一个八元环状分子(
 ),则Q=
),则Q=(2)已知反应aA(g)+bB(g)
 cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物的量浓度随时间变化的曲线如图所示。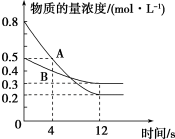
②经测定,前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
(3)向某容积不变的密闭容器中充入一定量的NO2,发生反应2NO2(g)
 N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。
N2O4(g) ΔH<0,达到平衡后,若分别单独改变下列条件,下列判断正确的是_____。| A.升高温度,混合气体的颜色变浅 |
| B.通入NO2,化学平衡常数增大 |
| C.通入NO2,重新达到平衡后混合气体的平均相对分子质量增大 |
| D.增大压强,平衡向正反应方向移动,混合气体的颜色变浅 |
Ⅰ.CH4(g)+H2O(g)
 CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)
CO(g)+3H2(g) Ⅱ.CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)①下列操作中,能提高CH4(g)平衡转化率的是
A.增加CH4 (g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②恒温恒压条件下,1 mol CH4 (g)和1 mol H2O(g)反应达平衡时,CH4 (g)的转化率为α,CO2(g)的物质的量为b mol,则反应Ⅰ的平衡常数Kx=
 pC(g)+qD(g),Kx=
pC(g)+qD(g),Kx=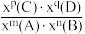 ,x为物质的量分数]。
,x为物质的量分数]。
您最近一年使用:0次
9 . 完成下列问题。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
①亚硫酸发生电离的方程式为______ 。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:______ 。
③在相同条件下,试比较H2CO3、 和
和 的酸性强弱:
的酸性强弱:____ >____ >____ 。
(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:____ 。
②a、b、c三点溶液的pH由大到小的顺序为____ ,电离程度最大的是____ 。
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择____ (填字母)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
(1)已知在25 ℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示。
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:
③在相同条件下,试比较H2CO3、
 和
和 的酸性强弱:
的酸性强弱:(2)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,请回答:
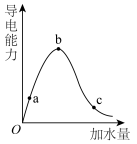
②a、b、c三点溶液的pH由大到小的顺序为
③若使c点溶液中c(CH3COO-)增大,在如下措施中可选择
A.加热 B.加很稀的NaOH溶液 C.加固体KOH
D.加水 E.加CH3COONa(s) F.加锌粉
(3)向氨水中加入醋酸溶液,其导电能力(I)与加入醋酸溶液的体积(V)关系正确的是______。
A. | B. | C. | D. |
您最近一年使用:0次
10 . 某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是
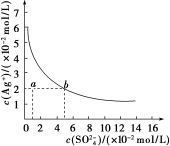
A.含有大量 的溶液中肯定不存在Ag+ 的溶液中肯定不存在Ag+ |
| B.0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀 |
| C.Ag2SO4的溶度积常数(Ksp)为1×10-5 |
| D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
您最近一年使用:0次



