名校
解题方法
1 . Ⅰ.明胶是水溶性蛋白质混合物,溶于水形成胶体。工业明胶含有重金属 ,对人体有害。
,对人体有害。
(1)已知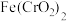 中
中 是一种酸根离子,则
是一种酸根离子,则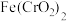 属于
属于___________ (填“酸”“碱”“盐”或“氧化物”),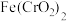 中铁元素的化合价为
中铁元素的化合价为___________ 价。
(2)明胶的水溶液和 溶液共同具有的性质是
溶液共同具有的性质是___________ (填字母)。
A.都不稳定,密封放置会产生沉淀 B.两者均有丁达尔效应 C.分散质粒子都可通过滤纸
Ⅱ. 是银白色金属,化学性质稳定,
是银白色金属,化学性质稳定, 价和
价和 价为常见价态。工业上以铬铁矿(主要成分为
价为常见价态。工业上以铬铁矿(主要成分为 ,含
,含
 等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠
等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠 ,其主要工艺流程如下。
,其主要工艺流程如下。

查阅资料:常温下, 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为 。
。
(3)工业上常采用热还原法制备金属铬,写出以 为原料,利用铝热反应制取金属铬的化学方程式:
为原料,利用铝热反应制取金属铬的化学方程式:___________ 。
(4)酸化滤液D时,用硫酸而不用盐酸,可能的原因是___________ 。
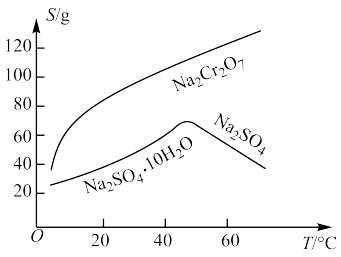
(5)固体E的主要成分是 ,根据下图分析操作a为
,根据下图分析操作a为___________ 、___________ 。
(6)电镀厂产生的镀铜废水中往往含有一定量的 ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:

① 的化学性质与
的化学性质与 相似。在上述生产过程中加入
相似。在上述生产过程中加入 溶液时要控制溶液的
溶液时要控制溶液的 不能过高,是因为
不能过高,是因为___________ (用离子方程式表示)。
②下列溶液中可以代替上述流程中 溶液的是
溶液的是___________ (填字母)。
A.浓硫酸 B.酸性 溶液 C.
溶液 C. 溶液
溶液
③上述流程中,每消耗0.1mol 转移0.8mole-,则加入
转移0.8mole-,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为___________ 。
 ,对人体有害。
,对人体有害。(1)已知
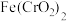 中
中 是一种酸根离子,则
是一种酸根离子,则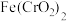 属于
属于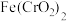 中铁元素的化合价为
中铁元素的化合价为(2)明胶的水溶液和
 溶液共同具有的性质是
溶液共同具有的性质是A.都不稳定,密封放置会产生沉淀 B.两者均有丁达尔效应 C.分散质粒子都可通过滤纸
Ⅱ.
 是银白色金属,化学性质稳定,
是银白色金属,化学性质稳定, 价和
价和 价为常见价态。工业上以铬铁矿(主要成分为
价为常见价态。工业上以铬铁矿(主要成分为 ,含
,含
 等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠
等杂质)为主要原料生产金属铬和强氧化剂重铬酸钠 ,其主要工艺流程如下。
,其主要工艺流程如下。
查阅资料:常温下,
 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为 。
。(3)工业上常采用热还原法制备金属铬,写出以
 为原料,利用铝热反应制取金属铬的化学方程式:
为原料,利用铝热反应制取金属铬的化学方程式:(4)酸化滤液D时,用硫酸而不用盐酸,可能的原因是
(5)固体E的主要成分是
 ,根据下图分析操作a为
,根据下图分析操作a为
(6)电镀厂产生的镀铜废水中往往含有一定量的
 ,处理该废水常用还原沉淀法,具体流程如下:
,处理该废水常用还原沉淀法,具体流程如下:
①
 的化学性质与
的化学性质与 相似。在上述生产过程中加入
相似。在上述生产过程中加入 溶液时要控制溶液的
溶液时要控制溶液的 不能过高,是因为
不能过高,是因为②下列溶液中可以代替上述流程中
 溶液的是
溶液的是A.浓硫酸 B.酸性
 溶液 C.
溶液 C. 溶液
溶液③上述流程中,每消耗0.1mol
 转移0.8mole-,则加入
转移0.8mole-,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为
您最近一年使用:0次
2021-12-04更新
|
87次组卷
|
2卷引用:宁夏石嘴山市平罗中学2021-2022学年高三上学期期中考试化学试题
名校
2 . 下列结论正确 的是
①微粒半径:S2->K+>Al3+
②氢化物的稳定性:HF>HCl>SiH4
③离子的还原性: Cl->Br->I-
④氧化性:F2>S>Se
⑤酸性:HClO>H2SO4>H3PO4
⑥非金属性:O>N>Si
⑦金属性:Be>Ca>K
⑧碱性:NaOH>Be(OH)2>LiOH
①微粒半径:S2->K+>Al3+
②氢化物的稳定性:HF>HCl>SiH4
③离子的还原性: Cl->Br->I-
④氧化性:F2>S>Se
⑤酸性:HClO>H2SO4>H3PO4
⑥非金属性:O>N>Si
⑦金属性:Be>Ca>K
⑧碱性:NaOH>Be(OH)2>LiOH
| A.①②④⑥ | B.①③④⑥ | C.①③⑥⑧ | D.②⑤⑥⑧ |
您最近一年使用:0次
3 . 某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为________ ;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有______ (填“氧化性”、“还原性”或“酸性”);②请配平该反应的离子方程式:_____ MnO4-+____ H2C2O4+___ H+=___ Mn2++____ CO2↑+_____ H2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):
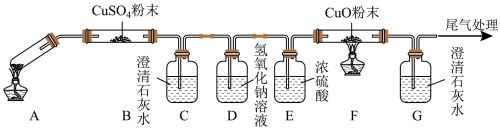
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
①上述装置中,D的作用是_________ ,
②乙二酸分解的化学方程式为________ ;
(4)该小组同学将2.52g草酸晶体(H2C2O4•2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______ (用文字简单表述),该溶液中各离子的浓度由大到小的顺序为:_______ (用离子符号表示).
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
①上述装置中,D的作用是
②乙二酸分解的化学方程式为
(4)该小组同学将2.52g草酸晶体(H2C2O4•2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是
您最近一年使用:0次
2019-09-12更新
|
158次组卷
|
12卷引用:2011届宁夏银川一中高三上学期第五次月考(理综)化学部分
(已下线)2011届宁夏银川一中高三上学期第五次月考(理综)化学部分(已下线)2011届宁夏银川一中高三第五次月考化学试卷2017届宁夏固原市第一中学高三下学期第一次月考理综化学试卷22017届宁夏固原市第一中学高三下学期第一次月考理综化学试卷2017届宁夏固原市第一中学高三下学期第一次月考理综化学试卷12016届河北邯郸第一中学高三一轮收官考试一理综化学卷【市级联考】广东省潮州市2018-2019学年高二下学期期末教学质量检测理科综合化学试题云南省文山壮族苗族自治州马关县第一中学2020届高三上学期9月份考试化学试题云南省文山州砚山县一中2020届高三上学期开学考试化学试题云南省元阳县第一中学2020届高三上学期开学考试化学试题云南省宾川县三中2020届高三上学期开学考试化学试题云南省峨山县一中2019-2020学年高三上学期期中考试理综化学试题
解题方法
4 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)实验室制Cl2的反应中,浓盐酸所起的作用有_______ (填序号)。
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为_______ (用离子方程式表示,)。
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
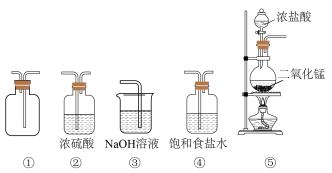
A.上述仪器的正确顺序(用序号表示):_______ ;
B.②装置中,浓硫酸的作用是_______ ;
C.⑤装置中发生反应的离子方程式为:_______ 。
(1)实验室制Cl2的反应中,浓盐酸所起的作用有
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:

A.上述仪器的正确顺序(用序号表示):
B.②装置中,浓硫酸的作用是
C.⑤装置中发生反应的离子方程式为:
您最近一年使用:0次
2023-02-10更新
|
62次组卷
|
2卷引用:宁夏银川市贺兰县景博中学2022-2023学年高一下学期第一次质量检测化学试题
名校
解题方法
5 . 苹果汁中含有 ,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生,这说明维生素C有
,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生,这说明维生素C有
 ,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生,这说明维生素C有
,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生,这说明维生素C有| A.碱性 | B.氧化性 | C.还原性 | D.酸性 |
您最近一年使用:0次
2022-11-07更新
|
656次组卷
|
20卷引用:宁夏吴忠市吴忠中学2023-2024学年高一上学期11月期中考试化学试题
宁夏吴忠市吴忠中学2023-2024学年高一上学期11月期中考试化学试题宁夏银川市永宁县永宁中学2023-2024学年高一上学期第一次月考化学试卷重庆市杨家坪中学2022-2023学年高一上学期第一次月考化学试题天津市民族中学2022~2023学年高一上学期期中考试化学试题新疆巴音郭楞蒙古自治州第二中学2022-2023学年高一上学期期中考试化学(B卷)试题广东省清远市四校2022-2023学年高一上学期期中考试化学试题浙江省金华市曙光学校2022-2023学年高一上学期第一次阶段考试(10月)化学试题吉林省永吉县第四中学2022-2023学年高一上学期期末考试化学试题河北省石家庄北华中学2022-2023学年高一上学期期末考试(线上)化学试题新疆哈密市第八中学2022-2023学年高一上学期期末考试化学试题河北省邯郸市永年区第二中学2022-2023学年高一上学期期末考试化学试题广西南宁市第五十六中学2022-2023学年高一上学期期中考试化学试题广东省东莞实验中学2022-2023学年高一上学期期中考试化学试题安徽省马鞍山市第二十二中学2022-2023学年高一上学期11月期中考试化学试题广东省广州市真光中学2023-2024学年高一上学期期中考试化学试题陕西省西咸新区2023-2024学年高一上学期11月期中考试化学试题江苏省江阴市华士高级中学2023-2024学年高一上学期10月学情调研化学试题广东省江门市江海区外海中学2023-2024学年高一上学期期中考试化学试题四川省南充市阆中东风中学校2023-2024学年高一上学期第二次段考化学试题河北省邯郸市魏县第五中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
6 . 某校化学实验兴趣小组,为了探究MnO2和浓盐酸反应制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质。甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要按要求回答问题。已知Cl2易溶于CCl4。
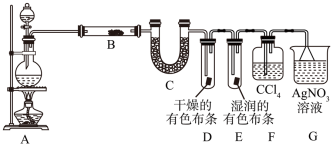
(1)写出A装置中发生反应的离子方程式:___________ 。
(2)若用含有0.2molHCl的浓盐酸与足量的MnO2反应,制氯气制得的Cl2物质的量总是小于理论值的原因是___________ 。
(3)B装置盛放的药品是无水CuSO4作用是___________ 。
(4)装置D和E中出现的不同现象说明___________ 。
(5)装置F的作用是___________ 。
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在F与G之间加一个检验装置,装置中应盛放___________ 。
A.NaOH溶液 B.湿润的淀粉KI试纸 C.浓硫酸
(7)已知高锰酸钾与浓盐酸混合能产生氯气,化学反应方程式为: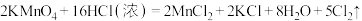 ,则氧化性强弱:
,则氧化性强弱:
___________ 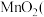 填“>”,“<”或“=”)。反应中HCl表现出的性质是
填“>”,“<”或“=”)。反应中HCl表现出的性质是___________ 。(填写字母)
a、还原性 b、酸性 c、氧化性

(1)写出A装置中发生反应的离子方程式:
(2)若用含有0.2molHCl的浓盐酸与足量的MnO2反应,制氯气制得的Cl2物质的量总是小于理论值的原因是
(3)B装置盛放的药品是无水CuSO4作用是
(4)装置D和E中出现的不同现象说明
(5)装置F的作用是
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在F与G之间加一个检验装置,装置中应盛放
A.NaOH溶液 B.湿润的淀粉KI试纸 C.浓硫酸
(7)已知高锰酸钾与浓盐酸混合能产生氯气,化学反应方程式为:
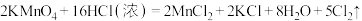 ,则氧化性强弱:
,则氧化性强弱:
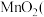 填“>”,“<”或“=”)。反应中HCl表现出的性质是
填“>”,“<”或“=”)。反应中HCl表现出的性质是a、还原性 b、酸性 c、氧化性
您最近一年使用:0次
7 . I.实验室用如图所示装置制取干燥、纯净的Cl2和NO,并用二者在常温常压下反应制取亚硝氯(NOCl)。已知:NOCl的熔点为-64.5℃,沸点为-5.5℃,遇水剧烈反应生成氨的两种常见氧化物和HCl。
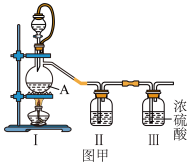
回答下列问题:
(1)用图甲所示装置制备干燥、纯净的Cl2、NO。
①制备Cl2时所用试剂为浓盐酸和MnO2,A中发生反应的离子方程式为____ 。
②制备NO时用Cu与稀硝酸反应,装置II中的试剂为H2O,H2O的作用是____ 。
(2)用图乙所示装置制备NOCl。
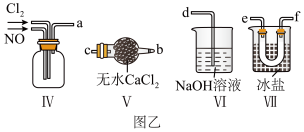
①图乙中装置V的名称是____ 。
②图乙中各装置接口的连接顺序为a→e→f→____ (填标号)。
③装置IV中发生反应的化学方程式为____ 。
④装置VI吸收尾气时,NOCl发生反应的化学方程式为____ 。
II.公元前9世纪,二氧化硫就被用于消毒和漂白。实验室可用下列装置(部分夹持仪器略去)制取SO2并验证其性质。
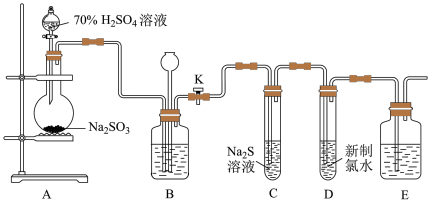
(3)检查装置A、B气密性的操作为:先关闭装置A中分液漏斗活塞和装置B中止水夹K,往长颈漏斗中注水至水柱高于广口瓶液面,若观察到____ ,则气密性良好。
(4)装置A中反应的化学方程式为____ 。
(5)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有____ (填“还原性”、“氧化性”或“漂白性”)。经测定,产物中含有一种摩尔质量为104g•mol-1的盐,该盐的化学式为_____ 。
(6)实验结束时,关闭止水夹K,装置B所起的作用是____ 。
(7)取少量试管D中的溶液,加入BaCl2溶液,产生白色沉淀。
①该白色沉淀为____ (写化学式)。
②原试管D中反应的化学方程式为____ 。
(8)利用产生的SO2,设计实验探究亚硫酸与次氯酸的酸性强弱。
①将少量SO2气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是____ (用化学反应方程式表示)。
②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是____ ,其作用是____ ,通过___ (填现象)即可证明亚硫酸的酸性强于次氯酸。

回答下列问题:
(1)用图甲所示装置制备干燥、纯净的Cl2、NO。
①制备Cl2时所用试剂为浓盐酸和MnO2,A中发生反应的离子方程式为
②制备NO时用Cu与稀硝酸反应,装置II中的试剂为H2O,H2O的作用是
(2)用图乙所示装置制备NOCl。

①图乙中装置V的名称是
②图乙中各装置接口的连接顺序为a→e→f→
③装置IV中发生反应的化学方程式为
④装置VI吸收尾气时,NOCl发生反应的化学方程式为
II.公元前9世纪,二氧化硫就被用于消毒和漂白。实验室可用下列装置(部分夹持仪器略去)制取SO2并验证其性质。

(3)检查装置A、B气密性的操作为:先关闭装置A中分液漏斗活塞和装置B中止水夹K,往长颈漏斗中注水至水柱高于广口瓶液面,若观察到
(4)装置A中反应的化学方程式为
(5)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有
(6)实验结束时,关闭止水夹K,装置B所起的作用是
(7)取少量试管D中的溶液,加入BaCl2溶液,产生白色沉淀。
①该白色沉淀为
②原试管D中反应的化学方程式为
(8)利用产生的SO2,设计实验探究亚硫酸与次氯酸的酸性强弱。
①将少量SO2气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是
您最近一年使用:0次
名校
解题方法
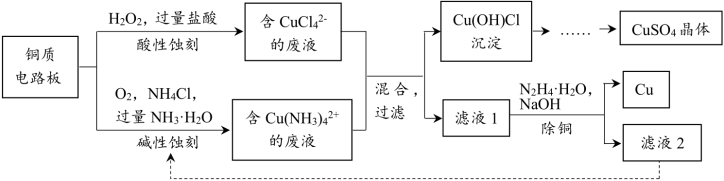
8 . 铜质电路板可采用酸性蚀刻与碱性蚀刻两种方法。将二者的废液混合可实现回收再利用。其主要流程如图:
已知:①水合肼N2H4·H2O具有强还原性,易被氧化为N2
②Cu2++4NH3 Cu(NH3)
Cu(NH3)
(1)蚀刻
①酸性蚀刻铜的离子方程式:___________
②关于蚀刻的下列说法正确的是___________ 。
A.碱性蚀刻和酸性蚀刻分别利用了O2、H2O2的氧化性
B.酸性蚀刻时盐酸的主要作用是增强溶液的酸性
C.用H2O2、H2SO4、NaCl也可以使Cu溶解
(2)滤液1的pH约为5,其中除少量Cu2+外,还大量存在的离子是___________ 。
(3)除铜
①利用水合肼N2H4·H2O还原Cu2+的离子方程式是___________ 。
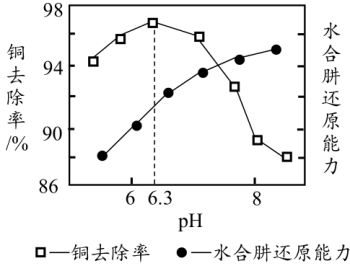
②已知该反应瞬间完成。滤渣成分只有Cu。测得铜去除率、水合肼还原能力随溶液pH的变化情况如图所示。由图可知。随溶液pH增大,铜去除率先增加后减小,结合图给值息和已知信息分析其原因:___________ 。

已知:①水合肼N2H4·H2O具有强还原性,易被氧化为N2
②Cu2++4NH3
 Cu(NH3)
Cu(NH3)
(1)蚀刻
①酸性蚀刻铜的离子方程式:
②关于蚀刻的下列说法正确的是
A.碱性蚀刻和酸性蚀刻分别利用了O2、H2O2的氧化性
B.酸性蚀刻时盐酸的主要作用是增强溶液的酸性
C.用H2O2、H2SO4、NaCl也可以使Cu溶解
(2)滤液1的pH约为5,其中除少量Cu2+外,还大量存在的离子是
(3)除铜
①利用水合肼N2H4·H2O还原Cu2+的离子方程式是
②已知该反应瞬间完成。滤渣成分只有Cu。测得铜去除率、水合肼还原能力随溶液pH的变化情况如图所示。由图可知。随溶液pH增大,铜去除率先增加后减小,结合图给值息和已知信息分析其原因:

您最近一年使用:0次
2021-11-27更新
|
480次组卷
|
3卷引用:宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题
宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题黑龙江省牡丹江市第一高级中学2021-2022学年高三上学期期中考试化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
12-13高一上·黑龙江大庆·期末
名校
9 . 物质在反应中可表现氧化性、还原性、酸性、碱性等,下面方程式中划线的物质,能在同一反应中同时表现上述两种或两种以上性质的有( )
①3FeO + 10HNO3 = 3Fe(NO3)3 + NO + 5H2O
②C + 2H2SO4(浓) = CO2 + 2SO2 + 2H2O
③8NH3 + 3Cl2 =6NH4Cl + N2
④2Na2O2 + 2H2O =4NaOH + O2
①3FeO + 10HNO3 = 3Fe(NO3)3 + NO + 5H2O
②C + 2H2SO4(浓) = CO2 + 2SO2 + 2H2O
③8NH3 + 3Cl2 =6NH4Cl + N2
④2Na2O2 + 2H2O =4NaOH + O2
| A.①② | B.①④ | C.③④ | D.全部 |
您最近一年使用:0次
2020-10-24更新
|
125次组卷
|
15卷引用:宁夏回族自治区中卫市海原县第一中学2020-2021学年高一上学期第二次月考化学试题
宁夏回族自治区中卫市海原县第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)2011—2012学年度黑龙江大庆实验中学高一上学期期末考试化学试卷(已下线)2011-2012学年河北省邯郸市高一下学期期末教学质量检测化学试卷(已下线)2012-2013学年黑龙江省集贤县第一中学高一上学期期末考试化学试卷(已下线)2015届福建省三明一中高三学年度上学期第一次月考化学试卷(已下线)2015届福建省三明一中高三上学期第一次月考化学试卷2016届湖南省衡阳市第八中学高三上学期第二次月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷湖南省邵东县第一中学2017届高三上学期第三次月考化学试题福建省龙海市第二中学2016-2017学年高二下学期期末考试化学试题(已下线)二轮复习 专题6 非金属及其化合物 押题专练(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(押题专练)浙江省余姚中学2020-2021学年高二上学期10月质量检测化学试题浙江省宁波市余姚中学2020-2021学年高一上学期10月质量检测化学试题(已下线)【浙江新东方】62
10 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
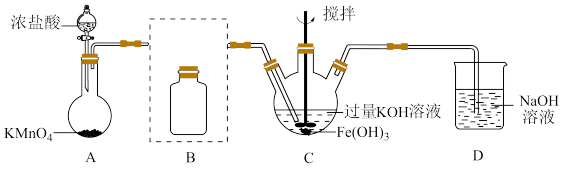
①A为氯气发生装置。A中反应方程式是________________ (锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。_______
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有________________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________ 产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2________  (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是________________ 。
③资料表明,酸性溶液中的氧化性 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:________________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH
 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
2018-06-09更新
|
9679次组卷
|
31卷引用:宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题
宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题(已下线)高考母题题源18 化学实验设计与探究(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019年高考总复习巅峰冲刺-专题03 氧化还原反应 离子反应应试策略(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 高考帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 高考帮河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题(已下线)易错22 气体实验装置的设计-备战2021年高考化学一轮复习易错题(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第7讲 铁及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向14 物质制备探究-备战2022年高考化学一轮复习考点微专题四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)天津市耀华中学2023届高三第一次统练化学试题云南省玉溪市华宁县第二中学2021-2022年高一下学期开学考试化学试题第三章 金属及其化合物 第14讲 铁及其化合物的转化关系(已下线)第一部分 化学综合实验 热点6 物质性质探究实验北京一零一中学2023-2024学年高一上学期11月统练三化学试卷河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题



