名校
1 . 下列实验设计能达到实验目的的是
| 选项 | 实验设计 | 实验目的 |
| A | 向NaOH样品中加水后滴加足量稀盐酸,观察是否有气泡冒出 | 检验NaOH样品是否完全变质 |
| B | 将混合气体依次通过足量的无水硫酸铜、浓硫酸、石灰水、氢氧化钠溶液 | 验证并除去氧气中的水蒸气和二氧化碳 |
| C | 将锌片与某金属X粉末分别加入稀硫酸,X与稀硫酸反应产生气泡快 | 证明X的活动性比锌强 |
| D | 先加足量水溶解,再加适量稀盐酸,最后蒸发结晶 | 除去NaCl固体中的少量 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 .  在工业上有广泛的用途。以硫铁矿(主要成分为
在工业上有广泛的用途。以硫铁矿(主要成分为 )为原料制备
)为原料制备 的工艺流程如下图:
的工艺流程如下图:_______ (写出一种)。
(2)“操作”在实验室的名称为_______ ,需用到的玻璃仪器是_______ 、玻璃棒和烧杯。
(3)黄铁矿焙烧后得到的主要固体为 ,写出“焙烧”的化学方程式为
,写出“焙烧”的化学方程式为_______ 。
(4)“……”表示的操作为在_______ 气流中蒸发浓缩、_______ 、过滤。
(5)为防治 引起的污染,某工厂设计了新的治污方法,同时可得到化工产品
引起的污染,某工厂设计了新的治污方法,同时可得到化工产品 。该工艺流程如图所示,过程中起催化作用的物质是
。该工艺流程如图所示,过程中起催化作用的物质是_______ ,生成化工产品 的化学方程式为
的化学方程式为_______ 。 生产硫酸。用
生产硫酸。用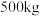 含
含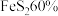 的硫铁矿,生产过程中硫损失
的硫铁矿,生产过程中硫损失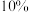 ,则可得
,则可得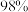 的硫酸
的硫酸_______  。
。
 在工业上有广泛的用途。以硫铁矿(主要成分为
在工业上有广泛的用途。以硫铁矿(主要成分为 )为原料制备
)为原料制备 的工艺流程如下图:
的工艺流程如下图: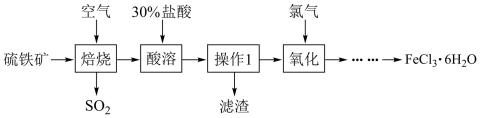
(2)“操作”在实验室的名称为
(3)黄铁矿焙烧后得到的主要固体为
 ,写出“焙烧”的化学方程式为
,写出“焙烧”的化学方程式为(4)“……”表示的操作为在
(5)为防治
 引起的污染,某工厂设计了新的治污方法,同时可得到化工产品
引起的污染,某工厂设计了新的治污方法,同时可得到化工产品 。该工艺流程如图所示,过程中起催化作用的物质是
。该工艺流程如图所示,过程中起催化作用的物质是 的化学方程式为
的化学方程式为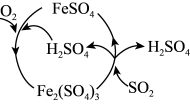
 生产硫酸。用
生产硫酸。用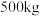 含
含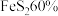 的硫铁矿,生产过程中硫损失
的硫铁矿,生产过程中硫损失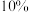 ,则可得
,则可得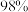 的硫酸
的硫酸 。
。
您最近一年使用:0次
名校
解题方法
3 . 一种制备 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数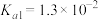 ,
,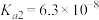 。下列说法正确的是
。下列说法正确的是
 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数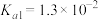 ,
,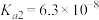 。下列说法正确的是
。下列说法正确的是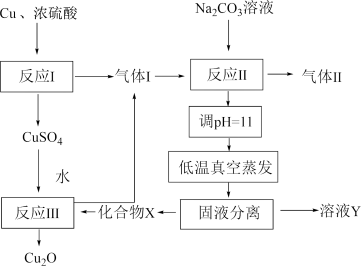
A.反应 、 、 、 、 均为氧化还原反应 均为氧化还原反应 |
B.低温真空蒸发主要目的是防止 被氧化 被氧化 |
C.溶液Y可循环用于反应 所在操作单元吸收气体 所在操作单元吸收气体 |
D.若 产量不变,参与反应 产量不变,参与反应 的X与 的X与 物质的量之比 物质的量之比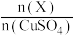 增大时,需补加 增大时,需补加 的量增多 的量增多 |
您最近一年使用:0次
2024-06-10更新
|
105次组卷
|
4卷引用:福建省福州第三中学2023-2024学年高三上学期第五次质量检测化学试题
4 . 氧化还原反应可拆分为氧化和还原两个“半反应”,某小组同学从“半反应”的角度探究反应规律。
(1)已知: 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。
①该转化的还原半反应是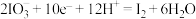 ,则相应的氧化半反应是
,则相应的氧化半反应是___________ 。
②分析上述还原半反应可知:增大 可促进
可促进 得到电子,使其
得到电子,使其___________ 性增强,进而与 发生反应。
发生反应。
(2)探究 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。
①有同学认为 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是___________ 。
用如下装置进行实验【硫酸与浓盐酸中 接近】。
接近】。
②甲实验的目的是___________ 。
③a.丙中气球变鼓是因为生成了___________ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:___________ 。
(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧 电极表面有
电极表面有 析出。
析出。
①该装置中左侧  电极作
电极作___________ (填“正”或“负”)极。
②写出该装置右侧 烧杯中的电极反应式___________ 。
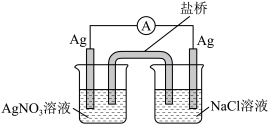
对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池__________ 。
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
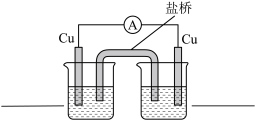
a.若能,在右装置图中填写烧杯中的试剂,并标出电子的移动方向 。
b.若不能,说明原因。
(1)已知:
 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。①该转化的还原半反应是
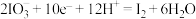 ,则相应的氧化半反应是
,则相应的氧化半反应是②分析上述还原半反应可知:增大
 可促进
可促进 得到电子,使其
得到电子,使其 发生反应。
发生反应。(2)探究
 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。①有同学认为
 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是用如下装置进行实验【硫酸与浓盐酸中
 接近】。
接近】。| 装置 | 序号 | 试管内药品 | 现象 |
 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 |  粉+硫酸 粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 |  粉+浓盐酸 粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在
 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧
 电极表面有
电极表面有 析出。
析出。①该装置中
 电极作
电极作②写出该装置

对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
a.若能,在右装置图中填写烧杯中的试剂,
b.若不能,说明原因。
您最近一年使用:0次
5 .  在实验研究和化学工业中应用广泛,有多种制备方法。
在实验研究和化学工业中应用广泛,有多种制备方法。
Ⅰ.利用 溶液吸收
溶液吸收 制备
制备 溶液
溶液
(1)写出该制备方法的离子方程式___________ 。
(2) 时,
时, 与
与 反应后的溶液中,
反应后的溶液中, 价含
价含 微粒(
微粒( 和
和 )物质的量分数随
)物质的量分数随 变化如图1所示:
变化如图1所示:
Ⅱ.利用工业废碱渣(主要成分 )吸收硫酸厂尾气中的
)吸收硫酸厂尾气中的 制备无水
制备无水 的成本低,优势明显。其流程如下:
的成本低,优势明显。其流程如下: )显碱性的原因
)显碱性的原因___________ 。
(4)图2为吸收塔中 溶液与
溶液与 反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是
反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是___________ 。___________ 。
(6)为了降低由中和器所得溶液中 的溶解度,从而提高结晶产率,中和器中加入的
的溶解度,从而提高结晶产率,中和器中加入的 是过量的。
是过量的。
①请结合化学反应原理解释 过量的原因
过量的原因___________ 。
②结晶时应选择的最佳操作是___________ (选填字母)。
a.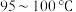 加热蒸发,直至蒸干
加热蒸发,直至蒸干
b.维持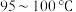 蒸发浓缩至有大量晶体析出,趁热过滤
蒸发浓缩至有大量晶体析出,趁热过滤
c.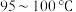 加热浓缩,冷却至室温结晶,过滤
加热浓缩,冷却至室温结晶,过滤
(7)为检验 成品中是否含少量
成品中是否含少量 ,需选用的试剂是
,需选用的试剂是___________ 。
 在实验研究和化学工业中应用广泛,有多种制备方法。
在实验研究和化学工业中应用广泛,有多种制备方法。Ⅰ.利用
 溶液吸收
溶液吸收 制备
制备 溶液
溶液(1)写出该制备方法的离子方程式
(2)
 时,
时, 与
与 反应后的溶液中,
反应后的溶液中, 价含
价含 微粒(
微粒( 和
和 )物质的量分数随
)物质的量分数随 变化如图1所示:
变化如图1所示: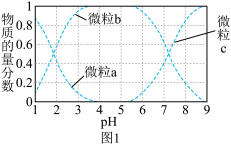
A.曲线 表示 表示 物质的量分数随溶液 物质的量分数随溶液 变化的曲线 变化的曲线 |
B. 的溶液中: 的溶液中: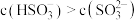 |
C. 的溶液中: 的溶液中: |
D. 的 的 溶液中存在: 溶液中存在: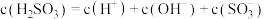 |
Ⅱ.利用工业废碱渣(主要成分
 )吸收硫酸厂尾气中的
)吸收硫酸厂尾气中的 制备无水
制备无水 的成本低,优势明显。其流程如下:
的成本低,优势明显。其流程如下: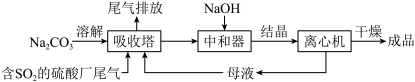
 )显碱性的原因
)显碱性的原因(4)图2为吸收塔中
 溶液与
溶液与 反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是
反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是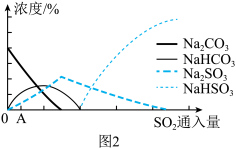
| 资料显示: Ⅰ.  在 在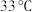 时溶解度最大,将其饱和溶液加热至 时溶解度最大,将其饱和溶液加热至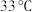 以上时,由于溶解度降低会析出无水 以上时,由于溶解度降低会析出无水 ,冷却至 ,冷却至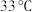 以下时析出 以下时析出 ; ;Ⅱ.无水  在空气中不易被氧化, 在空气中不易被氧化, 在空气中易被氧化。 在空气中易被氧化。 |
(6)为了降低由中和器所得溶液中
 的溶解度,从而提高结晶产率,中和器中加入的
的溶解度,从而提高结晶产率,中和器中加入的 是过量的。
是过量的。①请结合化学反应原理解释
 过量的原因
过量的原因②结晶时应选择的最佳操作是
a.
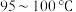 加热蒸发,直至蒸干
加热蒸发,直至蒸干b.维持
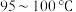 蒸发浓缩至有大量晶体析出,趁热过滤
蒸发浓缩至有大量晶体析出,趁热过滤c.
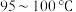 加热浓缩,冷却至室温结晶,过滤
加热浓缩,冷却至室温结晶,过滤(7)为检验
 成品中是否含少量
成品中是否含少量 ,需选用的试剂是
,需选用的试剂是
您最近一年使用:0次
6 . 国家主席习近平提出了中国应对气候变化的两个目标:二氧化碳排放力争于2030年前达到峰值,于2060年前实现碳中和。杭州亚运会火炬使用的燃料为“零碳甲醇”,是利用焦炉气中的H2与从工业尾气中捕集的二氧化碳反应合成,实现废碳再生、循环内零碳排放。
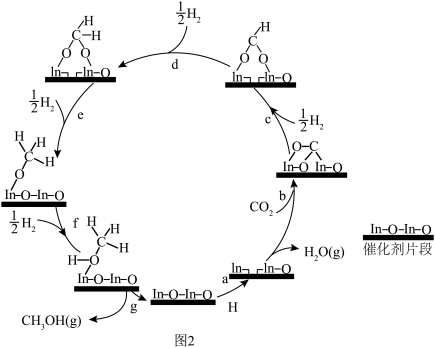
(1)已知:某温度下物质的相对能量如下图1所示,在In2O3催化下用CO2(g)和H2(g)制备CH3OH(g)的反应原理如图2。___________ 。
①该反应在___________ (填“高温”或“低温”)下能自发进行。
②向一绝热恒容密闭容器中充入等物质的量的H2和CO2进行反应,下面不能判断该反应已达到平衡状态的是___________ 。
A混合气体的密度保持不变 B.总压强不变
C.平衡常数不变 D.H2的转化率保持不变
(2)煤制甲醇的生产工艺中,由合成气(组成为H2、CO和少量的CO2)可直接制备甲醇,主要包括以下三个反应:
ⅰ.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41.1kJ/mol
CO(g)+H2O(g) △H1=+41.1kJ/mol
ⅱ.CO(g)+2H2(g) CH3OH(g) △H1=+90.1kJ/mol
CH3OH(g) △H1=+90.1kJ/mol
ⅲ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
t℃、100kPa下,将3molH2(g)、1molCO2(g)和6molKr(g)投入一恒容密闭容器中发生反应。反应达到平衡时,测得容器中CH3OH(g)为0.5mol、CO(g)为0.2mol。
①CO2的平衡转化率为___________ 。
②反应ⅱ的平衡常数Kx=___________ (保留位小数)[对于反应aM(g)+bN(g) cZ(g)+dQg),Kx=
cZ(g)+dQg),Kx=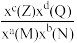 ,x为物质的量分数]。
,x为物质的量分数]。
(3)2023年11月20日,福岛核电站第三批次核污水排放结束,从8月24日正式开启排污,不到三个月的时间,己有超2.3万吨核污水流入太平洋,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料,核废料中+6价的铀[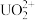 ]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:
]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:___________ 。
②阴极上可能发生副反应: +3H++2e-=HNO2+H2O、2HNO2+U4+=
+3H++2e-=HNO2+H2O、2HNO2+U4+=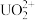 +2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+
+2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+ =N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是
=N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是___________ 。
③电还原处理+6价的铀转移1rnole-,阴极区H+减少___________ mol(不考虑副反应)。
(1)已知:某温度下物质的相对能量如下图1所示,在In2O3催化下用CO2(g)和H2(g)制备CH3OH(g)的反应原理如图2。

①该反应在
②向一绝热恒容密闭容器中充入等物质的量的H2和CO2进行反应,下面不能判断该反应已达到平衡状态的是
A混合气体的密度保持不变 B.总压强不变
C.平衡常数不变 D.H2的转化率保持不变
(2)煤制甲醇的生产工艺中,由合成气(组成为H2、CO和少量的CO2)可直接制备甲醇,主要包括以下三个反应:
ⅰ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41.1kJ/mol
CO(g)+H2O(g) △H1=+41.1kJ/molⅱ.CO(g)+2H2(g)
 CH3OH(g) △H1=+90.1kJ/mol
CH3OH(g) △H1=+90.1kJ/mol ⅲ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3t℃、100kPa下,将3molH2(g)、1molCO2(g)和6molKr(g)投入一恒容密闭容器中发生反应。反应达到平衡时,测得容器中CH3OH(g)为0.5mol、CO(g)为0.2mol。
①CO2的平衡转化率为
②反应ⅱ的平衡常数Kx=
 cZ(g)+dQg),Kx=
cZ(g)+dQg),Kx=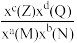 ,x为物质的量分数]。
,x为物质的量分数]。(3)2023年11月20日,福岛核电站第三批次核污水排放结束,从8月24日正式开启排污,不到三个月的时间,己有超2.3万吨核污水流入太平洋,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料,核废料中+6价的铀[
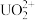 ]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示:
]可以通过电化学还原法处理,+6价的铀被还原为U4+的电化学装置如图所示: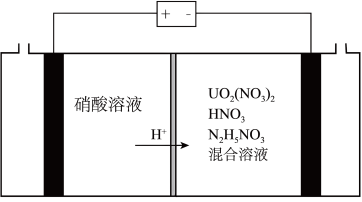
②阴极上可能发生副反应:
 +3H++2e-=HNO2+H2O、2HNO2+U4+=
+3H++2e-=HNO2+H2O、2HNO2+U4+=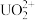 +2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+
+2NO↑+2H+,为了减少副反应造成的影响,可向阴极区溶液中加入N2H5NO3,发生的反应为:2HNO2+ =N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是
=N2O↑+N2↑+3H2O+H+,溶液中加入N2H5NO3的具体作用是③电还原处理+6价的铀转移1rnole-,阴极区H+减少
您最近一年使用:0次
7 . 恒容密闭反应器中间有一个可自由移动的导热隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:甲:A(g)+B(g) 2C(g) △H>0、乙:X(g)+3Y(g)
2C(g) △H>0、乙:X(g)+3Y(g) 2Z(g) △H<0起初甲、乙中反应均达到平衡时隔板位于正中间,然后进行相关操作,下列叙述正确的是
2Z(g) △H<0起初甲、乙中反应均达到平衡时隔板位于正中间,然后进行相关操作,下列叙述正确的是
 2C(g) △H>0、乙:X(g)+3Y(g)
2C(g) △H>0、乙:X(g)+3Y(g) 2Z(g) △H<0起初甲、乙中反应均达到平衡时隔板位于正中间,然后进行相关操作,下列叙述正确的是
2Z(g) △H<0起初甲、乙中反应均达到平衡时隔板位于正中间,然后进行相关操作,下列叙述正确的是
| A.恒温条件下,向甲中通入C气体,再次平衡时,Z的物质的量浓度不变 |
| B.恒温条件下,向乙中通入惰性气体,再次平衡时,乙中Z的浓度减小 |
| C.绝热条件下,向乙中通入Z气体,A的平衡转化率不变 |
| D.绝热条件下,向甲中通入惰性气体,再次平衡时,C的物质的量不变 |
您最近一年使用:0次
8 . 常温下,下列有关电解质溶液的说法正确的是
| A.pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,所得混合溶液中:c(H+)<c(OH-) |
B.将CH3COONa溶液从20℃升温至30℃,溶液中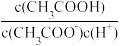 增大 增大 |
C.向0.1mol/LCH3COOH溶液中加入少量纯CH3COOH,溶液 减小 减小 |
| D.向醋酸钠溶液中加入适量醋酸后,混合溶液中离子浓度大小可能为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
您最近一年使用:0次
9 . 某 样品露置在空气中部分变质生成
样品露置在空气中部分变质生成 ,为确定其中
,为确定其中 和
和 的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸
的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸 ,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
(1)样品中物质的量之比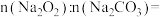
___________ 。
(2)盐酸的物质的量浓度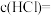
___________ 。
 样品露置在空气中部分变质生成
样品露置在空气中部分变质生成 ,为确定其中
,为确定其中 和
和 的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸
的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸 ,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积/mL | 100.0 | 100.0 | 100.0 | 100.0 |
| 样品质量/g | 2.62 | 3.93 | 5.24 | 6.55 |
| 气体总体积/mL | 448 | 560 | 448 | 560 |
(1)样品中物质的量之比
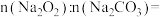
(2)盐酸的物质的量浓度
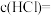
您最近一年使用:0次
10 . Ⅰ.橡胶在工农业及国防领域中具有重要的作用。世界橡胶产量中,天然橡胶仅占15%左右。随着石油化学工业的发展,提纯得到许多制橡胶的原料,从而制得品种多、性能好的合成橡胶。
(1)天然橡胶可看成异戊二烯(2-甲基-1,3-丁二烯)的聚合产物。若异戊二烯与氯气以等物质的量发生加成反应,所得产物有___________种。
(2)P是否存在顺反异构___________ (选A“是”B“否”)。
(3)P发生1,4-加聚反应得到___________ (填结构简式),将该产物加入溴的四氯化碳中,现象是___________ 。
(4)写出P与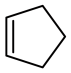 发生Diels-Alder反应的化学方程式
发生Diels-Alder反应的化学方程式___________ 。
(5)P与酸性 溶液反应生成的有机产物为
溶液反应生成的有机产物为___________ (填结构简式)。
(6)三元乙丙橡胶的一种单体M的键线式如图,下列它的说法错误的是___________。
(7)丁苯橡胶是合成橡胶的一种,其结构简式为,写出合成丁苯橡胶的单体的结构简式:___________ 。
①环丙烷 ②乙炔 ③丁二烯 ④甲苯
(9)某烃与氢气发生反应后能生成 ,则该烃不可能是_______。
,则该烃不可能是_______。
(10)立方烷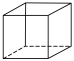 的一氯代物有
的一氯代物有___________ 种,它的六氯代物有___________ 种。
A.1 B.2 C.3 D.4
(1)天然橡胶可看成异戊二烯(2-甲基-1,3-丁二烯)的聚合产物。若异戊二烯与氯气以等物质的量发生加成反应,所得产物有___________种。
| A.1种 | B.2种 | C.3种 | D.4种 |
Ⅱ.有机物P( ),常用于合成橡胶。
),常用于合成橡胶。
已知:①Diels-Alder反应: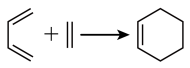 ;
;
②
(2)P是否存在顺反异构
(3)P发生1,4-加聚反应得到
(4)写出P与
 发生Diels-Alder反应的化学方程式
发生Diels-Alder反应的化学方程式(5)P与酸性
 溶液反应生成的有机产物为
溶液反应生成的有机产物为(6)三元乙丙橡胶的一种单体M的键线式如图,下列它的说法错误的是___________。
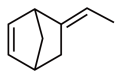
A.在催化剂作用下,1molM最多可以消耗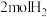 |
B.能使酸性 溶液褪色 溶液褪色 |
C.不能使溴的 溶液褪色 溶液褪色 |
| D.M中的碳原子可能在同一平面 |
(7)丁苯橡胶是合成橡胶的一种,其结构简式为,写出合成丁苯橡胶的单体的结构简式:
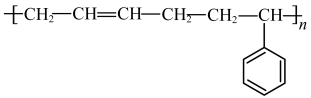
①环丙烷 ②乙炔 ③丁二烯 ④甲苯
| A.①③④② | B.④③①② | C.①②④③ | D.④②③① |
(9)某烃与氢气发生反应后能生成
 ,则该烃不可能是_______。
,则该烃不可能是_______。| A.2-甲基-2-丁烯 | B.3-甲基-1-丁烯 | C.2-甲基-1-丁烯 | D.2,3-二甲基-1-丁烯 |
(10)立方烷
 的一氯代物有
的一氯代物有A.1 B.2 C.3 D.4
您最近一年使用:0次



