名校
1 . 关于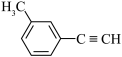 的说法正确的是
的说法正确的是
| A.分子中有6个原子共线 | B.分子中共平面的原子数目最多为14 |
| C.分子中的苯环由单双键交替组成 | D.该有机物的一氯代物有两种 |
您最近一年使用:0次
2 . 现有如图所示的转化关系,已知:A为高级脂肪酸甘油酯。回答下列问题:___________ ,D的结构简式为___________ 。
(2)①的化学方程式为________________ ;③的反应类型为________ 反应。
(3)完全燃烧等物质的量的B和某烷烃消耗等量的氧气,则该烷烃的名称为___________ 。
(4)m g某天然油脂完全水解需要18gNaOH,则m g该油脂的物质的量为___________ mol。
(5)一定量的CH3COOH和O2混合后完全反应生成CO2、CO和H2O(g)。产物分别经过浓硫酸和碱石灰,浓硫酸增重10.8g,碱石灰增重13.2g。则n(CH3COOH)︰n(O2)=___________ 。

(2)①的化学方程式为
(3)完全燃烧等物质的量的B和某烷烃消耗等量的氧气,则该烷烃的名称为
(4)m g某天然油脂完全水解需要18gNaOH,则m g该油脂的物质的量为
(5)一定量的CH3COOH和O2混合后完全反应生成CO2、CO和H2O(g)。产物分别经过浓硫酸和碱石灰,浓硫酸增重10.8g,碱石灰增重13.2g。则n(CH3COOH)︰n(O2)=
您最近一年使用:0次
名校
解题方法
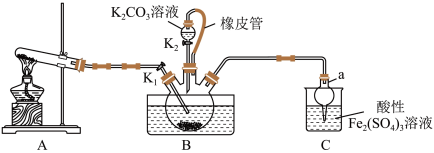
3 . 硫氰化钾(KSCN)是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图实验装置模拟工业制备 KSCN 并进行相关探究实验。___________ 。
(2)装置A用于实验室制备氨气,反应的化学方程式为___________ 。
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是___________ (写两点)。
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至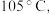 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是___________ 。
(5)尾气处理:装置C 中仪器a的名称是___________ ,酸性Fe₂(SO₄)₃溶液用于除去尾气中两种污染性气体,其中一种气体M能使酚酞溶液变红,另一种气体N能使溶液产生淡黄色沉淀,写出除去气体N的离子方程式___________ 。
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知 (白色)]:
(白色)]:___________ [可供选择的试剂: 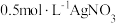 溶液、
溶液、 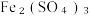 溶液、
溶液、 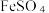 溶液、
溶液、  溶液]。
溶液]。

(2)装置A用于实验室制备氨气,反应的化学方程式为
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至
 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是(5)尾气处理:装置C 中仪器a的名称是
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知
 (白色)]:
(白色)]: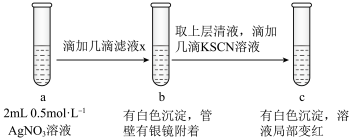
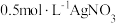 溶液、
溶液、 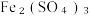 溶液、
溶液、 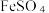 溶液、
溶液、  溶液]。
溶液]。
您最近一年使用:0次
名校
4 . 下列选项中除杂试剂或操作正确的是
选项 | 物质(杂质) | 除杂试剂或操作 |
A | 甲烷(丙烯) | 酸性高锰酸钾溶液 |
B | 乙酸乙酯(乙醇) | 浓硫酸、乙酸、加热 |
C | 二氧化硫(乙烯) | 溴水 |
D | 蛋白质溶液(NaCl) | 渗析 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-20更新
|
911次组卷
|
3卷引用:江西省南昌十九中2021-2022学年高一下学期第三次月考化学试卷
名校
5 . 几种短周期元素的原子半径及主要化合价如下表所示,下列叙述正确的是
元素代号 | X | Y | Z | W | Q |
原子半径/pm | 130 | 118 | 75 | 73 | 102 |
主要化合价 | +2 | +3 | +5、-3 | -2 | +6、-2 |
| A.简单离子半径:X<Y |
B.一定条件下,Z单质与W的常见单质直接生成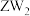 |
| C.W的简单氢化物比Q的更稳定,是因为W的简单氢化物中含有氢键 |
| D.最高价氧化物对应的水化物的碱性:X>Y |
您最近一年使用:0次
名校
6 . 直接排放含 的烟气会形成酸雨,危害环境。某化学实验小组进行如下有关
的烟气会形成酸雨,危害环境。某化学实验小组进行如下有关 性质的探究活动。
性质的探究活动。
(1)写出证明 弱氧化性的化学方程式
弱氧化性的化学方程式________ 。
(2)写出下图装置A中滴加盐酸仪器的名称:________ 。
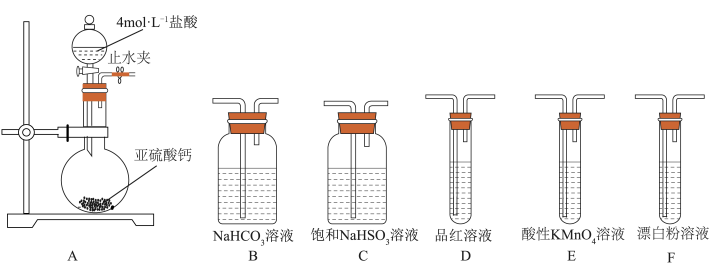
①甲同学认为按照A→C→F顺序连接装置可以比较亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是________ 。
②丙同学设计的合理实验方案为A→________ →尾气处理(填字母)。其中装置C的作用是________ 。证明亚硫酸酸性强于次氯酸的实验现象是________ 。
(4)利用下图的装置可测定装置A残液中 的含量。量取1.00mL残液于烧瓶中,加适量蒸馏水稀释,加热使
的含量。量取1.00mL残液于烧瓶中,加适量蒸馏水稀释,加热使 全部逸出并与锥形瓶中的
全部逸出并与锥形瓶中的 溶液恰好完全反应,然后用浓度为
溶液恰好完全反应,然后用浓度为 溶液测定锥形瓶中生成的酸的含量,消耗NaOH溶液的体积为20.00mL。
溶液测定锥形瓶中生成的酸的含量,消耗NaOH溶液的体积为20.00mL。
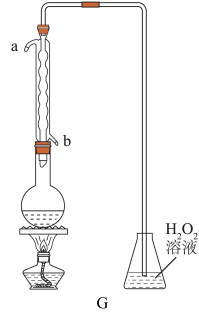
残液中 的含量为
的含量为________  。
。
 的烟气会形成酸雨,危害环境。某化学实验小组进行如下有关
的烟气会形成酸雨,危害环境。某化学实验小组进行如下有关 性质的探究活动。
性质的探究活动。(1)写出证明
 弱氧化性的化学方程式
弱氧化性的化学方程式(2)写出下图装置A中滴加盐酸仪器的名称:
①甲同学认为按照A→C→F顺序连接装置可以比较亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是
②丙同学设计的合理实验方案为A→
(4)利用下图的装置可测定装置A残液中
 的含量。量取1.00mL残液于烧瓶中,加适量蒸馏水稀释,加热使
的含量。量取1.00mL残液于烧瓶中,加适量蒸馏水稀释,加热使 全部逸出并与锥形瓶中的
全部逸出并与锥形瓶中的 溶液恰好完全反应,然后用浓度为
溶液恰好完全反应,然后用浓度为 溶液测定锥形瓶中生成的酸的含量,消耗NaOH溶液的体积为20.00mL。
溶液测定锥形瓶中生成的酸的含量,消耗NaOH溶液的体积为20.00mL。
残液中
 的含量为
的含量为 。
。
您最近一年使用:0次
2024-03-14更新
|
230次组卷
|
2卷引用:广东省深圳市高级中学2021-2022学年高一下学期期中考试化学试卷
名校
解题方法
7 . I.已知:金属钠和空气可以制备纯度较高的 ,反应原理是:
,反应原理是: ,并且
,并且 易与空气中
易与空气中 、水蒸气反应。现用金属钠和空气制备纯度较高的
、水蒸气反应。现用金属钠和空气制备纯度较高的 ,可利用的装置如图所示。回答下列问题:
,可利用的装置如图所示。回答下列问题:
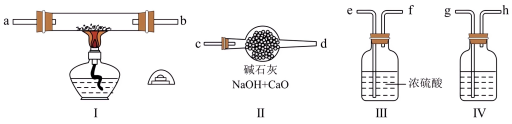
(1)装置Ⅳ中盛放的试剂是_______ ,其作用是_________ 。
(2)若规定气体的气流方向从左到右,则组合实验装置时各接口的连接顺序为:______ →d。
(3)装置Ⅱ的作用是___________ 。
(4)操作中通空气和加热的先后顺序为___________ 。
Ⅱ.为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。
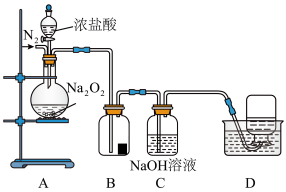
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接装置A、B、C。
②缓慢通入一定量的 后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,装置A中剧烈反应,有气体产生。
后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,装置A中剧烈反应,有气体产生。
③待装置D中导管口产生连续气泡后,将导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭活塞,再通一段时间N₂,直至装置中气体变为无色。
回答下列问题:
(5)装置A中盛装浓盐酸的仪器名称是______ 。
(6)实验中观察到B中湿润的红色纸条褪色,说明在浓盐酸和 的反应中有
的反应中有______ (填化学式)生成。
(7)实验中,在D的集气瓶中收集到能使带火星木条复燃的无色气体,有同学认为该气体是 被浓盐酸还原所得,从氧化还原角度分析该推断是否合理并说明理由?
被浓盐酸还原所得,从氧化还原角度分析该推断是否合理并说明理由?___________ 。
(8)还有同学认为D的集气瓶中收集到的气体是 与浓盐酸中的水反应得到。通过实验证实
与浓盐酸中的水反应得到。通过实验证实 与干燥的
与干燥的 能反应,请完成并配平该化学方程式:
能反应,请完成并配平该化学方程式:________ ,___ +____
+____
 ____
____ +____
+____ +_____。当有0.1mol电子发生转移时,生成的
+_____。当有0.1mol电子发生转移时,生成的 在标况下的体积为
在标况下的体积为______ 。
 ,反应原理是:
,反应原理是: ,并且
,并且 易与空气中
易与空气中 、水蒸气反应。现用金属钠和空气制备纯度较高的
、水蒸气反应。现用金属钠和空气制备纯度较高的 ,可利用的装置如图所示。回答下列问题:
,可利用的装置如图所示。回答下列问题:
(1)装置Ⅳ中盛放的试剂是
(2)若规定气体的气流方向从左到右,则组合实验装置时各接口的连接顺序为:
(3)装置Ⅱ的作用是
(4)操作中通空气和加热的先后顺序为
Ⅱ.为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接装置A、B、C。
②缓慢通入一定量的
 后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,装置A中剧烈反应,有气体产生。
后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,装置A中剧烈反应,有气体产生。③待装置D中导管口产生连续气泡后,将导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭活塞,再通一段时间N₂,直至装置中气体变为无色。
回答下列问题:
(5)装置A中盛装浓盐酸的仪器名称是
(6)实验中观察到B中湿润的红色纸条褪色,说明在浓盐酸和
 的反应中有
的反应中有(7)实验中,在D的集气瓶中收集到能使带火星木条复燃的无色气体,有同学认为该气体是
 被浓盐酸还原所得,从氧化还原角度分析该推断是否合理并说明理由?
被浓盐酸还原所得,从氧化还原角度分析该推断是否合理并说明理由?(8)还有同学认为D的集气瓶中收集到的气体是
 与浓盐酸中的水反应得到。通过实验证实
与浓盐酸中的水反应得到。通过实验证实 与干燥的
与干燥的 能反应,请完成并配平该化学方程式:
能反应,请完成并配平该化学方程式: +____
+____
 ____
____ +____
+____ +_____。当有0.1mol电子发生转移时,生成的
+_____。当有0.1mol电子发生转移时,生成的 在标况下的体积为
在标况下的体积为
您最近一年使用:0次
名校
8 . 某有机物X(分子组成可表示为CxHyOz)是生物体的一种代谢产物,在不同的生命体中发挥不同的功能。现对X进行相关实验:
①取纯净的X固体9.0g(不含结晶水),控制在125℃~150℃缓慢加热,将其完全转化为蒸气,所得X气体所占体积为2.24L(已折算成标准状况);
②取纯净的X固体18.0g(不含结晶水),迅速加热到190℃以上,使其完全分解,得到三种气体产物;
③将分解产物依次通过足量浓硫酸和无水硫酸铜固体,浓硫酸增重3.6g,无水硫酸铜不显蓝色;
④将剩余的气体8.96L(已折算成标准状况)通过足量澄清石灰水,有白色沉淀生成,最后剩余的气体在装置末端可以被点燃;
⑤被点燃的尾气产生蓝色火焰,用干冷的烧杯罩在火焰上方没有水雾产生,用涂有澄清石灰水的烧杯罩在火焰上方有浑浊。
回答下列问题:
(1)有机物X的摩尔质量为___________ ;X分解产物的化学式为___________ 。
(2)通过计算推导出X的分子式(写出计算过程)___________ 。
(3)取0.5g含有杂质的X固体,溶于水配成25.00mL溶液,取所配溶液于锥形瓶中,加入少量硫酸酸化,用KMnO4溶液滴定至X恰好全部氧化成二氧化碳,共消耗0.002mol 的KMnO4.(MnO 转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为___________ 。
①取纯净的X固体9.0g(不含结晶水),控制在125℃~150℃缓慢加热,将其完全转化为蒸气,所得X气体所占体积为2.24L(已折算成标准状况);
②取纯净的X固体18.0g(不含结晶水),迅速加热到190℃以上,使其完全分解,得到三种气体产物;
③将分解产物依次通过足量浓硫酸和无水硫酸铜固体,浓硫酸增重3.6g,无水硫酸铜不显蓝色;
④将剩余的气体8.96L(已折算成标准状况)通过足量澄清石灰水,有白色沉淀生成,最后剩余的气体在装置末端可以被点燃;
⑤被点燃的尾气产生蓝色火焰,用干冷的烧杯罩在火焰上方没有水雾产生,用涂有澄清石灰水的烧杯罩在火焰上方有浑浊。
回答下列问题:
(1)有机物X的摩尔质量为
(2)通过计算推导出X的分子式(写出计算过程)
(3)取0.5g含有杂质的X固体,溶于水配成25.00mL溶液,取所配溶液于锥形瓶中,加入少量硫酸酸化,用KMnO4溶液滴定至X恰好全部氧化成二氧化碳,共消耗0.002mol 的KMnO4.(MnO
 转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
转化为Mn2+,不考虑X中杂质反应)。请计算X的纯度为
您最近一年使用:0次
2024-02-24更新
|
148次组卷
|
2卷引用:江苏省无锡市第一中学2022-2023学年高一上学期阶段性质量检测化学试题
9 . 回答下列问题。
I.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O。
(1)反应中___________ 元素被氧化,___________ (填化学式)是氧化剂。
(2)用单线桥标出电子转移方向和数目___________ 。
(3)反应产物中,所得氧化产物与还原产物微粒个数之比为___________ 。
Ⅱ.有一种“地康法”制取氯气的反应原理如图所示:
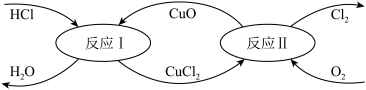
(4)反应Ⅱ的化学方程式为___________ 。
(5)在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式___________ 。
(6)ClO2是一种黄绿色的气体。铬(Cr)的一种固体氧化物Cr2O3与KClO3固体在高温条件下反应,只生成ClO2、Cl2和铬酸钾(K2CrO4)固体三种产物。若该反应中转移24mol电子,生成气体共___________ mol。
I.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O。
(1)反应中
(2)用单线桥标出电子转移方向和数目
(3)反应产物中,所得氧化产物与还原产物微粒个数之比为
Ⅱ.有一种“地康法”制取氯气的反应原理如图所示:

(4)反应Ⅱ的化学方程式为
(5)在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式
(6)ClO2是一种黄绿色的气体。铬(Cr)的一种固体氧化物Cr2O3与KClO3固体在高温条件下反应,只生成ClO2、Cl2和铬酸钾(K2CrO4)固体三种产物。若该反应中转移24mol电子,生成气体共
您最近一年使用:0次
名校
10 . 黄铁矿的主要成分是FeS2 (Fe为 价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO
价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO +16H+。下列说法中正确的是
+16H+。下列说法中正确的是
 价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO
价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO +16H+。下列说法中正确的是
+16H+。下列说法中正确的是| A.反应中氧化产物和还原产物的物质的量之比为2∶15 |
| B.FeS2是反应中的氧化剂,发生还原反应 |
C.由反应可知氧化性:SO >Fe3+ >Fe3+ |
D.每生成1mol SO ,反应中转移的电子是7mol ,反应中转移的电子是7mol |
您最近一年使用:0次
2024-02-24更新
|
285次组卷
|
3卷引用:江苏省无锡市第一中学2022-2023学年高一上学期阶段性质量检测化学试题



