解题方法
1 . 甘氨酸亚铁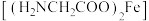 是一种补血剂,工业上用赤铁矿
是一种补血剂,工业上用赤铁矿 (含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:

已知:甘氨酸(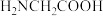 ),易溶于水,微溶于乙醇,具有两性。滤渣1成份为
),易溶于水,微溶于乙醇,具有两性。滤渣1成份为 。
。
回答下列问题:
(1)“碱浸”去除的元素是___________ 。(填化学式)
(2)“还原”时的还原产物是___________ 。(填化学式)
(3)“沉淀”的离子方程式___________ ,“副产品”是___________ (写名称)
(4)柠檬酸的作用防止 氧化,“反应”的化学方程式为
氧化,“反应”的化学方程式为___________ 。
(5) 是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是
是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是______ 。
(6)某同学通过如下实验测定该补血剂中 的含量:
的含量:
①配制:用分析天平称取
 样品,再用煮沸并冷却的蒸馏水配制
样品,再用煮沸并冷却的蒸馏水配制 溶液。配制时还需要的定量仪器是
溶液。配制时还需要的定量仪器是___________ 。
②滴定:用酸化的 溶液滴定用
溶液滴定用
移液管移取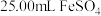 溶液于锥形瓶中,用
溶液于锥形瓶中,用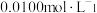 的
的 ,溶液滴定,平行滴定3次,
,溶液滴定,平行滴定3次, 溶液的平均用量为
溶液的平均用量为 ,则样品
,则样品 的质量分数为
的质量分数为___________ 。
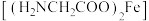 是一种补血剂,工业上用赤铁矿
是一种补血剂,工业上用赤铁矿 (含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:
已知:甘氨酸(
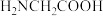 ),易溶于水,微溶于乙醇,具有两性。滤渣1成份为
),易溶于水,微溶于乙醇,具有两性。滤渣1成份为 。
。回答下列问题:
(1)“碱浸”去除的元素是
(2)“还原”时的还原产物是
(3)“沉淀”的离子方程式
(4)柠檬酸的作用防止
 氧化,“反应”的化学方程式为
氧化,“反应”的化学方程式为(5)
 是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是
是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是(6)某同学通过如下实验测定该补血剂中
 的含量:
的含量:①配制:用分析天平称取

 样品,再用煮沸并冷却的蒸馏水配制
样品,再用煮沸并冷却的蒸馏水配制 溶液。配制时还需要的定量仪器是
溶液。配制时还需要的定量仪器是②滴定:用酸化的
 溶液滴定用
溶液滴定用移液管移取
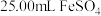 溶液于锥形瓶中,用
溶液于锥形瓶中,用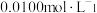 的
的 ,溶液滴定,平行滴定3次,
,溶液滴定,平行滴定3次, 溶液的平均用量为
溶液的平均用量为 ,则样品
,则样品 的质量分数为
的质量分数为
您最近一年使用:0次
2 . 实验室有一瓶密封不严的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol·L-1HCl、品红溶液、新制澄清石灰水。
(1)[提出假设]假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含___ ;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3。
(2)[进行实验]在答题卡上完成下表(不必检验Ca2+、Cl-):
(1)[提出假设]假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3。
(2)[进行实验]在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论 | |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管 | 若无气体放出且澄清石灰水未见浑浊,则假设一成立, |
| ② | ||
| ③ | ||
您最近一年使用:0次
2013·山东滨州·一模
解题方法
3 . (1)某学习小组利用下图装置制取氯气并探究其性质。
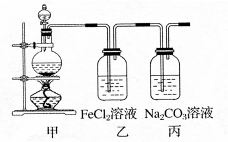
①甲装置中反应的化学方程式是_____________________________________ ;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)__________________________________________________________ ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是____________________________________ 。
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含________________ ;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):

①甲装置中反应的化学方程式是
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论 | |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管 | 若无气体放出且澄清石灰水未见浑浊,则假设一成立; |
| ② | ||
您最近一年使用:0次
名校
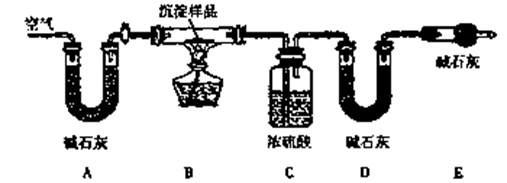
4 . I. 氢化钙固体登山运动员常用的能源提供剂.某兴趣小组长拟选用如下装置制备氢化钙.

请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为__________ (填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞_________ (请按正确的顺序填入下列步骤的标号).
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭分液漏斗活塞 D.停止加热,充分冷却
(3)已知钙与氢化钙固体在外观上相似,现设计一个实验,用化学方法区分钙与氢化钙,请完善以下实验的简要步骤及观察到的现象:取适量氢化钙,在加热条件下与_________ 反应,将反应气相产物通过装有_______ 的容器,观察到容器内固体颜色变化为__________ ;取钙做类似实验,观察不到类似的反应现象.
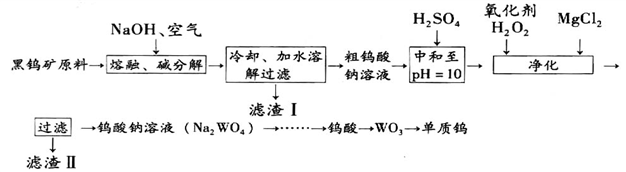
II.某化学兴趣小组发现,往CuSO4溶液中加入一定浓度的Na2CO3溶液得到的蓝色沉淀,若加入NaOH溶液则得到浅绿色沉淀。为此,小组同学对蓝色沉淀成份作了如下探究:
该小组同学利用下列装置通过实验测定其组成
(1)检查装置气密性并装好药品后,点燃酒精灯前应进行的操作是______________ 。
(2)若沉淀样品的质量为mg。装置C质量增加了ng,则沉淀中CuCO3的质量分数为_____________ 。
(3)通过查找资料得知,该浅绿色沉淀物可能是溶解度最小的碱式硫酸铜【化学式CuSO4·3Cu(OH)2】。请你设计一个实验,证明浊液中的浅绿色沉淀物中是否含有硫酸根离子的方法__________________________________ 。

请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭分液漏斗活塞 D.停止加热,充分冷却
(3)已知钙与氢化钙固体在外观上相似,现设计一个实验,用化学方法区分钙与氢化钙,请完善以下实验的简要步骤及观察到的现象:取适量氢化钙,在加热条件下与

II.某化学兴趣小组发现,往CuSO4溶液中加入一定浓度的Na2CO3溶液得到的蓝色沉淀,若加入NaOH溶液则得到浅绿色沉淀。为此,小组同学对蓝色沉淀成份作了如下探究:
该小组同学利用下列装置通过实验测定其组成
(1)检查装置气密性并装好药品后,点燃酒精灯前应进行的操作是
(2)若沉淀样品的质量为mg。装置C质量增加了ng,则沉淀中CuCO3的质量分数为
(3)通过查找资料得知,该浅绿色沉淀物可能是溶解度最小的碱式硫酸铜【化学式CuSO4·3Cu(OH)2】。请你设计一个实验,证明浊液中的浅绿色沉淀物中是否含有硫酸根离子的方法

您最近一年使用:0次
5 . 硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 。
(2)将1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是 。
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2
4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量各为多少?
(4)闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(计算保留2位小数)
取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是多少?
生产10吨98%的浓硫酸需要这种矿石多少吨?(反应过程中硫损失2%)
完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 。
(2)将1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是 。
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2
4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量各为多少?
(4)闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(计算保留2位小数)
取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是多少?
生产10吨98%的浓硫酸需要这种矿石多少吨?(反应过程中硫损失2%)
您最近一年使用:0次
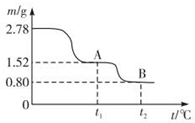
6 . 在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中煅烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
(1)绿矾油主要成份的化学式为_________ .t1~t2.发生反应的化学方程式为_________________ .
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为_________ .
(3)以下是FeSO4•7H2O的实验室制备流理图.
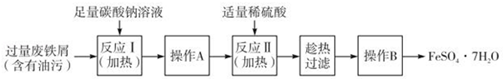
根据题意完成下列填空:
①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及____________ .
②操作A的名称为_____________ .
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为_______________ ,计算上述样品中FeSO4•7H2O的质量分数为_________ (保留两位有效数字).
(1)绿矾油主要成份的化学式为
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为
(3)以下是FeSO4•7H2O的实验室制备流理图.

根据题意完成下列填空:

①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及
②操作A的名称为
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为
您最近一年使用:0次
7 . 铁及其化合物与生活密切相关,古代炼丹家以绿矾(FeSO4·7H2O为原料,放在炼丹炉中煅烧可制得绿矾油。绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈。右图是2. 78 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g。


(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图

根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。


(1)绿矾油主要成份的化学式为 。t1~t2.发生反应的化学方程式为 。
(2)若将28.8 g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到14.4 g黑色细粉,则可推知该黑色细粉为 。
(3)以下是FeSO4·7H2O的实验室制备流理图

根据题意完成下列填空:
①反应II需要100 mL1. 5 mol·L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1. 84 g·cm -3的浓H2SO4配制。所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及 。
②操作A的名称为 。
③测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取6.0 g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.2000 mol·L -1KMnO4溶液滴定,消耗KMnO4溶液的体积为20. 00 mL。发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。
您最近一年使用:0次
名校
8 . A、B、C、D、E五种物质的焰色试验都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有可燃性,B与水反应放出的气体具有助燃性,同时都生成C的溶液,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D。
(1)写出A+H2O→C的化学方程式:___________ 。
(2)写出B+H2O→C的化学方程式:___________ 。
(3)写出E→D的化学方程式:___________ 。
(4)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式___________ ,___________ 。
(5)某实验室研究员将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为___________ (假设漂白粉中的其它成份不与硝酸反应)。
(6)将14gNa2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12L,所得溶液的体积为400mL。试计算:原混合物中Na2O的质量为___________ g,所得溶液的物质的量浓度为___________ mol·L-1。
(1)写出A+H2O→C的化学方程式:
(2)写出B+H2O→C的化学方程式:
(3)写出E→D的化学方程式:
(4)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式
(5)某实验室研究员将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为
(6)将14gNa2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12L,所得溶液的体积为400mL。试计算:原混合物中Na2O的质量为
您最近一年使用:0次
9 . 下列有关物质的检验方法和结论都正确的是
| A.检验还原铁粉是否变质,取样品溶于盐酸,滴加KSCN,溶液未变红,则铁粉也可能已变质 |
B.某溶液中加入 溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解,则该溶液中存在 溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解,则该溶液中存在 |
C.某溶液中加入稀NaOH溶液,没有产生使湿润红色试纸变蓝色的气体,则该溶液中不存在 |
D.铜与足量浓硫酸反应后冷却,在试管中加入少量水,若溶液变为蓝色,则产物中存在 |
您最近一年使用:0次
10 . 连二亚硫酸钠( )俗称保险粉,是一种白色晶体,常用作纺织工业的漂白剂、脱色剂等。已知
)俗称保险粉,是一种白色晶体,常用作纺织工业的漂白剂、脱色剂等。已知 易溶于水,不溶于乙醇,具有极强的还原性。某兴趣小组用下图所示装置制备连二亚硫酸钠(夹持及加热装置已略去)。回答下列问题。
易溶于水,不溶于乙醇,具有极强的还原性。某兴趣小组用下图所示装置制备连二亚硫酸钠(夹持及加热装置已略去)。回答下列问题。___________ 。
(2)仪器B中生成的气体通入D中,与甲酸钠和 反应,除生成
反应,除生成 外还产生了一种无毒气体,该反应的化学方程式为
外还产生了一种无毒气体,该反应的化学方程式为___________ 。
(3)按气流方向完成合理的连接顺序:___________ 。
a→___________→___________→___________→___________→f
(4)下列说法正确的是___________。
(5)称取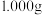 制得的
制得的 产品溶于冷水配成
产品溶于冷水配成 溶液,取出
溶液,取出 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用 碱性
碱性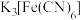 标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为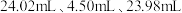 。
。
已知: 将
将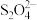 氧化为
氧化为 ,自身被还原为
,自身被还原为 。
。
①指示剂的条件电位要在滴定突跃电位之间,本实验滴定突跃范围为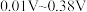 ,请根据下表所信息,选择合适指示剂,滴定终点的现象为
,请根据下表所信息,选择合适指示剂,滴定终点的现象为___________ 。
②样品中 的质量分数为
的质量分数为___________ %(杂质不参与反应,保留3位有效数字)。
 )俗称保险粉,是一种白色晶体,常用作纺织工业的漂白剂、脱色剂等。已知
)俗称保险粉,是一种白色晶体,常用作纺织工业的漂白剂、脱色剂等。已知 易溶于水,不溶于乙醇,具有极强的还原性。某兴趣小组用下图所示装置制备连二亚硫酸钠(夹持及加热装置已略去)。回答下列问题。
易溶于水,不溶于乙醇,具有极强的还原性。某兴趣小组用下图所示装置制备连二亚硫酸钠(夹持及加热装置已略去)。回答下列问题。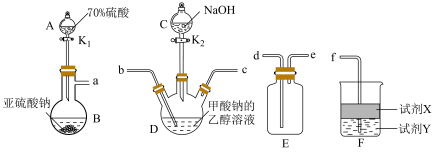
(2)仪器B中生成的气体通入D中,与甲酸钠和
 反应,除生成
反应,除生成 外还产生了一种无毒气体,该反应的化学方程式为
外还产生了一种无毒气体,该反应的化学方程式为(3)按气流方向完成合理的连接顺序:
a→___________→___________→___________→___________→f
(4)下列说法正确的是___________。
A.为减小杂质的生成,应打开 一段时间后再打开 一段时间后再打开 |
B.从D中混合产物分离出 晶体的操作是蒸发浓缩、冷却结晶、过滤 晶体的操作是蒸发浓缩、冷却结晶、过滤 |
| C.为防止产品变质,应选择低温烘干的干燥方式 |
D.仪器F中的试剂可以是:X为 溶液、Y为 溶液、Y为 ,目的是防止倒吸 ,目的是防止倒吸 |
(5)称取
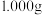 制得的
制得的 产品溶于冷水配成
产品溶于冷水配成 溶液,取出
溶液,取出 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用 碱性
碱性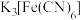 标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为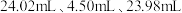 。
。已知:
 将
将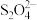 氧化为
氧化为 ,自身被还原为
,自身被还原为 。
。①指示剂的条件电位要在滴定突跃电位之间,本实验滴定突跃范围为
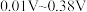 ,请根据下表所信息,选择合适指示剂,滴定终点的现象为
,请根据下表所信息,选择合适指示剂,滴定终点的现象为| 指示剂 | 条件电位(V) | 颜色变化 | |
| 氧化态 | 还原态 | ||
| 亚甲基蓝 | 0.36 | 蓝色 | 无色 |
| 二苯胺 | 0.76 | 紫色 | 无色 |
 的质量分数为
的质量分数为
您最近一年使用:0次



