名校
1 . A、B、C、D、E是核电荷数依次增大的5种短周期主族元素;原子半径按D、E、B、C、A顺序依次减小,B和E是同主族元素。
(1)下列推断正确的是________ 。
a A、B、E不可能在同一主族
b A、B、C可能在同一周期
c C的最高价氧化物的水化物可能显碱性
d C和D的单质可能生成离子化合物
(2)若A与D同主族,B属非金属元素,它的一种单质是电的良导体,C原子的最外层电子数比A与B的最外层电子数总和还多1。则①A与C元素按原子个数比1:1形成的化合物F的电子式为______ ;F属于__________ 分子(填“极性”或“非极性”)
②由A、B、C、D四元素按原子个数比1:1:3:1形成的化合物为_________ ,它与A、C、D形成的化合物在水溶液中反应的离子方程式为_______ ;
③E在周期表中的位置______ C和E形成的化合物属于_____ 晶体
④由A、B、C元素中的两种或三种可以组成多种分子,其中含有18个电子的分子是____ (填化学式)。
⑤B、C、E氢化物的沸点由高到低为__________ ,试说明原因 _____ 。
(1)下列推断正确的是
a A、B、E不可能在同一主族
b A、B、C可能在同一周期
c C的最高价氧化物的水化物可能显碱性
d C和D的单质可能生成离子化合物
(2)若A与D同主族,B属非金属元素,它的一种单质是电的良导体,C原子的最外层电子数比A与B的最外层电子数总和还多1。则①A与C元素按原子个数比1:1形成的化合物F的电子式为
②由A、B、C、D四元素按原子个数比1:1:3:1形成的化合物为
③E在周期表中的位置
④由A、B、C元素中的两种或三种可以组成多种分子,其中含有18个电子的分子是
⑤B、C、E氢化物的沸点由高到低为
您最近一年使用:0次
名校
解题方法
2 . 下列装置所示的实验中,能达到实验目的的是
A.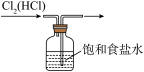 除去Cl2中的HCl杂质 除去Cl2中的HCl杂质 | B. 分离乙醇和乙酸 分离乙醇和乙酸 |
C. 检查装置气密性 检查装置气密性 | D. 实验室制取NH3 实验室制取NH3 |
您最近一年使用:0次
名校
解题方法
3 . 2005年10月12日,我国“神舟六号”载人飞船成功发射。航天飞船是用铝粉与高氯酸铵的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应: 2NH4ClO4 = N2↑+ 4H2O + Cl2 + 2O2↑;Δ H <0 下列对该反应的叙述中不正确的是 ( )
| A.高氯酸铵的水溶液呈中性 |
| B.每生成2 mol O2,反应中转移的电子数为14mol |
| C.该反应中Cl2是还原产物,N2和O2是氧化产物 |
| D.该反应是焓减,熵增的反应,能自发进行 |
您最近一年使用:0次
名校
解题方法
4 . 在某澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、S2-,在检验方案设计时初步分析其溶液中最多可含离子(只从这8种离子中选择)有( )
| A.4种 | B.5种 | C.6种 | D.7种 |
您最近一年使用:0次
名校
5 . 下列叙述正确的是
| A.发生化学反应时失去电子越多的金属原子,还原能力越强 |
| B.金属阳离子被还原后,一定得到该元素的单质 |
| C.核外电子总数相同的原子,一定是同种元素的原子 |
| D.需要加热才能发生的反应一定是吸热反应. |
您最近一年使用:0次
名校
6 . W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。回答下列问题:
(1)W、X对应的两种最高价氧化物的水化物可以反应生成盐和水,该反应的离子方程式为______________________________________________________ 。
(2)X的硝酸盐水溶液显______ 性,用离子方程式解释原因______________________ 。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为____________ 。
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是: > > > 。(填写离子符号)_____________
(5)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式:___________________________ 。
(1)W、X对应的两种最高价氧化物的水化物可以反应生成盐和水,该反应的离子方程式为
(2)X的硝酸盐水溶液显
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是: > > > 。(填写离子符号)
(5)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)。
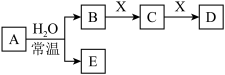
(1)若A是常温下的气态单质,X是Na2CO3,则D与A的水溶液反应的化学方程式为:_____________________________________ 。
(2)若E为难溶于水的白色沉淀,B与X的反应是中学化学中重要的化工反应:写出D与水反应所得的稀溶液与铜片反应的离子方程式________________________ 。
(3)若D为白色沉淀,且与A的摩尔质量相等,
(a)A的电子式__________ 。写出X与C反应生成D的离子方程式___________ 。
(b)将NaHCO3分解产生的气体用足量的A充分吸收得到固体混合物甲,将甲溶于VmLCmol·L- 的盐酸中,产生无色混合气体乙,溶液呈中性,则A的物质的量为__________ mol,混合气体乙的物质的量为___ mol。

(1)若A是常温下的气态单质,X是Na2CO3,则D与A的水溶液反应的化学方程式为:
(2)若E为难溶于水的白色沉淀,B与X的反应是中学化学中重要的化工反应:写出D与水反应所得的稀溶液与铜片反应的离子方程式
(3)若D为白色沉淀,且与A的摩尔质量相等,
(a)A的电子式
(b)将NaHCO3分解产生的气体用足量的A充分吸收得到固体混合物甲,将甲溶于VmLCmol·L- 的盐酸中,产生无色混合气体乙,溶液呈中性,则A的物质的量为
您最近一年使用:0次
名校
解题方法
8 . 某研究性学习小组查阅资料:“氯气与硫在加热条件下生成二氯化硫(S2Cl2),该物质遇水迅速反应,他们利用如下仪器和药品制取纯净的氯气与硫反应来制备S2Cl2

实验过程所提供的药品有:浓盐酸、浓H2SO4、MnO2、KMnO4(H+)、饱和NaHCO3溶液、碱石灰、硫磺、NaOH溶液、冰水、饱和食盐水。
回答下列问题:
(1)利用所提供的设备和药品,写出制备Cl2的离子方程式:________________
(2)在该实验过程中两次用到仪器B,第一次装置B中的药品是____________ ,第二次装置B的作用是____________________________________________________ 。
(3)能否省略装置C________ (填“能”或“否”),原因是_________________________________ 。
(4)实验开始后,当_______________________________________________ ,(填现象)点燃D处的酒精灯。
(5)某学生利用装置A制备一定量的Cl2,他收集到的Cl2的体积总比预期的要多,他经过认真分析后,认为应对装置A略作改进,你认为怎样改进:_____________________

实验过程所提供的药品有:浓盐酸、浓H2SO4、MnO2、KMnO4(H+)、饱和NaHCO3溶液、碱石灰、硫磺、NaOH溶液、冰水、饱和食盐水。
回答下列问题:
(1)利用所提供的设备和药品,写出制备Cl2的离子方程式:
(2)在该实验过程中两次用到仪器B,第一次装置B中的药品是
(3)能否省略装置C
(4)实验开始后,当
(5)某学生利用装置A制备一定量的Cl2,他收集到的Cl2的体积总比预期的要多,他经过认真分析后,认为应对装置A略作改进,你认为怎样改进:
您最近一年使用:0次
2020-03-06更新
|
361次组卷
|
2卷引用:山西省实验中学2020届高三化学复习针对性试题集(八)
名校
解题方法
9 . 2009年2月,日本产业技术综合研究所能源技术研究部门能源界面技术研究小组组长周豪慎和日本学术振兴会(JSPS)外籍特别研究员王永刚共同开发出了新构造的大容量锂空气电池。下列说法不正确的是


| A.放电时的正极反应为O2+2H2O+4e-→4OH- |
| B.充电时正极附近pH降低 |
| C.若用该电池作电源电解硫酸镁溶液,当电路中有0.02mol e-转移时,阴极增重0.24g |
| D.在该电池中,放电反应生成的不是固体的Li2O,而是容易溶解在水性电解液中的LiOH(氢氧化锂)。因此,氧化锂在空气电极堆积后,不会导致工作停止 |
您最近一年使用:0次
名校
解题方法
10 . 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示,下列说法正确的是
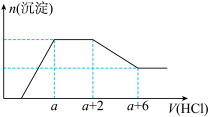

| A.原溶液中一定含有的阴离子是OH-、SiO32-、AlO2-、CO32- |
| B.反应最后形成的溶液中的溶质为NaCl |
| C.原溶液中一定含有Na2SO4 |
| D.原溶液中含有CO32-与AlO2-的物质的量之比为1:1 |
您最近一年使用:0次



