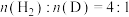名校
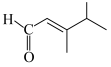
1 . “价—类”二维图是元素化合物学习的重要工具,部分含硫物质的分类与相应硫元素的化合价关系如图所示。下列说法不正确的是
| A.向a的溶液中通入c,出现黄色浑浊 | B.d是一种二元强酸 |
| C.能用e的浓溶液干燥c气体 | D.盐g与盐f之间也可能发生反应 |
您最近一年使用:0次
名校
2 . 化学在工农业生产和日常生活中都有重要应用。下列叙述正确的是
| A.“尿不湿”中的高吸水性树脂,其主要成分聚丙烯酸钠属于天然有机高分子 |
| B.2023年诺贝尔化学奖授予量子点研究,直径为2~20nm的硅量子点属于胶体 |
| C.“煤制烯烃大型现代煤化工成套技术开发及应用”中煤的气化属于物理变化 |
| D.“玉兔二号”月球车首次实现在月球背面着陆,其太阳能电池帆板的主要材料是硅 |
您最近一年使用:0次
名校
3 . 一种昆虫信息素的部分合成过程如下(加料顺序、部分反应条件略):___________ ,I比Ⅳ沸点更高的原因是___________ 。
(2)Ⅱ的同分异构体M不能与 发生加成反应,且核磁共振氢谱的峰面积比为1:1,写出M的结构简式
发生加成反应,且核磁共振氢谱的峰面积比为1:1,写出M的结构简式___________ 。
(3)根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。
(4)反应⑥中,Ⅶ与Y反应生成Ⅷ,原子利用率为100%,Y为___________ (填化学式)。
(5)关于反应③的说法正确的有___________(填字母)。
(6)以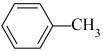 和
和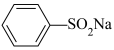 为主要原料,利用反应⑤和反应⑧的原理合成化合物Z。
为主要原料,利用反应⑤和反应⑧的原理合成化合物Z。___________ 和___________ (写结构简式)。
②从甲苯出发,第一步反应的化学方程式为___________ (注明反应条件)。
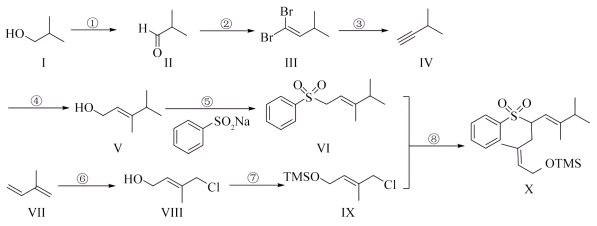
(2)Ⅱ的同分异构体M不能与
 发生加成反应,且核磁共振氢谱的峰面积比为1:1,写出M的结构简式
发生加成反应,且核磁共振氢谱的峰面积比为1:1,写出M的结构简式(3)根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。
| 序号 | 反应试剂、条件 | 反应形成的有机产物的结构简式 | 反应类型 |
| a |
| ||
| b | 催化剂,加热 | 加聚反应 |
(4)反应⑥中,Ⅶ与Y反应生成Ⅷ,原子利用率为100%,Y为
(5)关于反应③的说法正确的有___________(填字母)。
A.反应过程中,有 键和 键和 键的断裂 键的断裂 |
B.反应过程中,有 三键和 三键和 键的生成 键的生成 |
C.反应物Ⅲ中,C原子的杂化方式有 和 和 |
| D.产物Ⅳ中存在手性碳原子 |
(6)以
 和
和 为主要原料,利用反应⑤和反应⑧的原理合成化合物Z。
为主要原料,利用反应⑤和反应⑧的原理合成化合物Z。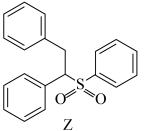
②从甲苯出发,第一步反应的化学方程式为
您最近一年使用:0次
名校
4 . 氨气是重要的化工原料,其制备与热力学研究在化工生产中十分重要。
(1)实验室用熟石灰和氯化铵为原料制备氨气,其化学方程式为___________ 。
(2)从制备到干燥、收集 并处理尾气所需装置的接口连接顺序是
并处理尾气所需装置的接口连接顺序是___________ 。 的焓变
的焓变 。
。
查阅资料:反应焓变可通过量热计对反应前后温度的变化测定,利用热量变化数值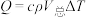 的原理,经换算得到反应的焓变,溶液中的反应可以近似认为
的原理,经换算得到反应的焓变,溶液中的反应可以近似认为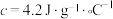 、
、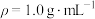 。
。
反应热的测定:取25.0℃下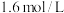 的氨水与
的氨水与 盐酸各
盐酸各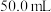 ,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。
,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。
①根据测定数据计算反应I的
___________  。
。
②参考上述流程用氢氧化钠与盐酸进行实验,测得反应II: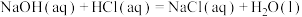 的焓变
的焓变 与
与 有一定差异,其原因是
有一定差异,其原因是___________ (从平衡移动角度作答)。
(4)甲同学欲借鉴(3)的方法测得反应III: 的焓变
的焓变 ,但发现气态反应过程中
,但发现气态反应过程中 、
、 变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:
变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:
①补全b的待测过程___________ 。
②计算反应III的
___________ (列式表示)。
(5)丙同学查阅资料发现,气态反应可通过测定不同温度下的平衡常数,利用以下原理换算得到焓变: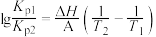
式中A为常数(已知),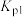 、
、 表示在
表示在 或
或 温度下反应的压强平衡常数。
温度下反应的压强平衡常数。
丙同学根据该原理设计了相关方案,测得了反应III的焓变,该方案是___________ (要求:方案中须写明待测的物理量,可选用仪器、药品:气压计、恒温反应器、温度计、 )。
)。
(1)实验室用熟石灰和氯化铵为原料制备氨气,其化学方程式为
(2)从制备到干燥、收集
 并处理尾气所需装置的接口连接顺序是
并处理尾气所需装置的接口连接顺序是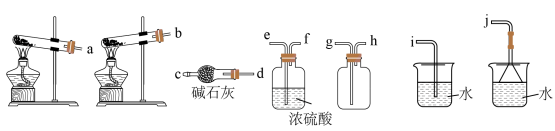
 的焓变
的焓变 。
。查阅资料:反应焓变可通过量热计对反应前后温度的变化测定,利用热量变化数值
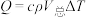 的原理,经换算得到反应的焓变,溶液中的反应可以近似认为
的原理,经换算得到反应的焓变,溶液中的反应可以近似认为 、
、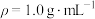 。
。反应热的测定:取25.0℃下
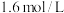 的氨水与
的氨水与 盐酸各
盐酸各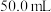 ,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。
,在量热计中混合搅拌,三次重复实验测得温度最高点的平均值为33.8℃。①根据测定数据计算反应I的

 。
。②参考上述流程用氢氧化钠与盐酸进行实验,测得反应II:
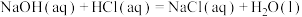 的焓变
的焓变 与
与 有一定差异,其原因是
有一定差异,其原因是(4)甲同学欲借鉴(3)的方法测得反应III:
 的焓变
的焓变 ,但发现气态反应过程中
,但发现气态反应过程中 、
、 变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:
变化大,难以测得准确数值。乙同学则提出在(3)所测数据的基础上,再测得3个过程的焓变即可。实验方案和结果如下:| 实验序号 | 待测过程 | 焓变 |
| a | 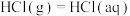 | 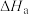 |
| b | 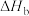 | |
| c |  | 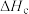 |
②计算反应III的

(5)丙同学查阅资料发现,气态反应可通过测定不同温度下的平衡常数,利用以下原理换算得到焓变:
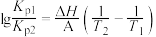
式中A为常数(已知),
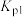 、
、 表示在
表示在 或
或 温度下反应的压强平衡常数。
温度下反应的压强平衡常数。丙同学根据该原理设计了相关方案,测得了反应III的焓变,该方案是
 )。
)。
您最近一年使用:0次
名校
5 .  石墨烯电极材料可在光照条件下产生电子(
石墨烯电极材料可在光照条件下产生电子( )和空穴(
)和空穴( ),其制氧效果优越。原理如下图所示。下列叙述正确的是
),其制氧效果优越。原理如下图所示。下列叙述正确的是
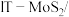 石墨烯电极材料可在光照条件下产生电子(
石墨烯电极材料可在光照条件下产生电子( )和空穴(
)和空穴(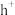 ),其制氧效果优越。原理如下图所示。下列叙述正确的是
),其制氧效果优越。原理如下图所示。下列叙述正确的是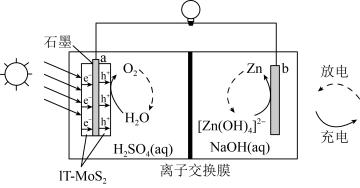
| A.放电时电势高低:a<b |
| B.放电时,电子流向:b→离子交换膜→a |
| C.充电效率与光照产生的电子和空穴量有关 |
D.放电时存在反应: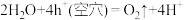 |
您最近一年使用:0次
2024-06-12更新
|
227次组卷
|
2卷引用:2024届广东省顺德区普通高中高三下学期适应性考试 化学试题
解题方法
6 . 亚磷酸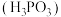 常温下电离平衡常数
常温下电离平衡常数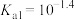 ,
, 。常温下,向
。常温下,向
 溶液中滴加
溶液中滴加 盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位
盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位 和溶液
和溶液 随盐酸体积变化曲线如下图所示。下列说法正确的是
随盐酸体积变化曲线如下图所示。下列说法正确的是
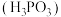 常温下电离平衡常数
常温下电离平衡常数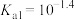 ,
, 。常温下,向
。常温下,向
 溶液中滴加
溶液中滴加 盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位
盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位 和溶液
和溶液 随盐酸体积变化曲线如下图所示。下列说法正确的是
随盐酸体积变化曲线如下图所示。下列说法正确的是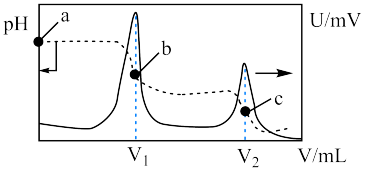
| A.滴定过程需要加入酚酞做指示剂 |
B.水的电离程度: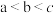 |
C. 点对应的溶液中: 点对应的溶液中: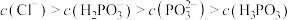 |
D. 点溶液中存在 点溶液中存在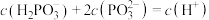 |
您最近一年使用:0次
名校
解题方法
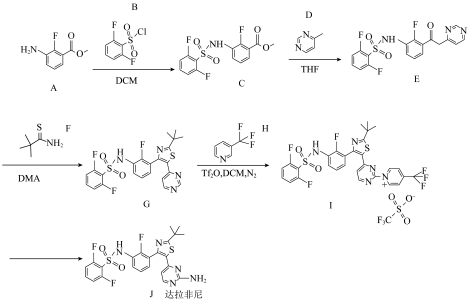
7 . 近几年达拉非尼在肿瘤适应症的拓展应用方面取得了较大的进展,达拉非尼的合成路线如下。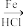 -NH2
-NH2
回答下列问题:
(1)反应物A中官能团名称为___________ 。
(2)写出化合物H与足量氢氧化钠溶液反应的化学方程式___________ 。
(3)C→E的反应类型为___________ ,列举一种该反应中除了E以外的有机产物在生活或生产上的应用___________ 。
(4)M为D的同系物,且比D多一个碳,符合下列条件的M的同分异构体有___________ 种。___________ 。
(5)有关G→达拉非尼路线中,下列说法正确的是___________。
(6)以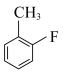 为原料合成化合物
为原料合成化合物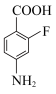 (无机试剂任选),基于你设计的合成路线,回答下列问题:
(无机试剂任选),基于你设计的合成路线,回答下列问题:
①第二步为氧化反应,其有机产物的结构简式为:___________ 。
②相关步骤涉及取代反应,其化学方程式为:___________ 。
已知:①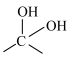 不稳定,易脱水生成
不稳定,易脱水生成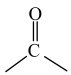
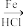 -NH2
-NH2回答下列问题:
(1)反应物A中官能团名称为
(2)写出化合物H与足量氢氧化钠溶液反应的化学方程式
(3)C→E的反应类型为
(4)M为D的同系物,且比D多一个碳,符合下列条件的M的同分异构体有
①含苯环②只有一种官能团③不含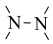 结构
结构
(5)有关G→达拉非尼路线中,下列说法正确的是___________。
| A.G→I是为后续引入氨基做准备 |
| B.达拉非尼分子中所有碳原子杂化方式相同 |
| C.达拉非尼分子核磁共振氢谱有11组峰 |
| D.化合物G可发生加成反应、氧化反应 |
(6)以
 为原料合成化合物
为原料合成化合物 (无机试剂任选),基于你设计的合成路线,回答下列问题:
(无机试剂任选),基于你设计的合成路线,回答下列问题:①第二步为氧化反应,其有机产物的结构简式为:
②相关步骤涉及取代反应,其化学方程式为:
您最近一年使用:0次
解题方法
8 . 砷的化合物可用于半导体领域。一种从酸性高浓度含砷废水[砷主要以亚砷酸(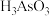 )形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
)形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
Ⅰ. ;
;
Ⅱ.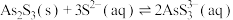 ;
;
Ⅲ.砷酸( )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 等还原;
等还原;
Ⅳ.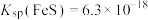 ,
, 。
。
回答下列问题;
(1)“沉砷”时,亚砷酸转化为 的化学方程式为
的化学方程式为_____________________________ 。
(2)“沉砷”时产生的废气可用______________ 溶液吸收处理(填化学式)。
(3)“NaOH溶液浸取”后,所得“滤渣”的主要成分是_________ (填化学式);此时溶液中存在平衡: ,该反应的平衡常数K=
,该反应的平衡常数K=_____________ (保留2位小数)。
(4)向滤液Ⅱ中通入氧气进行“氧化脱硫”,反应的离子方程式为_____________________ 。
(5)“沉砷”过程中FeS不可用过量的 替换,原因是
替换,原因是 ______________________________ (从平衡移动的角度解释)。
(6)该流程最后一步用 “还原”砷酸,发生反应的化学方程式为
“还原”砷酸,发生反应的化学方程式为____________________ 。
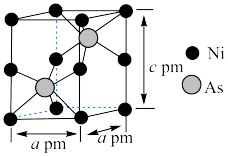
(7)某含砷化合物晶体的晶胞如图所示,As原子位于紧邻Ni原子构成的正三棱柱的体心。晶胞参数为a pm、a pm、c pm,则该晶体的密度为_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
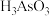 )形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
)形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下: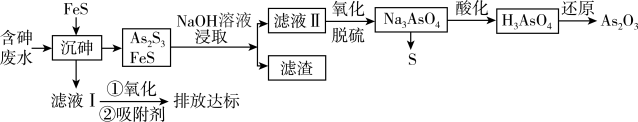
Ⅰ.
 ;
;Ⅱ.
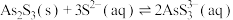 ;
;Ⅲ.砷酸(
 )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 等还原;
等还原;Ⅳ.
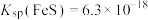 ,
, 。
。回答下列问题;
(1)“沉砷”时,亚砷酸转化为
 的化学方程式为
的化学方程式为(2)“沉砷”时产生的废气可用
(3)“NaOH溶液浸取”后,所得“滤渣”的主要成分是
 ,该反应的平衡常数K=
,该反应的平衡常数K=(4)向滤液Ⅱ中通入氧气进行“氧化脱硫”,反应的离子方程式为
(5)“沉砷”过程中FeS不可用过量的
 替换,原因是
替换,原因是 (6)该流程最后一步用
 “还原”砷酸,发生反应的化学方程式为
“还原”砷酸,发生反应的化学方程式为(7)某含砷化合物晶体的晶胞如图所示,As原子位于紧邻Ni原子构成的正三棱柱的体心。晶胞参数为a pm、a pm、c pm,则该晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
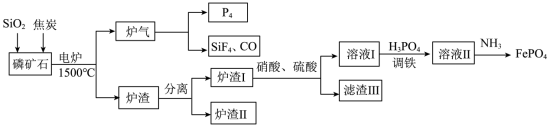
9 . “刀片电池”通过结构创新,大大提升了磷酸铁锂电池的能量密度。以下是以磷矿石(主要成分Ca5(PO4)3F,还有Fe2O3、CaCO3等杂质)为原料生产白磷(P4)同时制得刀片电池正极材料FePO4的工艺流程:
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
(1)白磷(P4)不溶于水但易溶于二硫化碳,说明P4是___________ (填“极性分子”或“非极性分子”),P4键角___________ 甲烷。(填“大于”、“小于”或“等于”)
(2)炉渣Ⅰ主要含有铁单质及铁的磷化物,写出其中FeP溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:___________ 。
(3)炉渣Ⅱ的主要成分是___________ 。
(4)“调铁”后须向“溶液Ⅱ”中通入氨气调节溶液的pH,将pH值控制在2.0的原因是___________ 。若此条件下Fe3+恰好完全转化为FePO4沉淀(当溶液中某离子浓度≤1×10−5mol/L时,可视为该离子沉淀完全),过滤,现往滤液中加入2mol/L的MgCl2溶液(设溶液体积增加1倍),此时溶液中___________ Mg3(PO4)2沉淀生成(填“有”或“无”或“无法确定”)【已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10−22、1.0×10−24】
(5)储氢技术是目前化学家研究的热点之一;铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示:其中A的原子坐标参数为(0,0,0),B为( ,
, ,
, ),C为(
),C为( ,
, ,0),则D点的坐标参数为
,0),则D点的坐标参数为___________ 。此晶胞中Fe的配位数是___________ 。若晶胞参数为anm,则晶胞中Fe与Mg最近的距离是___________ cm。
②Fe3+在pH为2.0时开始沉淀,pH为4.0时沉淀完全。
回答下列问题:
(1)白磷(P4)不溶于水但易溶于二硫化碳,说明P4是
(2)炉渣Ⅰ主要含有铁单质及铁的磷化物,写出其中FeP溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:
(3)炉渣Ⅱ的主要成分是
(4)“调铁”后须向“溶液Ⅱ”中通入氨气调节溶液的pH,将pH值控制在2.0的原因是
(5)储氢技术是目前化学家研究的热点之一;铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示:其中A的原子坐标参数为(0,0,0),B为(
 ,
, ,
, ),C为(
),C为( ,
, ,0),则D点的坐标参数为
,0),则D点的坐标参数为
您最近一年使用:0次
10 . 千金藤素常用于防治肿瘤病患者白细胞减少症、抗疟疾、调节免疫功能等,制备其关键中间体(I)的一种合成路线如下:
(1)化合物A的名称为______ ;化合物C中含有的官能团名称为___________ 。
(2)反应②是原子利用率100%的反应,写出化合物ⅰ的一种用途________________ 。
(3)芳香化合物x为ⅱ的同分异构体,能发生水解反应,且核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1。x的结构简式为_____________________ (写出一种)。
(4)根据化合物D的结构特征,分析预测其主要的化学性质,完成下表。
(5)下列说法正确的是
(6)参照上述路线,以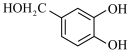 、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
①原料ⅲ为_____________ (写结构简式)。
②相关步骤涉及芳香醇转化为芳香醛的反应,对应的化学方程式为_____________________ 。
③最后一步反应类型为____________ 。
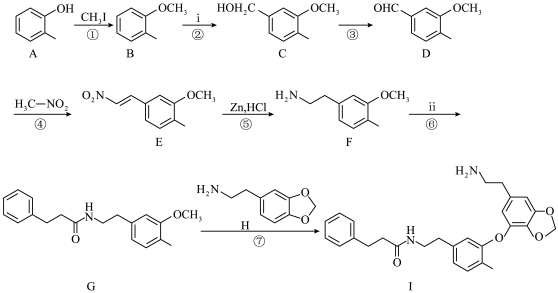
(1)化合物A的名称为
(2)反应②是原子利用率100%的反应,写出化合物ⅰ的一种用途
(3)芳香化合物x为ⅱ的同分异构体,能发生水解反应,且核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1。x的结构简式为
(4)根据化合物D的结构特征,分析预测其主要的化学性质,完成下表。
序号 | 可反应的试剂 | 反应形成的新结构 | 消耗反应物的物质的量之比 |
① | 新制 | 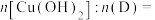 | |
② |
|
|
(5)下列说法正确的是
A.有机物A碳原子杂化方式有 、 、 | B.反应①,有C-I键和H-O键断裂 |
C.1mol化合物B中,含 键16 键16 个 个 | D.产品I属于极性分子,易溶于水和酒精 |
(6)参照上述路线,以
 、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:①原料ⅲ为
②相关步骤涉及芳香醇转化为芳香醛的反应,对应的化学方程式为
③最后一步反应类型为
您最近一年使用:0次