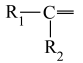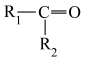名校
1 . 按要求回答下列问题:
(1)研究发现,在 低压合成甲醇反应(
低压合成甲醇反应(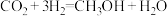 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布式为
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布式为_______ 。元素Mn与O中,第一电离能较大的是_______ ,基态原子核外未成对电子数较多的是_______ 。二氧化碳中σ和π数目之比为_______ ,甲醇和水中的氢氧键更易断裂的是_______ 。(填化学用语)
(2)我国科学家成功合成了世界上首个五氮阴离子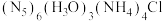 。
。
①氮原子的价层电子排布图为_______ 。
②元素的基态气态原子得到一个电子形成气态负价离子时所放出的能量称作第一电子亲和能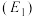 。第二周期部分元素的
。第二周期部分元素的 变化趋势如图所示。
变化趋势如图所示。 自左而右依次增大的原因是
自左而右依次增大的原因是_______ ;氮元素的 呈现异常的原因是
呈现异常的原因是_______ 。
(1)研究发现,在
 低压合成甲醇反应(
低压合成甲醇反应(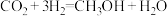 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布式为
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布式为(2)我国科学家成功合成了世界上首个五氮阴离子
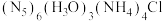 。
。①氮原子的价层电子排布图为
②元素的基态气态原子得到一个电子形成气态负价离子时所放出的能量称作第一电子亲和能
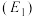 。第二周期部分元素的
。第二周期部分元素的 变化趋势如图所示。
变化趋势如图所示。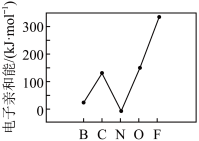
 自左而右依次增大的原因是
自左而右依次增大的原因是 呈现异常的原因是
呈现异常的原因是
您最近一年使用:0次
名校
解题方法
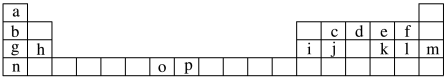
2 . 如图是元素周期表的一部分,其中所列的字母分别代表一种化学元素。
(1)元素p形成的常见离子稳定的是_______ (填化学用语),原因是_______ 。
(2)c、d、e、f四种元素的第一电离能由大到小的顺序为_______ (填元素符号)。
(3)o、p两元素的部分电离能数据如表:
比较两元素的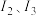 可知,基态气态o2+再失去一个电子比基态气态p2+再失去一个电子难。对此,你的解释是
可知,基态气态o2+再失去一个电子比基态气态p2+再失去一个电子难。对此,你的解释是_______ 。
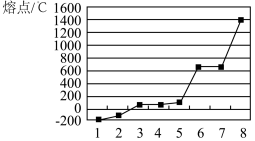
(4)第三周期8种元素按单质熔点高低的顺序排列如图所示,其中电负性最大的是_______ (填图中的序号)。_______ 。
②当阴极产生标准状况下112mL气体时,通过阳离子交换膜的离子的物质的量为_______ 。
(1)元素p形成的常见离子稳定的是
(2)c、d、e、f四种元素的第一电离能由大到小的顺序为
(3)o、p两元素的部分电离能数据如表:
| 元素 | o | p | |
 |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
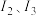 可知,基态气态o2+再失去一个电子比基态气态p2+再失去一个电子难。对此,你的解释是
可知,基态气态o2+再失去一个电子比基态气态p2+再失去一个电子难。对此,你的解释是(4)第三周期8种元素按单质熔点高低的顺序排列如图所示,其中电负性最大的是
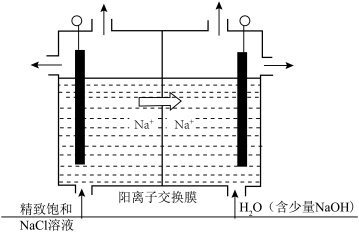
②当阴极产生标准状况下112mL气体时,通过阳离子交换膜的离子的物质的量为
您最近一年使用:0次
解题方法
3 . 氮元素的化合物种类繁多。以下是工业制硝酸的原理示意图:
(1)写出氨合成塔中发生反应的化学方程式_______ 。
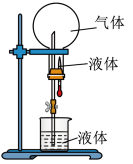
(2)氨气可以进行喷泉实验,其它气体也有可能。如图是喷泉实验装置,在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有相同液体。下列组合能形成喷泉的是_______ (填字母序号)。
(3)写出氧化炉中反应的化学方程式_______ 。吸收塔中M的作用是_______ 。
(4)下列与氮氧化物有关的环境问题有_______ (填字母序号)。
a.沙尘 b.酸雨 c.白色污染 d.霾
(5)工业生产中为了盛装大量浓硝酸,常温下可选择铝作为罐体材料,原因是_______ 。
(6)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应,用Rh做催化剂时该反应的过程示意图如下:_______ ,当生成14gN2时,转移电子_______ mol。
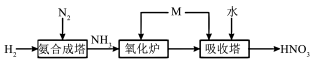
(1)写出氨合成塔中发生反应的化学方程式
(2)氨气可以进行喷泉实验,其它气体也有可能。如图是喷泉实验装置,在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有相同液体。下列组合能形成喷泉的是
(3)写出氧化炉中反应的化学方程式
(4)下列与氮氧化物有关的环境问题有
a.沙尘 b.酸雨 c.白色污染 d.霾
(5)工业生产中为了盛装大量浓硝酸,常温下可选择铝作为罐体材料,原因是
(6)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应,用Rh做催化剂时该反应的过程示意图如下:
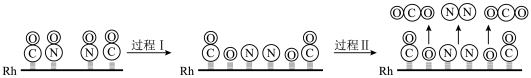
您最近一年使用:0次
4 . 己二腈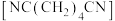 是制造“尼龙-66”(聚己二酰己二胺)的原料,工业需求量大,其制备工艺很多,发展前景较好的是利用丙烯腈
是制造“尼龙-66”(聚己二酰己二胺)的原料,工业需求量大,其制备工艺很多,发展前景较好的是利用丙烯腈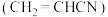 电合成己二腈。如图是用甲醇
电合成己二腈。如图是用甲醇 燃料电池作为电源电合成己二腈的示意图,所有电极均为惰性电极。
燃料电池作为电源电合成己二腈的示意图,所有电极均为惰性电极。
(1)电极b为_____ 极(填“正”或“负”);A口通入的是_____ ,a电极的电极反应式为_____ 。
(2)乙池中离子交换膜为_____ 离子交换膜(填“阴”或“阳”),随着反应的进行,电极c附近溶液pH_____ (填“变大”、“变小”或“不变”),电路中每转移 阳极室溶液质量减少
阳极室溶液质量减少_____ g(不考虑气体溶解)。
(3)当B口通入11.2L气体时(标准状况下),甲池中有_____ mol 通过质子交换膜,理论上乙池能合成己二腈
通过质子交换膜,理论上乙池能合成己二腈_____ mol。
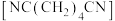 是制造“尼龙-66”(聚己二酰己二胺)的原料,工业需求量大,其制备工艺很多,发展前景较好的是利用丙烯腈
是制造“尼龙-66”(聚己二酰己二胺)的原料,工业需求量大,其制备工艺很多,发展前景较好的是利用丙烯腈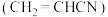 电合成己二腈。如图是用甲醇
电合成己二腈。如图是用甲醇 燃料电池作为电源电合成己二腈的示意图,所有电极均为惰性电极。
燃料电池作为电源电合成己二腈的示意图,所有电极均为惰性电极。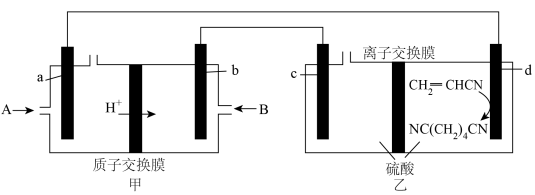
(1)电极b为
(2)乙池中离子交换膜为
 阳极室溶液质量减少
阳极室溶液质量减少(3)当B口通入11.2L气体时(标准状况下),甲池中有
 通过质子交换膜,理论上乙池能合成己二腈
通过质子交换膜,理论上乙池能合成己二腈
您最近一年使用:0次
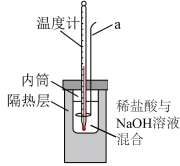
5 . 利用如图简易量热计测定中和反应反应热。 HCl溶液,插入温度计,记录初始温度为20.0℃;
HCl溶液,插入温度计,记录初始温度为20.0℃;
②向烧杯中加入50mL 0.55 NaOH溶液,调节其温度,使之也为20.0℃;
NaOH溶液,调节其温度,使之也为20.0℃;
③快速将烧杯中的碱液倒入量热计内筒中,盖好杯盖,匀速搅拌,记录体系达到的最高温度为23.3℃。
回答下列问题:
(1)仪器a的名称为______ 。
(2)本实验中NaOH溶液稍过量,理由是______ 。
(3)上述反应过程中释放的能量为______ kJ[已知,稀溶液的密度均为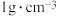 ,水的比热容为
,水的比热容为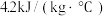 ]。
]。
(4)写出表示该反应反应热的离子方程式:______ 。
(5)精确实验测得中和反应生成1 mol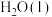 的反应热
的反应热 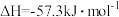 ,本实验出现误差的原因可能是______(填字母)。
,本实验出现误差的原因可能是______(填字母)。
(6)在实验中,如果用0.55 的KOH溶液代替NaOH溶液,混合后最高温度与用NaOH时溶液的最高温度
的KOH溶液代替NaOH溶液,混合后最高温度与用NaOH时溶液的最高温度______ (填“相同”或“不同”)。说明理由:______ 。
 HCl溶液,插入温度计,记录初始温度为20.0℃;
HCl溶液,插入温度计,记录初始温度为20.0℃;②向烧杯中加入50mL 0.55
 NaOH溶液,调节其温度,使之也为20.0℃;
NaOH溶液,调节其温度,使之也为20.0℃;③快速将烧杯中的碱液倒入量热计内筒中,盖好杯盖,匀速搅拌,记录体系达到的最高温度为23.3℃。
回答下列问题:
(1)仪器a的名称为
(2)本实验中NaOH溶液稍过量,理由是
(3)上述反应过程中释放的能量为
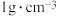 ,水的比热容为
,水的比热容为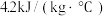 ]。
]。(4)写出表示该反应反应热的离子方程式:
(5)精确实验测得中和反应生成1 mol
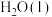 的反应热
的反应热 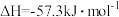 ,本实验出现误差的原因可能是______(填字母)。
,本实验出现误差的原因可能是______(填字母)。| A.NaOH溶液久置变质 | B.温度计读数不是最高温度 |
| C.NaOH溶液一次性倒入量热计中 | D.量热计隔热效果差 |
(6)在实验中,如果用0.55
 的KOH溶液代替NaOH溶液,混合后最高温度与用NaOH时溶液的最高温度
的KOH溶液代替NaOH溶液,混合后最高温度与用NaOH时溶液的最高温度
您最近一年使用:0次
名校
6 . 现有下列几种有机物:
(1)上述有机物中互为同系物的_____________ ;互为同分异构体的是_____________ ;
(2)用系统命名法对C进行命名:_____________ ;
(3)D发生加聚反应的化学方程式为___________________________________ ;
(4)烯烃分子中的不饱和键能被酸性高锰酸钾溶液氧化断链.已知:
①D被酸性 溶液氧化后,生成
溶液氧化后,生成_____________ 种氧化产物;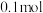 该烃完全燃烧后的产物依次通入足量浓硫酸、碱石灰,浓硫酸增重
该烃完全燃烧后的产物依次通入足量浓硫酸、碱石灰,浓硫酸增重 ,碱石灰质量增加
,碱石灰质量增加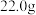 ,写出该烃的结构简式
,写出该烃的结构简式_____________ 。
A. B.
B. C.
C.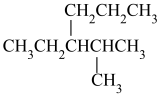 D.
D.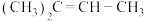 E.环戊烷
E.环戊烷
(1)上述有机物中互为同系物的
(2)用系统命名法对C进行命名:
(3)D发生加聚反应的化学方程式为
(4)烯烃分子中的不饱和键能被酸性高锰酸钾溶液氧化断链.已知:
| 烯烃被氧化的部位 | 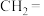 | 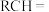 |
|
| 对应的氧化产物 |  |  |
|
 溶液氧化后,生成
溶液氧化后,生成②分子式为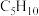 的某烯烃与酸性
的某烯烃与酸性 溶液反应后,经检测其产物为
溶液反应后,经检测其产物为 和
和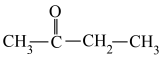 ,试推测该烯烃的结构简式为
,试推测该烯烃的结构简式为
①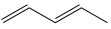 与一定量的
与一定量的 发生加成反应,生成的产物不可能是
发生加成反应,生成的产物不可能是
a. b.
b.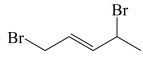
c.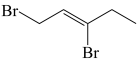 d.
d.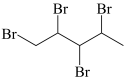
②双烯合成反应(即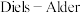 反应是一类二烯烃与单烯烃或炔烃作用生成六元环状化合物的反应,例如1,3-丁二烯和乙烯的作用表示为:
反应是一类二烯烃与单烯烃或炔烃作用生成六元环状化合物的反应,例如1,3-丁二烯和乙烯的作用表示为: .则由B和D发生双烯合成反应的产物为(用键线式表示)
.则由B和D发生双烯合成反应的产物为(用键线式表示)
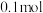 该烃完全燃烧后的产物依次通入足量浓硫酸、碱石灰,浓硫酸增重
该烃完全燃烧后的产物依次通入足量浓硫酸、碱石灰,浓硫酸增重 ,碱石灰质量增加
,碱石灰质量增加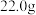 ,写出该烃的结构简式
,写出该烃的结构简式
您最近一年使用:0次
2024-07-15更新
|
55次组卷
|
3卷引用:河南省洛阳市洛龙区洛阳市第一高级中学2024-2025学年高二上学期开学化学试题
7 . 在一密闭容器中发生反应:
 ,达到平衡后,当降低温度时,X的转化率变小;当增大压强时,混合体系中Z的质量分数增大,则:
,达到平衡后,当降低温度时,X的转化率变小;当增大压强时,混合体系中Z的质量分数增大,则:
(1)
______ (填“>”“<”或“=”,下同)0,且
______ c。
(2)增大容器体积,X的质量分数______ (填“增大”“减小”或“不变”,下同)。
(3)恒容条件下充入惰性气体Ar,则化学反应速率______ 。
(4)恒容条件下充入X,则X的转化率______ ,Y的转化率______ 。
(5)加入催化剂,平衡时混合气体总物质的量______ 。
(6)若Z是有色气体,X、Y均为无色气体,压缩容器体积,则混合体系的颜色变化为______ (填现象)。

 ,达到平衡后,当降低温度时,X的转化率变小;当增大压强时,混合体系中Z的质量分数增大,则:
,达到平衡后,当降低温度时,X的转化率变小;当增大压强时,混合体系中Z的质量分数增大,则:(1)


(2)增大容器体积,X的质量分数
(3)恒容条件下充入惰性气体Ar,则化学反应速率
(4)恒容条件下充入X,则X的转化率
(5)加入催化剂,平衡时混合气体总物质的量
(6)若Z是有色气体,X、Y均为无色气体,压缩容器体积,则混合体系的颜色变化为
您最近一年使用:0次
8 . 回答下列问题。
(1)镍元素基态原子的核外电子排布式为___________ ,3d能级上的未成对电子数为___________ 。
(2)基态Ge原子的价层电子排布式为___________ ,有___________ 个未成对电子。
(3)Zn2+基态核外电子排布式为___________ 。
(4)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________ 形象化描述。在基态 14C原子中,核外存在___________ 对自旋相反的电子。
(5)基态Fe原子有___________ 个未成对电子。Fe3+的电子排布式为___________ 。
(1)镍元素基态原子的核外电子排布式为
(2)基态Ge原子的价层电子排布式为
(3)Zn2+基态核外电子排布式为
(4)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(5)基态Fe原子有
您最近一年使用:0次
名校
解题方法
9 . 根据Bronsted酸碱质子理论,酸是能放出质子的物质,碱是能接受质子的物质,酸性或碱性强弱与物质的结构有很大关系,试完成以下各题
(1)下列化合物酸性由大到小的顺序是___________ (填序号)。
①NCCOOH ②CH3CH2COOH ③CH2=CHCOOH ④CH3COOH
(2)已知化合物A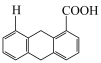 的pKa=6.04,化合物B
的pKa=6.04,化合物B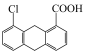 的pKa=6.25,试分析B的pKa比A大的原因
的pKa=6.25,试分析B的pKa比A大的原因___________ 。
(3)已知硝基化合物①CH3CH2CH2NO2 ②(CH3)3CNO2 ③(CH3)2CHNO2。上述三种化合物哪些可溶于NaOH溶液___________ ?其中一种在NaOH溶液中容易与溴作用且生成的溴化物可继续与NaOH溶液作用生成盐,分析该盐的结构简式___________ 。
(1)下列化合物酸性由大到小的顺序是
①NCCOOH ②CH3CH2COOH ③CH2=CHCOOH ④CH3COOH
(2)已知化合物A
 的pKa=6.04,化合物B
的pKa=6.04,化合物B 的pKa=6.25,试分析B的pKa比A大的原因
的pKa=6.25,试分析B的pKa比A大的原因(3)已知硝基化合物①CH3CH2CH2NO2 ②(CH3)3CNO2 ③(CH3)2CHNO2。上述三种化合物哪些可溶于NaOH溶液
您最近一年使用:0次
名校
解题方法
10 . 光催化是新发展的一个催化技术,TiO2是目前研究成功的应用广泛的光催化剂,它是由金红石矿(主要成分为TiO2)先制备为TiCl4,再转化为纯TiO2。
请根据表中数据作答:
(1)计算反应:TiO2(s) + 2Cl2(g)= TiCl4(g) + O2(g) 298K的ΔrΗΘm和ΔrSΘm,该反应能否正向进行___________ ?
(2)计算反应2C(s) + O2(g) = 2CO(g) 298K的ΔrΗΘm和ΔrSΘm,并判据反应在298K进行的方向___________ 。
(3)为得到纯的TiCl4,有人设计如下方案:TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g ) + 2CO(g)。计算该反应298K的ΔrΗΘm和ΔrSΘm,并判据反应进行的方向___________ 。
| 物种 | TiO2(s) | TiCl4(g) | Cl2(g) | O2(g) | C(s) | CO(g) |
| ΔrΗΘm /kJ∙molˉ1 | –944.7 | –763.2 | 0 | 0 | 0 | –110.5 |
| SΘm/J∙molˉ1∙Kˉ1 | 55.02 | 354.9 | 223.1 | 205.1 | 5.74 | 197.7 |
(1)计算反应:TiO2(s) + 2Cl2(g)= TiCl4(g) + O2(g) 298K的ΔrΗΘm和ΔrSΘm,该反应能否正向进行
(2)计算反应2C(s) + O2(g) = 2CO(g) 298K的ΔrΗΘm和ΔrSΘm,并判据反应在298K进行的方向
(3)为得到纯的TiCl4,有人设计如下方案:TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(g ) + 2CO(g)。计算该反应298K的ΔrΗΘm和ΔrSΘm,并判据反应进行的方向
您最近一年使用:0次