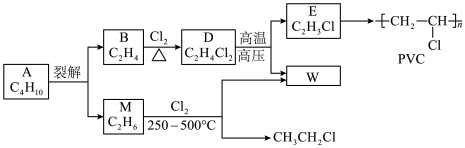
1 . 乙烯是石油化学工业重要的基本原料,可以由乙烯得到有机高分子材料、药物等成千上万种有用的物质。例如可以合成聚氯乙烯(PVC)和用作汽油抗震剂的CH3CH2Cl。_______ 。
(2)B→D的反应类型是_______ 。
(3)E的结构简式是_______ 。
(4)M→ 的反应方程式是
的反应方程式是_______ 。
(2)B→D的反应类型是
(3)E的结构简式是
(4)M→
 的反应方程式是
的反应方程式是
您最近一年使用:0次
7日内更新
|
164次组卷
|
2卷引用:北京工业大学附属中学2023-2024学年高一下学期期中考试化学试题
2 . 铜的配合物在自然界中广泛存在,请回答下列问题:
(1)硫酸铜溶液中存在多种微粒,硫酸铜溶液呈蓝色的原因是其中存在配离子_______ (填化学式),配体中提供孤电子对的原子是_______ (填元素符号)。
(2)同学甲设计如下制备铜的配合物的实验:
①结合化学用语,用平衡移动原理解释试管c中浑浊液转变为深蓝色溶液的原因_______ 。
②由上述实验可得出以下结论:
结论1:配合物的形成与_______ 、_______ 有关;
结论2:结合实验,试管b、c中深蓝色配离子的稳定性强弱顺序为:_______ >_______ (填化学式)。
③实验结束后,向c试管中加入乙醇,并用玻璃棒摩擦试管壁,析出深蓝色晶体[Cu(NH3)4]SO4·H2O,解释析出晶体的原因:_______ 。
(1)硫酸铜溶液中存在多种微粒,硫酸铜溶液呈蓝色的原因是其中存在配离子
(2)同学甲设计如下制备铜的配合物的实验:

①结合化学用语,用平衡移动原理解释试管c中浑浊液转变为深蓝色溶液的原因
②由上述实验可得出以下结论:
结论1:配合物的形成与
结论2:结合实验,试管b、c中深蓝色配离子的稳定性强弱顺序为:
③实验结束后,向c试管中加入乙醇,并用玻璃棒摩擦试管壁,析出深蓝色晶体[Cu(NH3)4]SO4·H2O,解释析出晶体的原因:
您最近一年使用:0次
名校
3 . 化学电池的发明,是贮能和供能技术的巨大进步。
(1)1799年,意大利科学家伏打用含食盐水的湿抹布夹在铜和锌的圆形板中间,堆积成圆柱状,制造出世界上最早的电池——伏打电池。此电池的负极反应___________ 。
(2)1859年,法国科学家普朗特发明了可充电的铅酸电池。汽车用铅蓄电池的结构如图1,放电时总反应为 。放电时,正极的电极反应是
。放电时,正极的电极反应是___________ ,当外电路通过0.5mol电子时,理论上负极板的质量增加___________ g。 和MnOOH,则电池放电的化学方程式为
和MnOOH,则电池放电的化学方程式为___________ 。___________ 。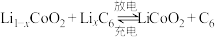 (x<1)。已知A为石墨
(x<1)。已知A为石墨 电极,则下图所示是
电极,则下图所示是___________ (填“充电”或“放电”)过程,B电极上的反应为___________ 。
(1)1799年,意大利科学家伏打用含食盐水的湿抹布夹在铜和锌的圆形板中间,堆积成圆柱状,制造出世界上最早的电池——伏打电池。此电池的负极反应
(2)1859年,法国科学家普朗特发明了可充电的铅酸电池。汽车用铅蓄电池的结构如图1,放电时总反应为
 。放电时,正极的电极反应是
。放电时,正极的电极反应是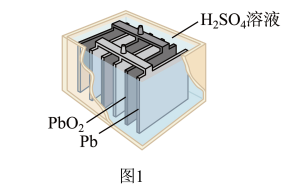
 和MnOOH,则电池放电的化学方程式为
和MnOOH,则电池放电的化学方程式为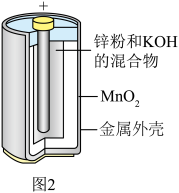
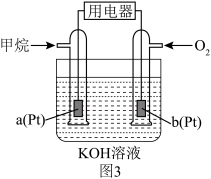
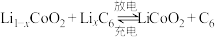 (x<1)。已知A为石墨
(x<1)。已知A为石墨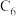 电极,则下图所示是
电极,则下图所示是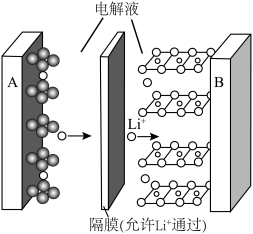
您最近一年使用:0次
名校
解题方法
4 . 由一氯乙烷合成乙二醇的线路如下:___________ 。
(2)反应②选用的无机试剂为___________ 。
(3)反应③的化学方程式是___________ 。

(2)反应②选用的无机试剂为
(3)反应③的化学方程式是
您最近一年使用:0次
名校
5 . 如图是某烃A的分子结构模型。回答下列问题:___________ 。
(2)A与溴的四氯化碳溶液反应的化学方程式是___________ 。
(3)写出A的属于烯烃的所有同分异构体的结构简式(包括顺反异构)___________ 。
(4)A在一定条件下可以发生加聚反应,其化学反应方程式是___________ 。
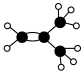
(2)A与溴的四氯化碳溶液反应的化学方程式是
(3)写出A的属于烯烃的所有同分异构体的结构简式(包括顺反异构)
(4)A在一定条件下可以发生加聚反应,其化学反应方程式是
您最近一年使用:0次
6 . 硒(Se)是动物和人体所必需的微量元素,硒单质是一种重要的工业原料。
(1)Se与S同一主族,Se在元素周期表的位置为:第4周期,___________ 。
(2)工业制备Se常用的原料含有硒化铜(CuSe),其中硒元素的化合价为___________ 。
(3)非金属性Br强于Se,用原子结构解释:Se和Br位于周期表中同一周期,原子核外电子层数相同,___________ ,___________ ,得电子能力Br大于Se.
(4)依据元素周期律,下列推断正确的是___________ (填字母)。
a.浓H2SeO4具有氧化性,可能有脱水性
b.热稳定性:H2S<H2Se<HCl
c.CuSe制备Se的过程会产生SeO2烟气,可用NaOH吸收
d.H2Se能与O2或Cl2反应生成Se单质
(1)Se与S同一主族,Se在元素周期表的位置为:第4周期,
(2)工业制备Se常用的原料含有硒化铜(CuSe),其中硒元素的化合价为
(3)非金属性Br强于Se,用原子结构解释:Se和Br位于周期表中同一周期,原子核外电子层数相同,
(4)依据元素周期律,下列推断正确的是
a.浓H2SeO4具有氧化性,可能有脱水性
b.热稳定性:H2S<H2Se<HCl
c.CuSe制备Se的过程会产生SeO2烟气,可用NaOH吸收
d.H2Se能与O2或Cl2反应生成Se单质
您最近一年使用:0次
名校
解题方法
7 . 甲醇(CH3OH)空气氧化法是生产甲醛(HCHO)的常用方法。发生的反应为2CH3OH+O2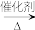 2
2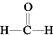 +2H2O。
+2H2O。
(2)由于水分子之间存在
(3)HCHO分子内σ键与π键个数之比为
(4)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:
您最近一年使用:0次
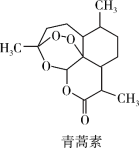
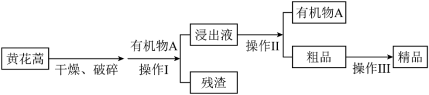
8 . 青蒿素是我国科学家从传统中药中发现的能治疗疟疾的有机化合物,可从黄花蒿茎叶中提取,它是无色针状晶体,其分子结构如图所示。___________ 。
②操作Ⅱ、Ⅲ的分离提纯方法名称分别是___________ 、___________ 。
(2)某同学发现青蒿素可以使湿润的淀粉碘化钾试纸变蓝,依据此现象在其键线式上圈出对应的基团_________ 。
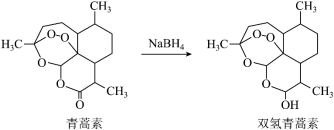
(3)科学家在青蒿素的研究中发现,一定条件下可把青蒿素转化为双氢青蒿素。___________ (填字母)。
a.青蒿素分子式为C14H20O5
b.青蒿素含有酯基和醚键
c.青蒿素分子不存在手性异构体
d.青蒿素转化为双氢青蒿素时断裂π键
②因为双氢青蒿素的水溶性更好,所与青蒿素相比,双氢青蒿素具有更好的疗效,请从结构的角度推测主要原因___________ 。
(4)已知有机溶剂A只含C、H、O三种元素,使用现代分析仪器对A的分子结构进行测定,相关结果如下:___________ 仪器可测得A的相对分子质量,其数值为74。
②如图2所示,通过红外光谱法可推测A可能所属的有机化合物类别为___________ 。
③如图3所示,通过核磁共振氢谱法测得两个峰的面积比为2∶3,推测A的结构简式为___________ 。
②操作Ⅱ、Ⅲ的分离提纯方法名称分别是
(2)某同学发现青蒿素可以使湿润的淀粉碘化钾试纸变蓝,依据此现象在其键线式上圈出对应的基团
(3)科学家在青蒿素的研究中发现,一定条件下可把青蒿素转化为双氢青蒿素。
a.青蒿素分子式为C14H20O5
b.青蒿素含有酯基和醚键
c.青蒿素分子不存在手性异构体
d.青蒿素转化为双氢青蒿素时断裂π键
②因为双氢青蒿素的水溶性更好,所与青蒿素相比,双氢青蒿素具有更好的疗效,请从结构的角度推测主要原因
(4)已知有机溶剂A只含C、H、O三种元素,使用现代分析仪器对A的分子结构进行测定,相关结果如下:
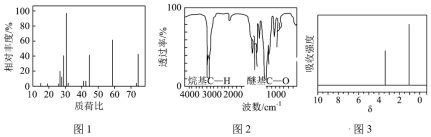

②如图2所示,通过红外光谱法可推测A可能所属的有机化合物类别为
③如图3所示,通过核磁共振氢谱法测得两个峰的面积比为2∶3,推测A的结构简式为
您最近一年使用:0次
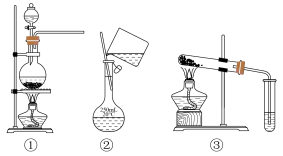
9 . 选择完成下列实验的装置。___________ (填序号,下同)。
(2)比较Na2CO3和NaHCO3的热稳定性,选用___________ 。
(3)加热MnO2和浓盐酸的混合物制Cl2,选用___________ 。
(2)比较Na2CO3和NaHCO3的热稳定性,选用
(3)加热MnO2和浓盐酸的混合物制Cl2,选用
您最近一年使用:0次
10 . 阅读短文,回答问题。
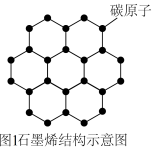
2022年北京冬奥会不仅是一次体育盛会,也是一场科技与创新的盛宴。在服装材料方面,颁奖礼仪服的内胆里添加了第二代石墨烯(如图)发热材料,能带来由内而外的温暖;速滑竞赛服使用了蜂窝样式的聚氨酯材料,以减少空气阻力。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)石墨烯中原子之间存在共价键。(___________)
(2)聚氨酯材料属于有机高分子材料。(___________)
(3)碳纤维导热性比金属材料的高。(___________)
(4)氢气是比烷烃更低碳环保的清洁能源。(___________)
2022年北京冬奥会不仅是一次体育盛会,也是一场科技与创新的盛宴。在服装材料方面,颁奖礼仪服的内胆里添加了第二代石墨烯(如图)发热材料,能带来由内而外的温暖;速滑竞赛服使用了蜂窝样式的聚氨酯材料,以减少空气阻力。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)石墨烯中原子之间存在共价键。(___________)
(2)聚氨酯材料属于有机高分子材料。(___________)
(3)碳纤维导热性比金属材料的高。(___________)
(4)氢气是比烷烃更低碳环保的清洁能源。(___________)
您最近一年使用:0次



