名校
解题方法
1 . 二甲醚(CH3OCH3)是一种绿色、可再生的新能源。
(1)①二甲醚(CH3OCH3)与乙醇(CH3CH2OH)的关系是___________ 。
②25℃、101kPa时,若1g二甲醚气体完全燃烧生成液态水放出mkJ的热量,则1mol二甲醚完全燃烧,放出的能量是___________ kJ。
(2)一定条件下,可用下列反应制得二甲醚:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
①在体积为2L密闭容器中,通入一定量的一氧化碳和氢气,2min末生成9g的水,2min 内CO的平均反应速率___________ mol/(L·min)。
②下列措施能够使该反应速率加快的是___________ 。
A.升高温度 B.降低压强 C.及时移走二甲醚
③若该反应在恒容密闭容器中进行,下列能说明该反应已达平衡状态的是___________ 。
A.单位时间内生成1mol CO,同时生成2mol H2
B.CH3OCH3的浓度不再变化
C.容器内气体的压强不再变化
D.CH3OCH3与H2O的物质的量相等
(3)二甲醚(CH3OCH3)“燃料电池”的工作原理如图所示:___________ (填“正极”或“负极”)。
②a电极的电极反应式为___________ 。
(1)①二甲醚(CH3OCH3)与乙醇(CH3CH2OH)的关系是
②25℃、101kPa时,若1g二甲醚气体完全燃烧生成液态水放出mkJ的热量,则1mol二甲醚完全燃烧,放出的能量是
(2)一定条件下,可用下列反应制得二甲醚:2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。①在体积为2L密闭容器中,通入一定量的一氧化碳和氢气,2min末生成9g的水,2min 内CO的平均反应速率
②下列措施能够使该反应速率加快的是
A.升高温度 B.降低压强 C.及时移走二甲醚
③若该反应在恒容密闭容器中进行,下列能说明该反应已达平衡状态的是
A.单位时间内生成1mol CO,同时生成2mol H2
B.CH3OCH3的浓度不再变化
C.容器内气体的压强不再变化
D.CH3OCH3与H2O的物质的量相等
(3)二甲醚(CH3OCH3)“燃料电池”的工作原理如图所示:
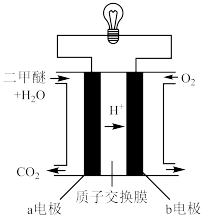
②a电极的电极反应式为
您最近一年使用:0次
名校
解题方法
2 . 硫及其化合物是十分重要的化工原料。
Ⅰ.工业上一般以硫磺或其他含硫矿物为原料制备硫酸。金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸。___________ 。
(2)用98.3%的浓硫酸吸收 而不用水的原因为
而不用水的原因为___________ 。
Ⅱ.某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气)___________ (答操作)。
(4)已知开始时量气管读数为 mL,最终读数为
mL,最终读数为 mL(均折合成标准状况,且
mL(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为___________ mol/L。
Ⅲ.实验小组为探究 与
与 溶液的反应,进行了以下实验。
溶液的反应,进行了以下实验。
实验一:用如下装置(夹持、加热仪器略)制备 ,将足量
,将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为
溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为 、(微溶)或二者的混合物。
、(微溶)或二者的混合物。 溶液,未出现白色沉淀。
溶液,未出现白色沉淀。
(5)实验二可判断B中不含 。做出判断的理由为
。做出判断的理由为___________ 。
(6)由实验二可知,实验一中, 与
与 溶液反应的离子方程式是
溶液反应的离子方程式是___________ 。
根据物质性质分析, 与
与 溶液应该可以发生氧化还原反应。
溶液应该可以发生氧化还原反应。
实验三:将实验一所得混合物隔绝空气放置一段时间,有Ag和 生成。
生成。
(7)根据实验一、二、三,可得结论为___________ 。
Ⅰ.工业上一般以硫磺或其他含硫矿物为原料制备硫酸。金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸。

(2)用98.3%的浓硫酸吸收
 而不用水的原因为
而不用水的原因为Ⅱ.某同学设计如图实验测定硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气)

(4)已知开始时量气管读数为
 mL,最终读数为
mL,最终读数为 mL(均折合成标准状况,且
mL(均折合成标准状况,且 )。则锌与稀硫酸发生反应的最低硫酸浓度为
)。则锌与稀硫酸发生反应的最低硫酸浓度为Ⅲ.实验小组为探究
 与
与 溶液的反应,进行了以下实验。
溶液的反应,进行了以下实验。实验一:用如下装置(夹持、加热仪器略)制备
 ,将足量
,将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为
溶液中,迅速反应,得到无色溶液A和白色沉淀B,经分析得出,沉淀B可能为 、(微溶)或二者的混合物。
、(微溶)或二者的混合物。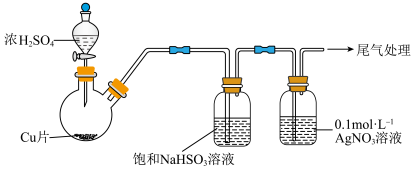
 溶液,未出现白色沉淀。
溶液,未出现白色沉淀。(5)实验二可判断B中不含
 。做出判断的理由为
。做出判断的理由为(6)由实验二可知,实验一中,
 与
与 溶液反应的离子方程式是
溶液反应的离子方程式是根据物质性质分析,
 与
与 溶液应该可以发生氧化还原反应。
溶液应该可以发生氧化还原反应。实验三:将实验一所得混合物隔绝空气放置一段时间,有Ag和
 生成。
生成。(7)根据实验一、二、三,可得结论为
您最近一年使用:0次
名校
3 . 电池在人们的生产生活中起着重要的作用,请回答下列问题:
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,放电时的总反应为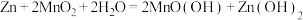 。该电池的正极为
。该电池的正极为 ,其电极反应式为:
,其电极反应式为:___________ 。___________ ;
②写出a电极上发生的电极反应___________ 。
(3)钴酸锂电池的正极采用钴酸锂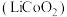 ,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式:
,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式: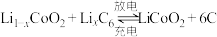 ,写出放电时负极的电极反应
,写出放电时负极的电极反应___________ 。
(4)利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
①烧渣是LiCl、 和
和 的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为
的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为___________ ;
②“滤饼2”的主要成分是___________ ,常温下, 的溶解度比LiOH
的溶解度比LiOH___________ (填“大”或“小”);
③“850℃煅烧”时的化学方程式为:___________ ;
④在实验室检查滤饼2是否洗涤干净的具体操作是:___________ 。
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,放电时的总反应为
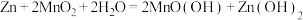 。该电池的正极为
。该电池的正极为 ,其电极反应式为:
,其电极反应式为: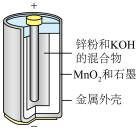
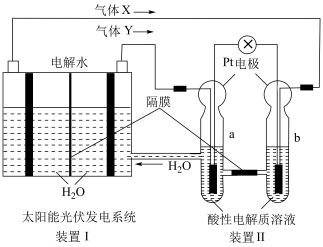
②写出a电极上发生的电极反应
(3)钴酸锂电池的正极采用钴酸锂
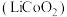 ,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式:
,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式: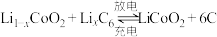 ,写出放电时负极的电极反应
,写出放电时负极的电极反应(4)利用
 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: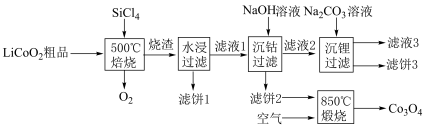
①烧渣是LiCl、
 和
和 的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为
的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为②“滤饼2”的主要成分是
 的溶解度比LiOH
的溶解度比LiOH③“850℃煅烧”时的化学方程式为:
④在实验室检查滤饼2是否洗涤干净的具体操作是:
您最近一年使用:0次
名校
解题方法
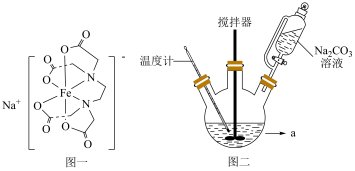
4 . 配合物乙二胺四乙酸铁钠(结构如图一所示,以下简写为NaFeY)可以添加到酱油中作为铁强化剂,制备乙二胺四乙酸铁钠晶体步骤如下:
①称取一定质量的FeCl3⋅6H2O于烧杯中溶解,加入适量浓氨水后搅拌、过滤、洗涤、干燥。
②将第一步得到的 、乙二胺四乙酸(H4Y)、H2O加入图二仪器a中,搅拌,80℃水浴1h,再加入适量碳酸钠溶液反应10min。
、乙二胺四乙酸(H4Y)、H2O加入图二仪器a中,搅拌,80℃水浴1h,再加入适量碳酸钠溶液反应10min。
③经蒸发浓缩、冷却结晶,过滤洗涤,晾干得到产品。
回答下列问题:___________ 、___________ 。
(2)步骤①中氨水应当___________ (填“分批”或“一次性”)加入,原因是___________ 。
(3)盛装Na2CO3溶液仪器名称为___________ ,加入碳酸钠溶液后可观察到产生大量气泡,则步骤②由 生成NaFeY⋅3H2O的总反应化学方程式为
生成NaFeY⋅3H2O的总反应化学方程式为___________ 。
(4)步骤③蒸发浓缩至___________ (填现象)时,停止加热。
(5)市售铁强化剂中含有NaCl、KIO3、NaFeY,其中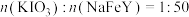 。称取mg样品,加稀硫酸溶解后配成100mL溶液。取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用
。称取mg样品,加稀硫酸溶解后配成100mL溶液。取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用 标准溶液滴定,重复操作2~3次,消耗
标准溶液滴定,重复操作2~3次,消耗 标准溶液的平均值为VmL。
标准溶液的平均值为VmL。
已知:

①滴定终点的现象为___________ 。
②样品中铁元素的质量分数为___________ 。
①称取一定质量的FeCl3⋅6H2O于烧杯中溶解,加入适量浓氨水后搅拌、过滤、洗涤、干燥。
②将第一步得到的
 、乙二胺四乙酸(H4Y)、H2O加入图二仪器a中,搅拌,80℃水浴1h,再加入适量碳酸钠溶液反应10min。
、乙二胺四乙酸(H4Y)、H2O加入图二仪器a中,搅拌,80℃水浴1h,再加入适量碳酸钠溶液反应10min。③经蒸发浓缩、冷却结晶,过滤洗涤,晾干得到产品。
回答下列问题:
(2)步骤①中氨水应当
(3)盛装Na2CO3溶液仪器名称为
 生成NaFeY⋅3H2O的总反应化学方程式为
生成NaFeY⋅3H2O的总反应化学方程式为(4)步骤③蒸发浓缩至
(5)市售铁强化剂中含有NaCl、KIO3、NaFeY,其中
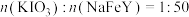 。称取mg样品,加稀硫酸溶解后配成100mL溶液。取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用
。称取mg样品,加稀硫酸溶解后配成100mL溶液。取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用 标准溶液滴定,重复操作2~3次,消耗
标准溶液滴定,重复操作2~3次,消耗 标准溶液的平均值为VmL。
标准溶液的平均值为VmL。已知:


①滴定终点的现象为
②样品中铁元素的质量分数为
您最近一年使用:0次
2024-06-11更新
|
161次组卷
|
2卷引用:湖北省武昌区2024届高三下学期5月质量检测(二模)化学试题
解题方法
5 . 化学在日常防疫中发挥了重要作用,各类杀菌消毒剂逐渐被人们认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液;②3%H2O2溶液;③漂白粉;④ClO2;⑤O3;⑥碘酒;⑦75%酒精;⑧高铁酸钠(Na2FeO4)。按要求回答下列问题。
(1)上述杀菌消毒剂属于电解质的是___________ ,属于非电解质的是__________ 。(填序号)。
(2)“84”消毒液可由Cl2和NaOH溶液反应制得,若与“洁厕灵”(盐酸是成分之一)混合使用会产生黄绿色有毒气体,原因是_________ (用离子方程式表示)。
(3)H2O2是一种绿色环保型消毒剂,其结构式为__________ ,含有化学键的类型为__________ 。
(4)O3是一种强氧化剂,具有强大的杀菌能力。O3与O2的关系是互为__________ 。
(5)高铁酸钠(Na2FeO4)是一种多功能新型净水剂。工业上可在NaOH溶液中,用NaClO氧化Fe(OH)3的方法制备Na2FeO4,其离子方程式为__________ ,Na2FeO4在水中可以发生反应: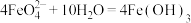 (胶体)
(胶体)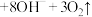 ,当反应转移的电子数为
,当反应转移的电子数为 时,生成标准状态下O2的体积约为
时,生成标准状态下O2的体积约为__________ 。
(1)上述杀菌消毒剂属于电解质的是
(2)“84”消毒液可由Cl2和NaOH溶液反应制得,若与“洁厕灵”(盐酸是成分之一)混合使用会产生黄绿色有毒气体,原因是
(3)H2O2是一种绿色环保型消毒剂,其结构式为
(4)O3是一种强氧化剂,具有强大的杀菌能力。O3与O2的关系是互为
(5)高铁酸钠(Na2FeO4)是一种多功能新型净水剂。工业上可在NaOH溶液中,用NaClO氧化Fe(OH)3的方法制备Na2FeO4,其离子方程式为
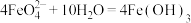 (胶体)
(胶体)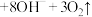 ,当反应转移的电子数为
,当反应转移的电子数为 时,生成标准状态下O2的体积约为
时,生成标准状态下O2的体积约为
您最近一年使用:0次
名校
解题方法
6 . 苯乙烯作为一种重要的基础有机化工原料,广泛用于合成塑料和橡胶。工业常采用乙苯脱氢的方法制备苯乙烯,其原理如下:
反应Ⅰ: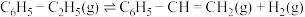

(1)近期有科技工作者结合是实验与计算机模拟结果,研究了乙苯在催化剂表面脱氢制苯乙烯的反应,其历程如下图所示(吸附在催化剂表面的物种用 标注):
标注):
___________  (计算结果保留整数)。
(计算结果保留整数)。
②依据上述反应历程,推测乙苯脱氢反应产生的副产物可能是___________ (填结构简式)
(2)在 下,乙苯直接脱氢反应的
下,乙苯直接脱氢反应的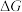 和
和 随温度的变化如图所示。
随温度的变化如图所示。___________ (选填“能”或“不能”)自发。
② 随温度的变化曲线为
随温度的变化曲线为___________ (选填“a”或“b”)。
(3)在某温度、 下,向反应器中充入
下,向反应器中充入 气态乙苯和
气态乙苯和 发生反应Ⅰ,其平衡转化率为
发生反应Ⅰ,其平衡转化率为 ,则乙苯脱氢反应的压强平衡常数
,则乙苯脱氢反应的压强平衡常数
___________ (计算时忽略副反应)。
(4)工业上还可以利用 氧化乙苯制乙烯,其原理为:反应Ⅱ:
氧化乙苯制乙烯,其原理为:反应Ⅱ: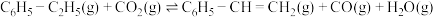
 ,在相同反应条件下,工业上可采用
,在相同反应条件下,工业上可采用 替代水蒸气进行乙苯脱氢反应,已知
替代水蒸气进行乙苯脱氢反应,已知 ;则
;则 代替水蒸气参与反应的优点有
代替水蒸气参与反应的优点有___________ 。
A.降低反应的能耗 B.乙苯转化率更高
C.提高了反应速率 D.提高了产物选择性
(5)苯乙烯被酸性高锰酸钾溶液充分氧化后的产物是___________ 和___________ (填名称)。
反应Ⅰ:
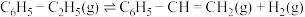

(1)近期有科技工作者结合是实验与计算机模拟结果,研究了乙苯在催化剂表面脱氢制苯乙烯的反应,其历程如下图所示(吸附在催化剂表面的物种用
 标注):
标注):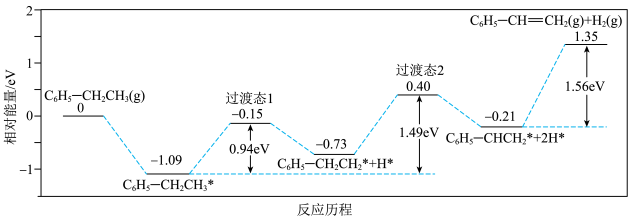

 (计算结果保留整数)。
(计算结果保留整数)。②依据上述反应历程,推测乙苯脱氢反应产生的副产物可能是
(2)在
 下,乙苯直接脱氢反应的
下,乙苯直接脱氢反应的 和
和 随温度的变化如图所示。
随温度的变化如图所示。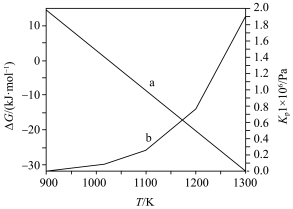
②
 随温度的变化曲线为
随温度的变化曲线为(3)在某温度、
 下,向反应器中充入
下,向反应器中充入 气态乙苯和
气态乙苯和 发生反应Ⅰ,其平衡转化率为
发生反应Ⅰ,其平衡转化率为 ,则乙苯脱氢反应的压强平衡常数
,则乙苯脱氢反应的压强平衡常数
(4)工业上还可以利用
 氧化乙苯制乙烯,其原理为:反应Ⅱ:
氧化乙苯制乙烯,其原理为:反应Ⅱ: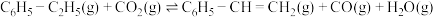
 ,在相同反应条件下,工业上可采用
,在相同反应条件下,工业上可采用 替代水蒸气进行乙苯脱氢反应,已知
替代水蒸气进行乙苯脱氢反应,已知 ;则
;则 代替水蒸气参与反应的优点有
代替水蒸气参与反应的优点有A.降低反应的能耗 B.乙苯转化率更高
C.提高了反应速率 D.提高了产物选择性
(5)苯乙烯被酸性高锰酸钾溶液充分氧化后的产物是
您最近一年使用:0次
解题方法
7 . I.现有A、B、C、D四种可溶性物质,它们溶于水后电离产生的所有离子如下表所示:(各物质中所含离子均不相同)
已知:①A物质是中学里用来检验Cl-的盐;
②向B物质的溶液中滴入无色酚酞溶液,呈红色;
③C物质分别与其它三种物质在溶液中反应均能产生白色沉淀,且B和C反应产生的白色沉淀会迅速变为灰绿色,最后变为红褐色。
回答下列问题:
(1)写出下列物质的化学式:A___________ ,D___________ 。
(2)写出③中沉淀颜色变化过程中涉及的化学反应方程式___________ 。
(3)检验溶液中Fe2+是否变质的操作是___________ 。
(4)D物质和C物质在溶液中反应的离子方程式为___________ 。
II.研究钠及其化合物的性质有重要的意义。
(5)某同学向 和
和 的混合液中逐滴加入一定浓度的盐酸,生成
的混合液中逐滴加入一定浓度的盐酸,生成 的体积(标准状况)与加入盐酸的体积的关系如图所示:
的体积(标准状况)与加入盐酸的体积的关系如图所示: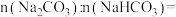
___________ 。
②盐酸的物质的量浓度为___________ 。
| 阳离子 |
|
| 阴离子 |
|
②向B物质的溶液中滴入无色酚酞溶液,呈红色;
③C物质分别与其它三种物质在溶液中反应均能产生白色沉淀,且B和C反应产生的白色沉淀会迅速变为灰绿色,最后变为红褐色。
回答下列问题:
(1)写出下列物质的化学式:A
(2)写出③中沉淀颜色变化过程中涉及的化学反应方程式
(3)检验溶液中Fe2+是否变质的操作是
(4)D物质和C物质在溶液中反应的离子方程式为
II.研究钠及其化合物的性质有重要的意义。
(5)某同学向
 和
和 的混合液中逐滴加入一定浓度的盐酸,生成
的混合液中逐滴加入一定浓度的盐酸,生成 的体积(标准状况)与加入盐酸的体积的关系如图所示:
的体积(标准状况)与加入盐酸的体积的关系如图所示:
②盐酸的物质的量浓度为
您最近一年使用:0次
名校
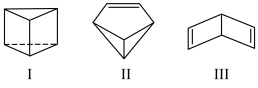
8 . Ⅰ.近年来运用有机合成的方法制备出了许多具有下图所示立体结构的环状化合物,如图:_______ 。
(2)Ⅰ、Ⅱ、Ⅲ之间的关系是______。
(3)物质Ⅰ、Ⅱ中含有的官能团的名称是_______ 。
Ⅱ.三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(4)分子中原子个数比
______ 。
(5)三聚氰胺的分子式为________ 。
(6)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳、氮两种元素组成的六元杂环。则三聚氰胺的结构简式为________ 。
(2)Ⅰ、Ⅱ、Ⅲ之间的关系是______。
| A.同素异形体 | B.同系物 | C.同分异构体 | D.同种物质 |
(3)物质Ⅰ、Ⅱ中含有的官能团的名称是
Ⅱ.三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(4)分子中原子个数比

(5)三聚氰胺的分子式为
(6)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳、氮两种元素组成的六元杂环。则三聚氰胺的结构简式为
您最近一年使用:0次
名校
解题方法
9 . 某小组同学设计实验实现几种价态硫元素的转化。
Ⅰ:从下列试剂中选择合适的试剂实现S(+6价)→S(+4价)的转化。
试剂清单:①浓H2SO4;②稀H2SO4;③酸性KMnO4溶液;④Na2SO3溶液;⑤Cu;⑥品红溶液。
(1)写出实现转化的化学方程式:___________ 。
(2)设计实验,证明实现了该转化(写出操作和现象):___________ 。
Ⅱ:实现硫元素在0价、+2价、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
SO2 Na2SO3溶液
Na2SO3溶液 Na2S2O3溶液
Na2S2O3溶液 X
X
(3)ⅰ中加入的物质是___________ ,该转化说明SO2的类别是___________ 。
(4)写出ⅲ反应的离子方程式:___________ 。
Ⅰ:从下列试剂中选择合适的试剂实现S(+6价)→S(+4价)的转化。
试剂清单:①浓H2SO4;②稀H2SO4;③酸性KMnO4溶液;④Na2SO3溶液;⑤Cu;⑥品红溶液。
(1)写出实现转化的化学方程式:
(2)设计实验,证明实现了该转化(写出操作和现象):
Ⅱ:实现硫元素在0价、+2价、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
SO2
 Na2SO3溶液
Na2SO3溶液 Na2S2O3溶液
Na2S2O3溶液 X
X(3)ⅰ中加入的物质是
(4)写出ⅲ反应的离子方程式:
您最近一年使用:0次
2024-05-11更新
|
92次组卷
|
2卷引用:湖北省武汉西藏中学2023-2024学年高一下学期5月期中考试化学试题
名校
解题方法
10 . 液相催化还原法可去除水体中的 ,其分步催化还原机理如图1所示。其他条件相同,不同
,其分步催化还原机理如图1所示。其他条件相同,不同 时,反应1小时后
时,反应1小时后 化率和不同产物在总还原产物中所占的物质的量的百分比如图2所示。
化率和不同产物在总还原产物中所占的物质的量的百分比如图2所示。_____________ ,还原剂是_____________ 。
(2)反应ⅰ的离子方程式是_____________________________________ 。
(3)研究表明, 在
在 表面与
表面与 竞争吸附,会降低
竞争吸附,会降低 吸附
吸附 的能力,但对
的能力,但对 吸附
吸附 的能力影响不大。
的能力影响不大。
①随 增大,
增大, 和氨态氮在还原产物中的百分比均减小,原因是
和氨态氮在还原产物中的百分比均减小,原因是_________________________ ,导致反应ⅱ的化学反应速率降低。
②随 减小,还原产物中
减小,还原产物中 的变化趋势是
的变化趋势是_____________________________ ,说明 表面吸附的
表面吸附的 和
和 的个数比变大,对反应
的个数比变大,对反应_________________________ (用离子方程式表示)更有利。
(4)分析图2,使用该催化剂,通过调节溶液 ,可将
,可将 可能多地转化为
可能多地转化为 。其具体方法是
。其具体方法是_____________ 。
 ,其分步催化还原机理如图1所示。其他条件相同,不同
,其分步催化还原机理如图1所示。其他条件相同,不同 时,反应1小时后
时,反应1小时后 化率和不同产物在总还原产物中所占的物质的量的百分比如图2所示。
化率和不同产物在总还原产物中所占的物质的量的百分比如图2所示。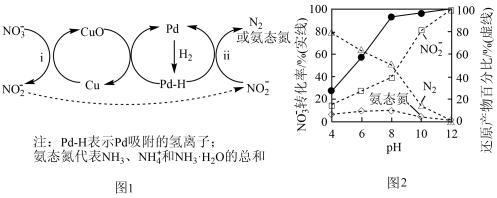
(2)反应ⅰ的离子方程式是
(3)研究表明,
 在
在 表面与
表面与 竞争吸附,会降低
竞争吸附,会降低 吸附
吸附 的能力,但对
的能力,但对 吸附
吸附 的能力影响不大。
的能力影响不大。①随
 增大,
增大, 和氨态氮在还原产物中的百分比均减小,原因是
和氨态氮在还原产物中的百分比均减小,原因是②随
 减小,还原产物中
减小,还原产物中 的变化趋势是
的变化趋势是 表面吸附的
表面吸附的 和
和 的个数比变大,对反应
的个数比变大,对反应(4)分析图2,使用该催化剂,通过调节溶液
 ,可将
,可将 可能多地转化为
可能多地转化为 。其具体方法是
。其具体方法是
您最近一年使用:0次

 Na+、Fe2+、Ag+、Ba2+
Na+、Fe2+、Ag+、Ba2+ 、
、


