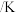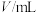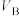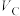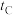名校
解题方法
1 . 酸性 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为 。某同学设计如下表所示方案探究温度、浓度改变对该反应速率的影响情况。
。某同学设计如下表所示方案探究温度、浓度改变对该反应速率的影响情况。
(1)实验中a的最小值为___________ ,探究温度变化对反应速率影响情况的两组实验是___________ 。
(2)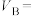
___________ ,
___________ ,利用实验B中数据计算,用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为
___________ 。
(3)他们发现,A组实验中收集的 体积如图a所示;若使A组反应在绝热容器中进行,该反应的反应速率随着时间的变化如图b所示。
体积如图a所示;若使A组反应在绝热容器中进行,该反应的反应速率随着时间的变化如图b所示。 时间内速率变快的主要原因可能:一是
时间内速率变快的主要原因可能:一是______________ ;二是______________ 。
 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为 。某同学设计如下表所示方案探究温度、浓度改变对该反应速率的影响情况。
。某同学设计如下表所示方案探究温度、浓度改变对该反应速率的影响情况。实验序号 | 实验温度 | 参加反应的物质 | 溶液颜色褪至无色所需时间/s | ||||
|
|
| |||||
| c/mol/L |
| c/mol/L |
| |||
A | 298 | 2 | 0.03 | 4 | a | 0 |
|
B | TB | 2 | 0.03 | 3 | a |
| 10 |
C | 318 | 2 | 0.03 |
| a | 1 |
|
(2)
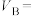

 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为
(3)他们发现,A组实验中收集的
 体积如图a所示;若使A组反应在绝热容器中进行,该反应的反应速率随着时间的变化如图b所示。
体积如图a所示;若使A组反应在绝热容器中进行,该反应的反应速率随着时间的变化如图b所示。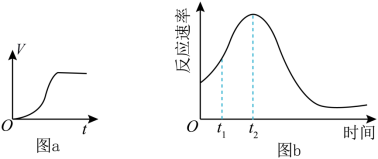
 时间内速率变快的主要原因可能:一是
时间内速率变快的主要原因可能:一是
您最近一年使用:0次
名校
2 . 聚氯乙烯英文缩写为PVC,是当今世界上产量最大、应用最广的热塑性塑料之一。
(1)工业上以乙烯和氯气为原料合成PVC的流程如下:
乙烯


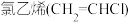

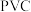
乙烯生成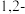 二氯乙烷的化学方程式为
二氯乙烷的化学方程式为_________________ ,反应类型是____________ 。
(2)一定条件下,乙炔( )经两步反应也可以得到聚氯乙烯,写出反应的化学方程式:
)经两步反应也可以得到聚氯乙烯,写出反应的化学方程式:___________ 、 __________ 。
(3)下列有关PVC的说法正确的是____________ (填字母)。
a.能使溴的四氯化碳溶液褪色 b.在空气中燃烧,但产物易引起环境污染
c.能使酸性 溶液褪色
溶液褪色
(4)下列物质不可能 是丙烯加成产物的是 _____________ 。
a.CH3CH2CH3 b.CH3CHClCH3 c.CH3CH2CH2Cl d.CH2ClCH=CH2
(1)工业上以乙烯和氯气为原料合成PVC的流程如下:
乙烯



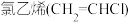

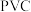
乙烯生成
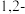 二氯乙烷的化学方程式为
二氯乙烷的化学方程式为(2)一定条件下,乙炔(
 )经两步反应也可以得到聚氯乙烯,写出反应的化学方程式:
)经两步反应也可以得到聚氯乙烯,写出反应的化学方程式:(3)下列有关PVC的说法正确的是
a.能使溴的四氯化碳溶液褪色 b.在空气中燃烧,但产物易引起环境污染
c.能使酸性
 溶液褪色
溶液褪色(4)下列物质
a.CH3CH2CH3 b.CH3CHClCH3 c.CH3CH2CH2Cl d.CH2ClCH=CH2
您最近一年使用:0次
名校
3 . 回答下列问题。
(1)将物质进行分类:① 和
和 ②乙醇
②乙醇 与二甲醚
与二甲醚 ③D2O与H2O④
③D2O与H2O④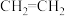 和
和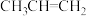 ⑤
⑤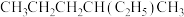 和
和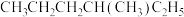 ,用序号回答下列问题:
,用序号回答下列问题:
A互为同分异构体的是__________ ;B属于同一种化合物的是__________ ;C互为同系物的是_________ 。
(2)分子中含有22个共价键的链状烷烃有多种同分异构体,写出其中含有三个甲基且等效氢有3种的结构简式:_____________________________________
(3)有一类组成最简单的有机硅化合物叫硅烷,硅烷的组成、结构与相应的烷烃相似。写出乙硅烷在空气中自燃的化学方程式:___________ 。
(4)若 、C2H4、C2H2、C6H6四种烃各为1g,在足量
、C2H4、C2H2、C6H6四种烃各为1g,在足量 中燃烧,消耗
中燃烧,消耗 最多的是:
最多的是:___________ 。
(5)写出CH3—CH=CH—CH3发生加聚反应的化学方程式:_______________ 。
(1)将物质进行分类:①
 和
和 ②乙醇
②乙醇 与二甲醚
与二甲醚 ③D2O与H2O④
③D2O与H2O④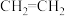 和
和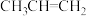 ⑤
⑤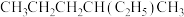 和
和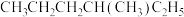 ,用序号回答下列问题:
,用序号回答下列问题:A互为同分异构体的是
(2)分子中含有22个共价键的链状烷烃有多种同分异构体,写出其中含有三个甲基且等效氢有3种的结构简式:
(3)有一类组成最简单的有机硅化合物叫硅烷,硅烷的组成、结构与相应的烷烃相似。写出乙硅烷在空气中自燃的化学方程式:
(4)若
 、C2H4、C2H2、C6H6四种烃各为1g,在足量
、C2H4、C2H2、C6H6四种烃各为1g,在足量 中燃烧,消耗
中燃烧,消耗 最多的是:
最多的是:(5)写出CH3—CH=CH—CH3发生加聚反应的化学方程式:
您最近一年使用:0次
名校
解题方法
4 . I.使用现代分析仪器对有机化合物A的分子结构进行测定(已知A中只含一种官能团),相关结果如下:___________ ,分子式为___________ 。
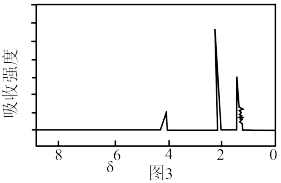
(2)根据以上结果和图3(三组峰的面积比为3:3:2),推测A的结构简式可能为___________ 。(写出一种即可)
(3)10个碳原子以下一氯代物只有1种的烷烃有4种,写出相对分子质量最大的烷烃的结构简式:___________ 。
(4)分子式为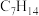 ,主链为5个碳的烯烃有
,主链为5个碳的烯烃有___________ 种。
(5)芳香烃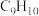 中存在顺反异构的有机物,其顺式结构简式为
中存在顺反异构的有机物,其顺式结构简式为___________ 。
(6)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,含有1个手性碳的有机物存在“对映异构体”(如同左手和右手)。下列有机物存在对映异构体的是___________ (写序号)。
①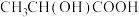 ②2-氯丁烷 ③甲基环己烷
②2-氯丁烷 ③甲基环己烷

(2)根据以上结果和图3(三组峰的面积比为3:3:2),推测A的结构简式可能为
(3)10个碳原子以下一氯代物只有1种的烷烃有4种,写出相对分子质量最大的烷烃的结构简式:
(4)分子式为
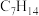 ,主链为5个碳的烯烃有
,主链为5个碳的烯烃有(5)芳香烃
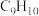 中存在顺反异构的有机物,其顺式结构简式为
中存在顺反异构的有机物,其顺式结构简式为(6)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,含有1个手性碳的有机物存在“对映异构体”(如同左手和右手)。下列有机物存在对映异构体的是
①
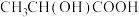 ②2-氯丁烷 ③甲基环己烷
②2-氯丁烷 ③甲基环己烷
您最近一年使用:0次
解题方法
5 . 现有下列几种有机物或微粒:
(1)上述物质中属于芳香烃的是________ (填编号,下同),互为同分异构体的是_________ 。
(2)④与等物质的量的HBr发生加成反应的产物可能为___________ (填结构简式)。
(3)⑧中只含碳、氢、氧三种元素,其分子结构模型中小球表示原子,球与球之间的短线代表单键或双键。⑧中所含官能团的名称为___________ 。
(4)⑤的一种同分异构体B为芳香族化合物,其核磁共振氢谱图如图所示:___________ ,下列关于B的说法正确的是___________ (填字母)。
A.该物质可与氢气反应,1mol该物质最多消耗氢气的物质的量为4mol
B.在光照条件下,该物质可以和氯水发生取代反应
C.该物质可以使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,均发生氧化反应
(5)⑦是最简单的碳正离子,它的中心原子的杂化方式为___________ ; 并不稳定,原因是
并不稳定,原因是___________ 。
①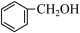 ②
②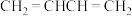 ③
③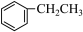 ④
④ ⑤
⑤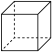 ⑥
⑥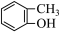 ⑦
⑦ ⑧
⑧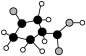
(1)上述物质中属于芳香烃的是
(2)④与等物质的量的HBr发生加成反应的产物可能为
(3)⑧中只含碳、氢、氧三种元素,其分子结构模型中小球表示原子,球与球之间的短线代表单键或双键。⑧中所含官能团的名称为
(4)⑤的一种同分异构体B为芳香族化合物,其核磁共振氢谱图如图所示:

A.该物质可与氢气反应,1mol该物质最多消耗氢气的物质的量为4mol
B.在光照条件下,该物质可以和氯水发生取代反应
C.该物质可以使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,均发生氧化反应
(5)⑦是最简单的碳正离子,它的中心原子的杂化方式为
 并不稳定,原因是
并不稳定,原因是
您最近一年使用:0次
6 . 亚硝酸钠( )是一种常用工业盐,具备多种用途,回答下列问题:
)是一种常用工业盐,具备多种用途,回答下列问题:
(1) 中N元素的化合价为
中N元素的化合价为_____ 。
(2)误食 能致人中毒,其中毒机制是把人血红蛋白内的
能致人中毒,其中毒机制是把人血红蛋白内的 转化为
转化为 ,这说明
,这说明 具有
具有_____ 性;服用维生素C可以缓解 中毒状况,这说明维生素C具有
中毒状况,这说明维生素C具有_____ 性;下列物质中能实现 转化为
转化为 的物质是
的物质是_____ (填字母)。
a. b.
b. c.Fe
c.Fe
(3)将 和NO按1∶1的比例通入NaOH溶液中可制得
和NO按1∶1的比例通入NaOH溶液中可制得 此反应的离子方程式为
此反应的离子方程式为_____ 。
(4)为了防止钢铁零件生锈,工厂常用 使钢铁零件表面生成致密保护层,处理过程中的一步反应为
使钢铁零件表面生成致密保护层,处理过程中的一步反应为 (亚铁酸钠)+
(亚铁酸钠)+_____ 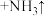 (未配平),请将上述反应中各物质的化学计量系数配平:
(未配平),请将上述反应中各物质的化学计量系数配平:_____ 。
_____Fe+_____ _____NaOH→_____
_____NaOH→_____ _____+_____
_____+_____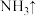 。
。
 )是一种常用工业盐,具备多种用途,回答下列问题:
)是一种常用工业盐,具备多种用途,回答下列问题:(1)
 中N元素的化合价为
中N元素的化合价为(2)误食
 能致人中毒,其中毒机制是把人血红蛋白内的
能致人中毒,其中毒机制是把人血红蛋白内的 转化为
转化为 ,这说明
,这说明 具有
具有 中毒状况,这说明维生素C具有
中毒状况,这说明维生素C具有 转化为
转化为 的物质是
的物质是a.
 b.
b. c.Fe
c.Fe(3)将
 和NO按1∶1的比例通入NaOH溶液中可制得
和NO按1∶1的比例通入NaOH溶液中可制得 此反应的离子方程式为
此反应的离子方程式为(4)为了防止钢铁零件生锈,工厂常用
 使钢铁零件表面生成致密保护层,处理过程中的一步反应为
使钢铁零件表面生成致密保护层,处理过程中的一步反应为 (亚铁酸钠)+
(亚铁酸钠)+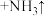 (未配平),请将上述反应中各物质的化学计量系数配平:
(未配平),请将上述反应中各物质的化学计量系数配平:_____Fe+_____
 _____NaOH→_____
_____NaOH→_____ _____+_____
_____+_____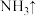 。
。
您最近一年使用:0次
名校
解题方法
7 . 研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。回答下列问题:
I.如图是硫元素的“价—类”二维图。___________ ; 属于
属于___________ (填“酸性氧化物”或“碱性氧化物”)。
(2) 的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是___________(填字母)。
的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是___________(填字母)。
(3) 易被氧化而变质,验证其已变质的实验操作及现象是
易被氧化而变质,验证其已变质的实验操作及现象是___________ 。
II.某化学兴趣小组,设计如图实验装置(夹持装置已省略),验证 的部分性质。
的部分性质。___________ 。
(5)装置A中发生反应的化学方程式为___________ ,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(6)装置B中湿润的品红溶液褪色,证明 有
有___________ (填“漂白性”或“氧化性”);装置C中产生白色沉淀,该白色沉淀为___________ (填化学式)。
(7)装置D中产生黄色浑浊,发生反应的离子方程式为___________ ( 过量)。
过量)。
I.如图是硫元素的“价—类”二维图。

 属于
属于(2)
 的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是___________(填字母)。
的过度排放易造成硫酸型酸雨,减少酸雨的产生可采取的措施是___________(填字母)。| A.把工厂烟囱造高 | B.煤使用之前先脱硫 |
| C.逐渐用新能源代替含硫煤 | D.加强空气中二氧化硫的监测 |
(3)
 易被氧化而变质,验证其已变质的实验操作及现象是
易被氧化而变质,验证其已变质的实验操作及现象是II.某化学兴趣小组,设计如图实验装置(夹持装置已省略),验证
 的部分性质。
的部分性质。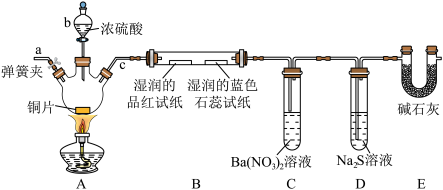
(5)装置A中发生反应的化学方程式为
(6)装置B中湿润的品红溶液褪色,证明
 有
有(7)装置D中产生黄色浑浊,发生反应的离子方程式为
 过量)。
过量)。
您最近一年使用:0次
名校
解题方法
8 . 请根据所学知识回答下列问题:
(1)同温同压下,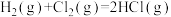 ,在光照和点燃条件下的
,在光照和点燃条件下的 (化学计量数相同)分别为
(化学计量数相同)分别为 、
、 ,
,
_______  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
(2)已知:稀溶液中,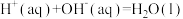
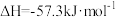 ,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量
,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量_______ 57.3kJ。
(3)天然气中含有的微量 会腐蚀管道和设备,在1200℃下进行脱硫处理,
会腐蚀管道和设备,在1200℃下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。
请写出该反应的热化学方程式:_______ 。
(4)卫星发射时可用肼(N2H4)作燃料,1mol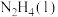 在
在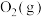 中燃烧,生成
中燃烧,生成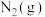 和
和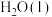 ,放出622kJ热量。反应的热化学方程式为
,放出622kJ热量。反应的热化学方程式为_______ 。
(1)同温同压下,
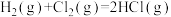 ,在光照和点燃条件下的
,在光照和点燃条件下的 (化学计量数相同)分别为
(化学计量数相同)分别为 、
、 ,
,
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。(2)已知:稀溶液中,
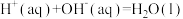
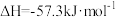 ,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量
,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量(3)天然气中含有的微量
 会腐蚀管道和设备,在1200℃下进行脱硫处理,
会腐蚀管道和设备,在1200℃下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。| 化学键 | 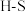 |  |  |  中共价键 中共价键 |
键能/( ) ) | 339 | 498 | 464 | 1083 |
(4)卫星发射时可用肼(N2H4)作燃料,1mol
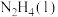 在
在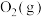 中燃烧,生成
中燃烧,生成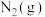 和
和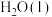 ,放出622kJ热量。反应的热化学方程式为
,放出622kJ热量。反应的热化学方程式为
您最近一年使用:0次
名校
9 . Ⅰ.以下实验中分别利用了硫酸的哪些性质?请将正确答案的序号分别填在横线上。
①脱水性②强氧化性③吸水性④强酸性
(1)浓硫酸干燥氯气:_____ ;
(2)适量浓硫酸与蔗糖混合后,体积膨胀颜色变黑:_____ ;
(3)把浓硫酸滴加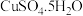 晶体中:
晶体中:_____ 。
Ⅱ.已知:浓硝酸和铜在常温下反应的化学方程式为: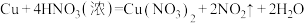 。回答下列问题:
。回答下列问题:
(4)在这个反应中,浓硝酸表现的化学性质是酸性和_____ 性(填“氧化”或“还原”)。
(5) 的电离方程式为
的电离方程式为_____ 。
(6)在离子方程式中,只有强酸、强碱和可溶性盐拆写成离子形式,该反应的离子方程式为_____ 。
(7)随着反应的进行,硝酸的浓度减小,发生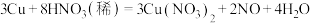 反应。在该反应中,有3molCu反应,有
反应。在该反应中,有3molCu反应,有_____ 个 转化为NO气体。
转化为NO气体。
(8)氮的氧化物有毒。用NaOH溶液吸收的方程式为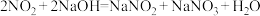 ,该反应消耗2mol
,该反应消耗2mol 转移的电子的物质的量是
转移的电子的物质的量是_____ 。
①脱水性②强氧化性③吸水性④强酸性
(1)浓硫酸干燥氯气:
(2)适量浓硫酸与蔗糖混合后,体积膨胀颜色变黑:
(3)把浓硫酸滴加
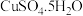 晶体中:
晶体中:Ⅱ.已知:浓硝酸和铜在常温下反应的化学方程式为:
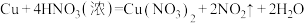 。回答下列问题:
。回答下列问题:(4)在这个反应中,浓硝酸表现的化学性质是酸性和
(5)
 的电离方程式为
的电离方程式为(6)在离子方程式中,只有强酸、强碱和可溶性盐拆写成离子形式,该反应的离子方程式为
(7)随着反应的进行,硝酸的浓度减小,发生
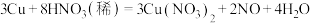 反应。在该反应中,有3molCu反应,有
反应。在该反应中,有3molCu反应,有 转化为NO气体。
转化为NO气体。(8)氮的氧化物有毒。用NaOH溶液吸收的方程式为
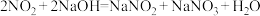 ,该反应消耗2mol
,该反应消耗2mol 转移的电子的物质的量是
转移的电子的物质的量是
您最近一年使用:0次
解题方法
10 . 研究化学反应的快慢和限度,对工农业生产和人们生活有重要的意义。回答下列问题:
(1)工业合成氨的原理为 。已知断开1 mol
。已知断开1 mol  、
、 、
、 键所需能量分别为436kJ、391kJ、946kJ,若有2 mol
键所需能量分别为436kJ、391kJ、946kJ,若有2 mol  生成时,
生成时,___________ (填“吸收”或“放出”)热量___________ kJ。
(2)一种新型催化剂能使NO和CO发生反应: 。已知:增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示:
。已知:增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示:
①表中
___________ 。
②能验证温度对化学反应速率影响规律的实验是___________ (填实验编号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度 随时间t的变化曲线如图1所示,其中表示实验Ⅱ的是曲线
随时间t的变化曲线如图1所示,其中表示实验Ⅱ的是曲线___________ (填“甲”或“乙”)。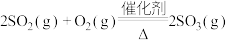 ,已知该反应为放热反应。向1 L恒容密闭容器中充入2 mol
,已知该反应为放热反应。向1 L恒容密闭容器中充入2 mol  和适当过量的
和适当过量的 ,在一定条件下充分反应,图2是
,在一定条件下充分反应,图2是 和
和 物质的量随时间的变化曲线。
物质的量随时间的变化曲线。
①相同温度下,2 mol 和1 mol
和1 mol 具有的总能量
具有的总能量___________ (填“>”“<”或“=”)2 mol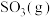 具有的总能量。
具有的总能量。
②10 min内, 的平均反应速率为
的平均反应速率为___________ ;平衡时 的转化率为
的转化率为___________ 。
③下列叙述不能判断该反应达到平衡状态的是___________ (填字母)。
A.容器中气体密度不再改变 B. 的物质的量浓度不再改变
的物质的量浓度不再改变
C. 的质量不再改变 D.
的质量不再改变 D.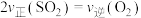
(1)工业合成氨的原理为
 。已知断开1 mol
。已知断开1 mol  、
、 、
、 键所需能量分别为436kJ、391kJ、946kJ,若有2 mol
键所需能量分别为436kJ、391kJ、946kJ,若有2 mol  生成时,
生成时,(2)一种新型催化剂能使NO和CO发生反应:
 。已知:增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示:
。已知:增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示:| 实验编号 | T/℃ | NO初始浓度/mol·L | CO初始浓度/mol·L | 催化剂的比表面积 |
| Ⅰ | 280 | 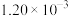 |  | 82 |
| Ⅱ | 280 | 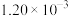 |  | 124 |
| Ⅲ | 350 | a |  | 82 |

②能验证温度对化学反应速率影响规律的实验是
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度
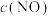 随时间t的变化曲线如图1所示,其中表示实验Ⅱ的是曲线
随时间t的变化曲线如图1所示,其中表示实验Ⅱ的是曲线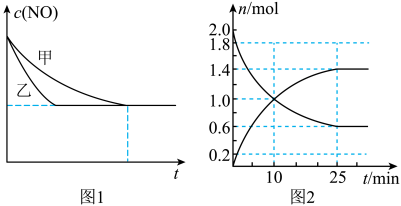
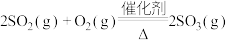 ,已知该反应为放热反应。向1 L恒容密闭容器中充入2 mol
,已知该反应为放热反应。向1 L恒容密闭容器中充入2 mol  和适当过量的
和适当过量的 ,在一定条件下充分反应,图2是
,在一定条件下充分反应,图2是 和
和 物质的量随时间的变化曲线。
物质的量随时间的变化曲线。①相同温度下,2 mol
 和1 mol
和1 mol 具有的总能量
具有的总能量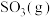 具有的总能量。
具有的总能量。②10 min内,
 的平均反应速率为
的平均反应速率为 的转化率为
的转化率为③下列叙述不能判断该反应达到平衡状态的是
A.容器中气体密度不再改变 B.
 的物质的量浓度不再改变
的物质的量浓度不再改变C.
 的质量不再改变 D.
的质量不再改变 D.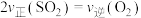
您最近一年使用:0次