1 . 请回答下列问题:
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为_______
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为_______
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为_______
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为_______
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是_______
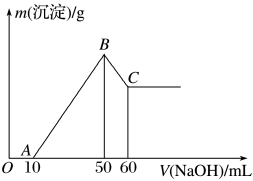
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为_______
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为

您最近一年使用:0次
2022-04-04更新
|
1306次组卷
|
3卷引用:四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题
四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题江苏省天一中学2021-2022学年高一上学期期末考试化学(强化班)试题(已下线)专题02 阿伏加德罗常数及其化学计算 (测)-2023年高考化学二轮复习讲练测(新高考专用)
解题方法
2 . 将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
(1)此时A的浓度c(A)=_______ mol/L
(2)前5min内用B表示的平均反应速率v(B)=_______ mol/(L·min);
(3)化学反应方程式中x的值为_______ 。
(1)此时A的浓度c(A)=
(2)前5min内用B表示的平均反应速率v(B)=
(3)化学反应方程式中x的值为
您最近一年使用:0次
名校
3 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
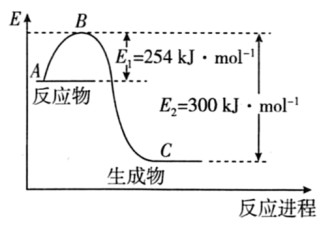
(1)如图是 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶___________
(2)若已知下列数据∶
试根据表中及图中数据计算N-H的键能∶___________ kJ·mol-1
(3)用 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知:
 ①
①
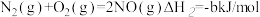 ②
②
若1mol 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3___________ kJ/mol(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:
反应I: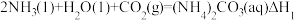
反应II: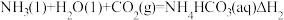
反应Ⅲ: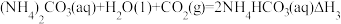
则△H3与△H1、△H2之间的关系是△H3=___________ 。
(1)如图是
 (g)和
(g)和 (g)反应生成1mol
(g)反应生成1mol (g)过程中能量的变化示意图,请写出
(g)过程中能量的变化示意图,请写出 和
和 反应的热化学方程式∶
反应的热化学方程式∶
(2)若已知下列数据∶
| 化学键 | H-H | N=N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能∶
(3)用
 催化还原NOx还可以消除氮氧化物的污染。已知:
催化还原NOx还可以消除氮氧化物的污染。已知: ①
①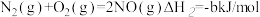 ②
②若1mol
 还原NO至
还原NO至 ,则该反应过程中的反应热△H3
,则该反应过程中的反应热△H3(4)捕碳技术(主要指捕获
 )在降低温室气体排放中具有重要的作用。目前
)在降低温室气体排放中具有重要的作用。目前 和
和 已经被用作工业捕碳剂,它们与
已经被用作工业捕碳剂,它们与 可发生如下可逆反应:
可发生如下可逆反应:反应I:
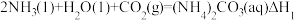
反应II:
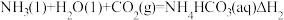
反应Ⅲ:
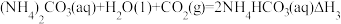
则△H3与△H1、△H2之间的关系是△H3=
您最近一年使用:0次
2021-06-20更新
|
1309次组卷
|
7卷引用:四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题
四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题四川省攀枝花市成都外国语学校2021-2022学年高二上学期10月月考化学试题(已下线)第1章 化学反应与能量(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)1.2 反应热的计算(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江苏省连云港市厉庄高级中学2022-2023学年高三上学期第一次质量检测化学试题江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年高三上学期第二次月考化学试题
解题方法
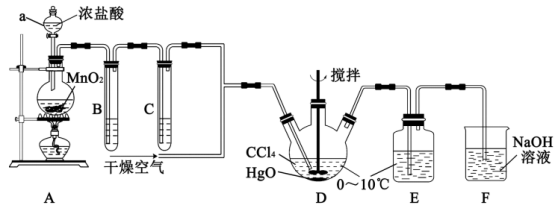
4 . 次氯酸 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备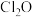 的反应原理为
的反应原理为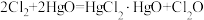 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:①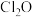 气体
气体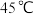 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;
②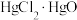 是难溶于水的固体。
是难溶于水的固体。
(1)仪器a的名称是___________ 。写出装置A中反应的离子方程式___________ 。
(2)装置B的作用是___________ ,装置C中盛装的试剂是___________ 。
(3)D中通入 与
与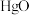 反应制得
反应制得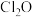 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为___________ 。
(4)有效含氯量常用来衡量消毒剂的消毒能力,用 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
①称取含氯消毒片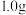 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用___________ 加蒸馏水至刻度线;
②配置 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入___________ 色试剂瓶中,置于暗处放置7~14天后,用酸性 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;
③用滴定管量取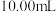 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入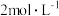 的硫酸
的硫酸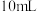 ,10%碘化钾溶液
,10%碘化钾溶液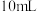 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至___________ 即为终点。记录消耗的 溶液的体积;
溶液的体积;
④重复上述操作三次。四次测定的数据如下表:
根据 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知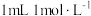 的硫代硫酸钠相当于
的硫代硫酸钠相当于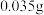 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为___________ %。
 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备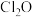 的反应原理为
的反应原理为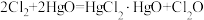 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:①
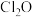 气体
气体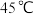 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;②
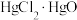 是难溶于水的固体。
是难溶于水的固体。(1)仪器a的名称是
(2)装置B的作用是
(3)D中通入
 与
与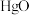 反应制得
反应制得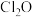 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为(4)有效含氯量常用来衡量消毒剂的消毒能力,用
 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:①称取含氯消毒片
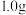 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用②配置
 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;③用滴定管量取
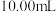 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入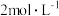 的硫酸
的硫酸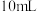 ,10%碘化钾溶液
,10%碘化钾溶液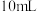 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至 溶液的体积;
溶液的体积;④重复上述操作三次。四次测定的数据如下表:
| 实验序号 | 1 | 2 | 3 | 4 |
消耗 溶液的体积/ 溶液的体积/ | 20.05 | 20.00 | 19.95 | 20.45 |
 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知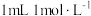 的硫代硫酸钠相当于
的硫代硫酸钠相当于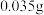 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为
您最近一年使用:0次
名校
解题方法
5 . 将20.0 g铜镁合金完全溶解于140 mL某浓度的硝酸中,得到NO2和NO的混合气体8.96 L(标准状况),当向反应后的溶液中加入320 mL 4.0 mol/L NaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为37 g。通过计算回答下列问题:
(1)该合金中铜与镁的物质的量之比是_______ 。
(2)该硝酸中HNO3的物质的量浓度是_______ mol/L。
(3)NO2和NO的混合气体中,NO2的体积分数是_______ 。
(4)若将混合气体与水混合完全转化为硝酸,则需要通入的氧气(标准状况)的体积为_______ L。
(1)该合金中铜与镁的物质的量之比是
(2)该硝酸中HNO3的物质的量浓度是
(3)NO2和NO的混合气体中,NO2的体积分数是
(4)若将混合气体与水混合完全转化为硝酸,则需要通入的氧气(标准状况)的体积为
您最近一年使用:0次
6 . 通过计算,回答下列问题:
(1)标况下6.72 L CH4分子中所含原子数与_______ gH2O分子中所含原子数相等。
(2)一定条件下,16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为____________ g/mol。
(3)等质量的OH-和H3O+中所含有的电子数之比为_____________ 。
(4)已知标况下11.2 L CO和CO2的混合气体质量为15.6g,则混合气体中CO与CO2的体积之比为__________ 。
(5)在NaCl和AlCl3的混合溶液中,Na+和Al3+的物质的量浓度之比为2:1,则2L含1mol Cl-的该溶液中,阳离子的总物质的量浓度为_______ mol/L。
(1)标况下6.72 L CH4分子中所含原子数与
(2)一定条件下,16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为
(3)等质量的OH-和H3O+中所含有的电子数之比为
(4)已知标况下11.2 L CO和CO2的混合气体质量为15.6g,则混合气体中CO与CO2的体积之比为
(5)在NaCl和AlCl3的混合溶液中,Na+和Al3+的物质的量浓度之比为2:1,则2L含1mol Cl-的该溶液中,阳离子的总物质的量浓度为
您最近一年使用:0次
名校
解题方法
7 . 100mL 6.0 mol·L-1稀硝酸,恰好使铜和氧化铜完全溶解,同时收集到标准状况下NO 2.24 L。请回答以下问题:(已知Cu:64;O:16)
(1)铜和稀硝酸反应的化学方程式:_______
(2)氧化铜和稀硝酸反应的化学方程式:_______
(3)原混合物中铜的物质的量为_______ ,氧化铜的质量为_______ 。
(1)铜和稀硝酸反应的化学方程式:
(2)氧化铜和稀硝酸反应的化学方程式:
(3)原混合物中铜的物质的量为
您最近一年使用:0次
2022-09-30更新
|
620次组卷
|
2卷引用:四川省江油中学2022-2023学年高一下学期第一次阶段考试化学试题
8 . Ⅰ.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):
请回答下列问题:
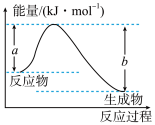
(1)如图表示某反应的能量变化关系,则此反应为___________ (填“吸收”或“放出”) ___________ kJ能量(用含有a、b的关系式表示)。
(2)反应H2(g)+ O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=___________ 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为___________ 。
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
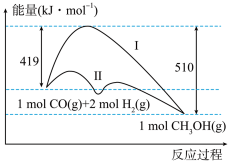
(4)计算当反应生成1.5molCH3OH(g)时,能量变化值是___________ kJ。
(5)推测反应CH3OH(g)⇌CO(g)+2H2(g)是___________ (填“吸热”或“放热”)反应。
Ⅲ.化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示:现提供以下化学键的键能(kJ·mol-1):P-P:198;P-O:360;O=O:498。
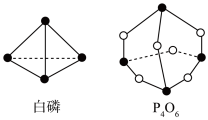
(6)则发生P4(白磷)+3O2(g)=P4O6(s)的反应,其中,生成1 mol P4O6需要___________ (“吸收或放出”)能量为___________ kJ
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/(kJ·mol-1) | 436 | 247 | x | 330 | 413 | 463 | 431 |

(1)如图表示某反应的能量变化关系,则此反应为
(2)反应H2(g)+
 O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)
 CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
(4)计算当反应生成1.5molCH3OH(g)时,能量变化值是
(5)推测反应CH3OH(g)⇌CO(g)+2H2(g)是
Ⅲ.化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示:现提供以下化学键的键能(kJ·mol-1):P-P:198;P-O:360;O=O:498。

(6)则发生P4(白磷)+3O2(g)=P4O6(s)的反应,其中,生成1 mol P4O6需要
您最近一年使用:0次
名校
9 . 20℃时,将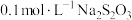 溶液与
溶液与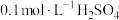 溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为:
溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为: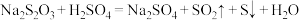 ,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?_______
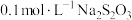 溶液与
溶液与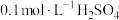 溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为:
溶液等体积混合,2min后溶液中出现明显浑浊,反应的化学方程式为: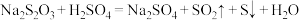 ,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
,已知温度每升高10℃,该反应的速率增大为原来的2倍。那么50℃时,同样的反应要看到同样的浑浊现象所需时间为多少?
您最近一年使用:0次
2022-11-25更新
|
457次组卷
|
3卷引用:四川省江油中学2022-2023学年高一下学期期中考试化学试题
解题方法
10 . 请回答下列问题
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+ O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为_____ kJ•mol-1(用含a、b、c的式子表示)。
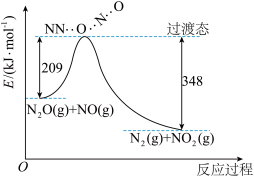
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为_____ 。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
①H2S的平衡转化率α=_____ %,反应平衡常数K=______ 。
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡______ (填“是”或“否”),此时v(正)______ v(逆)(填“>”、“<”或“=”)。
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+
 O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为

(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。①H2S的平衡转化率α=
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡
您最近一年使用:0次



