解题方法
1 . 我国《生活饮用水卫生标准》中规定生活饮用水中镉的排放量不超过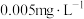 .处理含镉废水可采用化学沉淀法.试回答下列问题:
.处理含镉废水可采用化学沉淀法.试回答下列问题:
(1)磷酸镉 沉淀溶解平衡常数的表达式为
沉淀溶解平衡常数的表达式为
_______________ 。
(2)一定温度下, 的
的 ,
, 的
的 ,那么它们在水中的溶解量
,那么它们在水中的溶解量_______________ 较大。
(3)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到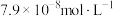 时,废水中
时,废水中 的浓度为
的浓度为_______________  [已知:
[已知: ,
, ],此时是否符合生活饮用水卫生标准?
],此时是否符合生活饮用水卫生标准?_______________ (填“是”或“否”)。
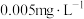 .处理含镉废水可采用化学沉淀法.试回答下列问题:
.处理含镉废水可采用化学沉淀法.试回答下列问题:(1)磷酸镉
 沉淀溶解平衡常数的表达式为
沉淀溶解平衡常数的表达式为
(2)一定温度下,
 的
的 ,
, 的
的 ,那么它们在水中的溶解量
,那么它们在水中的溶解量(3)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到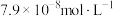 时,废水中
时,废水中 的浓度为
的浓度为 [已知:
[已知: ,
, ],此时是否符合生活饮用水卫生标准?
],此时是否符合生活饮用水卫生标准?
您最近一年使用:0次
名校
2 . 完成下列问题
(1)某温度(t℃)时,水的Kw=10-13,则该温度(填大于、等于或小于)_______ 25℃,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=_______ ;
②若所得混合溶液pH=2, 则 a:b=_______ 。
(2)在一定温度下,有a.醋酸 b.盐酸 c.硫酸 三种酸:
①同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小 的顺序是_______ ;(用a、b、c表示,下同)
②若三者c(H+)相同时,酸的物质的量浓度由大到小 的顺序为_______ ;
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小 的顺序是_______ 。
(1)某温度(t℃)时,水的Kw=10-13,则该温度(填大于、等于或小于)
①若所得混合溶液为中性,则a:b=
②若所得混合溶液pH=2, 则 a:b=
(2)在一定温度下,有a.醋酸 b.盐酸 c.硫酸 三种酸:
①同体积、同物质的量浓度的三种酸,中和NaOH的能力
②若三者c(H+)相同时,酸的物质的量浓度
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)
您最近一年使用:0次
2022-10-28更新
|
580次组卷
|
3卷引用:安徽省合肥庐巢八校2022-2023学年高二上学期12月联考化学试题
解题方法
3 . 一定温度下,在某体积为2L的密闭容器中充入1.5molNO2和2molCO,在一定条件下发生反应:NO2(g)+CO(g) CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol。
CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol。
(1)此段时间内,用CO2表示的平均反应速率_______ 。
(2)2min时,CO的转化率_______ 。
(3)平衡时,CO为1mol,求CO2的体积分数_______ 。
 CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol。
CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol。(1)此段时间内,用CO2表示的平均反应速率
(2)2min时,CO的转化率
(3)平衡时,CO为1mol,求CO2的体积分数
您最近一年使用:0次
名校
4 . 100mL 6.0 mol·L-1稀硝酸,恰好使铜和氧化铜完全溶解,同时收集到标准状况下NO 2.24 L。请回答以下问题:
(1)原混合物中铜的物质的量为___________ mol,氧化铜的物质的量为___________ mol。
(2)假设反应后溶液的体积保持不变,所得溶液溶质的物质的量浓度为___________ mol·L-1。
(3)若要将生成的NO气体完全转化为硝酸,需通氧气___________ (标准状况下)L。
(1)原混合物中铜的物质的量为
(2)假设反应后溶液的体积保持不变,所得溶液溶质的物质的量浓度为
(3)若要将生成的NO气体完全转化为硝酸,需通氧气
您最近一年使用:0次
2022-03-23更新
|
585次组卷
|
2卷引用:安徽省阜阳市太和中学2022-2023学年高一下学期第一次质量检测化学试题
名校
5 . 为了确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别滴加相同浓度盐酸50.0g,充分反应,产生CO2的质量,如表。
已知Na2CO3和盐酸反应可分成以下两步:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。
求:
(1)样品Na2CO3和NaHCO3的质量之比____ 。
(2)盐酸的质量分数____ 。
已知Na2CO3和盐酸反应可分成以下两步:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸质量(g) | 50.0 | 50.0 | 50.0 | 50.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
| CO2的质量(g) | 1.32 | 1.65 | 1.76 | 1.32 |
求:
(1)样品Na2CO3和NaHCO3的质量之比
(2)盐酸的质量分数
您最近一年使用:0次
11-12高一上·辽宁抚顺·阶段练习
名校
解题方法
6 . 常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g•cm-3的混合溶液。计算:
(1)混合后溶液中溶质的质量分数为____ 。
(2)混合后溶液中溶质的物质的量浓度为___ 。
(3)在1000g水中需溶解____ molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等。
(1)混合后溶液中溶质的质量分数为
(2)混合后溶液中溶质的物质的量浓度为
(3)在1000g水中需溶解
您最近一年使用:0次
2020-08-31更新
|
1502次组卷
|
35卷引用:安徽桐城重点中学2021-2022学年高一上学期开学教学质量检测化学试题
安徽桐城重点中学2021-2022学年高一上学期开学教学质量检测化学试题(已下线)2011-2012学年辽宁省抚顺县高中高一9月月考理科综合试题(化学部分)(已下线)2014-2015学年云南省玉溪市一中高一上学期期中化学试卷2016-2017学年北大附中河南分校高一上第一次月考化学卷2016-2017学年湖南省双峰县第一中学高一上第一次月考化学试卷2016-2017学年湖南省湘潭县第一中学高一下学期第一次模块考试化学试卷河北省定州中学2017-2018学年高一上学期开学考试化学试题河南省林州市第一中学2017-2018学年高一(普通班)10月调研化学试题甘肃省武威第五中学2017-2018学年高一上学期第一次月考化学试题四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题河北省石家庄市第一中学2017-2018学年高一上学期期中考试化学试题广东省仲元中学2017-2018学年高一上学期期中考试化学试题福建省晋江市季延中学2017-2018学年高一上学期期中考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高一上学期11月考试化学试题河北省辛集市第一中学2017-2018学年高二上学期第三次月考化学试题江苏省南通市、盐城市六校联盟2017-2018学年高一上学期期中联考(通泰)化学试题(已下线)2018年9月7日 《每日一题》人教必修1-溶液稀释或混合的计算(已下线)2018年9月16日《每日一题》人教必修1- 每周一测(已下线)2018年10月20日 《每日一题》人教必修1 - 周末培优四川省三台中学实验学校2018-2019学年高一上学期第一次月考化学试题(已下线)第16天 溶解度、溶质质量分数和物质的量浓度之间的关系——《2019年暑假作业总动员》高一化学(已下线)2019年9月6日《每日一题》 必修1 溶液稀释或混合的计算(已下线)2019年9月15日 《每日一题》必修1 —— 每周一测2019年10月19日《每日一题》2019-2020学年高一化学人教必修1——周末培优吉林省榆树市第一高级中学2019-2020学年高一上学期期中考试化学试卷四川省成都市成都外国语学校2019-2020学年高一上学期期中考试化学试题四川省成都三中2019-2020学年高一11月月考化学试题(已下线)期中模拟卷(二)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)苏教版(2020)高一必修第一册专题2第二单元突破1 物质的量浓度的有关计算人教版(2019)高一必修第一册 第二章 专题2 物质的量浓度的有关计算鲁科版(2019)高一必修第一册第1章 认识化学科学 第3节 物质的量 专题1 物质的量浓度的有关计算高一必修第一册(鲁科2019)第1章 章末综合检测卷甘肃省武威八中2020-2021学年高一上学期10月月考化学试题甘肃省民勤县第一中学2020-2021学年高一上学期第一次月考化学试题(已下线)【南昌新东方】2019 湾里一中 高一上第一次月考
7 . 有 和
和 的混合物共
的混合物共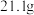 ,将其放入
,将其放入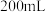 某浓度的盐酸中恰好完全反应。另取等质量该混合物与
某浓度的盐酸中恰好完全反应。另取等质量该混合物与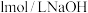 溶液反应,当混合物质量不再减少时,消耗
溶液反应,当混合物质量不再减少时,消耗 溶液
溶液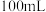 。
。
求:
(1)原混合物中 和
和 的质量各多少克
的质量各多少克_______ ?
(2)盐酸的物质的量浓度为多少_______ ?
 和
和 的混合物共
的混合物共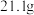 ,将其放入
,将其放入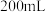 某浓度的盐酸中恰好完全反应。另取等质量该混合物与
某浓度的盐酸中恰好完全反应。另取等质量该混合物与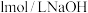 溶液反应,当混合物质量不再减少时,消耗
溶液反应,当混合物质量不再减少时,消耗 溶液
溶液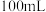 。
。求:
(1)原混合物中
 和
和 的质量各多少克
的质量各多少克(2)盐酸的物质的量浓度为多少
您最近一年使用:0次
8 . 把Cl2通入浓氨水中,发生如下反应:3Cl2+8NH3=6NH4Cl+N2
(1)用单线桥表示反应的电子转移方向和数目:_______ 。
(2)反应中发生电子转移的NH3与Cl2的分子数之比为:_______ 。
(3)若反应中有3.4克氨发生氧化反应,则反应中有生成氮气的质量为_______ 。
(4)高铁酸钠(Na2FeO4)(铁为+6 价)是一种新型的净水剂,可以通过下述反应制取:Fe(OH)3+ NaOH+NaClO—Na2FeO4+NaCl+H2O
①该反应中 (用化学式表示, 下同),还原产物为_______ ,_______ 元素被氧化。
②配平该反应的方程式并用双线桥在方程式中标出电子转移的情况:_______ 。
(1)用单线桥表示反应的电子转移方向和数目:
(2)反应中发生电子转移的NH3与Cl2的分子数之比为:
(3)若反应中有3.4克氨发生氧化反应,则反应中有生成氮气的质量为
(4)高铁酸钠(Na2FeO4)(铁为+6 价)是一种新型的净水剂,可以通过下述反应制取:Fe(OH)3+ NaOH+NaClO—Na2FeO4+NaCl+H2O
①该反应中 (用化学式表示, 下同),还原产物为
②配平该反应的方程式并用双线桥在方程式中标出电子转移的情况:
您最近一年使用:0次
名校
9 . 一定温度下,在容积为VL的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示:
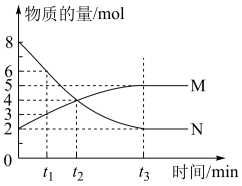
(1)该反应的化学反应方程式是___________ ;
(2) t 1到t 2时刻,以M的浓度变化表示的平均反应速率为:___________ ;
(3)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol⋅L−1⋅min−1,则此容器的容积为V=___________ L;
(4)反应A(g)+B(g) ⇌2C(g),当改变下列条件时,会加快反应速率的是___________ (填序号)
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
(5)用 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
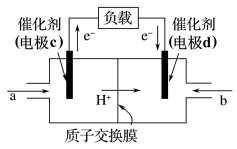
①则电极d是___________  填“正极”或“负极”),电极d的电极反应式为
填“正极”或“负极”),电极d的电极反应式为___________ ;
②若线路中转移2mol电子,则该燃料电池理论上消耗的 在标准状况下的体积为
在标准状况下的体积为___________ L。

(1)该反应的化学反应方程式是
(2) t 1到t 2时刻,以M的浓度变化表示的平均反应速率为:
(3)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol⋅L−1⋅min−1,则此容器的容积为V=
(4)反应A(g)+B(g) ⇌2C(g),当改变下列条件时,会加快反应速率的是
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
(5)用
 和
和 组合形成的质子交换膜燃料电池的结构如图:
组合形成的质子交换膜燃料电池的结构如图:
①则电极d是
 填“正极”或“负极”),电极d的电极反应式为
填“正极”或“负极”),电极d的电极反应式为②若线路中转移2mol电子,则该燃料电池理论上消耗的
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
2021-07-09更新
|
852次组卷
|
4卷引用:安徽省安庆市2020-2021学年高一下学期期末考试化学试题
12-13高三上·安徽滁州·阶段练习
名校
解题方法
10 . 在标准状况下,将224LHCl气体溶于635mL水中,所得盐酸的密度为1.18g·cm-3试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是___________ 、___________ 。
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是___________ 。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过___________ mL。
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到___________ g固体。
(1)所得盐酸的质量分数和物质的量浓度分别是
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到
您最近一年使用:0次
2021-01-11更新
|
766次组卷
|
22卷引用:2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷
(已下线)2013届安徽省来安县半塔中学高三上学期第一次月考化学试卷安徽省阜阳市第三中学2019-2020学年高一上学期期末考试化学试题安徽省六安中学2021届高三上学期开学考试化学试题(已下线)2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷2015-2016学年吉林省松原市油田高中高二下期中化学试卷2017届江西省新余一中、宜春一中高三7月联考化学试题2015-2016学年贵州省思南中学高二下学期期末化学卷(已下线)第04讲 一定物质的量浓度的溶液及其配制(精练)——2021年高考化学一轮复习讲练测(已下线)第02章 海水中的重要元素——钠和氯(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题甘肃省武威市第十八中学2021届高三上学期第一次月考化学试题黑龙江省实验中学2020-2021学年高一12月月考化学试题河南省新蔡县第一高级中学2020-2021学年高一上学期1月月考化学试题(已下线)第02讲 物质的量浓度与溶液的配制(精练)-2022年高考化学一轮复习讲练测(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点03 物质的量的浓度及溶液配制-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第02讲 物质的量浓度(练)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第一单元 化学计量在实验中的应用(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)考点03 物质的量的浓度及溶液配制-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第02讲 物质的量浓度与溶液的配制(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)



