2025高三上·全国·专题练习
1 . 已知MnO2与浓盐酸反应的化学方程式为MnO2+ 4HCl(浓) MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为___________ 。
(2)被氧化的HCl占HCl总量的___________ 。
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为___________ (设NA为阿伏加德罗常数的值)。
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成___________ g沉淀。
 MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:(1)该反应的离子方程式为
(2)被氧化的HCl占HCl总量的
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成
您最近一年使用:0次
2 . 某研究性学习小组,进行甲、乙、丙三组实验:各取 同浓度的盐酸,加入不同质量的同种铝合金颗粒,充分反应,产生气体。有关数据记录如下:
同浓度的盐酸,加入不同质量的同种铝合金颗粒,充分反应,产生气体。有关数据记录如下:
请回答以下问题:
(1)计算丙中产生气体的物质的量为___________ mol;
(2)实验中所用合金粉末中镁、铝的物质的量之比为___________ ;
(3)实验乙结束后的混合体系中加入一定量的NOH溶液,充分反应,得到固体M。如果固体M的质量不再减少,消耗NaOH的质量至少为___________ g。
 同浓度的盐酸,加入不同质量的同种铝合金颗粒,充分反应,产生气体。有关数据记录如下:
同浓度的盐酸,加入不同质量的同种铝合金颗粒,充分反应,产生气体。有关数据记录如下:| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(g) | 1.008 | 1.260 | 1.512 |
| 生成气体体积(mL)(标况) | 1075.2 | 1344 | 1344 |
(1)计算丙中产生气体的物质的量为
(2)实验中所用合金粉末中镁、铝的物质的量之比为
(3)实验乙结束后的混合体系中加入一定量的NOH溶液,充分反应,得到固体M。如果固体M的质量不再减少,消耗NaOH的质量至少为
您最近一年使用:0次
名校
解题方法
3 . 为确定某一铁铜样品中各成份的含量,某同学进行了如下实验:准确称取一份质量为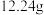 铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成
铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成 气体的体积为
气体的体积为 (已换成标准状况,假设生成的
(已换成标准状况,假设生成的 全部逸出),并测得剩余固体质量为
全部逸出),并测得剩余固体质量为 。各次实验的数据如下表:
。各次实验的数据如下表:
根据以上实验数据,请回答:
(1)上述实验当加入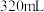 稀硝酸后,所发生反应的离子方程式为
稀硝酸后,所发生反应的离子方程式为______ 。
(2)稀硝酸的物质的量浓度为______  。
。
(3)样品中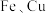 的物质的量之比为
的物质的量之比为______ 。
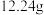 铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成
铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成 气体的体积为
气体的体积为 (已换成标准状况,假设生成的
(已换成标准状况,假设生成的 全部逸出),并测得剩余固体质量为
全部逸出),并测得剩余固体质量为 。各次实验的数据如下表:
。各次实验的数据如下表:稀硝酸体积 | 0 | 80 | 160 | 240 | 320 | 400 |
| 0 | 0.896 | 1.792 | 2.688 | 3.584 | 4.48 |
剩余固体质量 | 12.24 | 8.88 | 5.52 | 1.92 | 0 | 0 |
(1)上述实验当加入
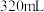 稀硝酸后,所发生反应的离子方程式为
稀硝酸后,所发生反应的离子方程式为(2)稀硝酸的物质的量浓度为
 。
。(3)样品中
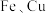 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
21-22高一上·浙江·阶段练习
解题方法
4 . 向含CuCl2和HCl的100g混合溶液中,逐滴加溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图[仅考虑沉淀为Cu(OH)2]。求:_____ 。
(2)图像中,m1=_____ 。
(3)计算M点时溶液中溶质的质量分数_____ (结果保留到0.1%)。

(2)图像中,m1=
(3)计算M点时溶液中溶质的质量分数
您最近一年使用:0次
2023高三·全国·专题练习
5 . 与K相关的计算:已知 时,
时,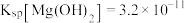 ,
,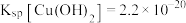 。
。
(1) 时,
时, 的溶解度为
的溶解度为_______ 。
(2)向 溶液中加入
溶液中加入 固体,要生成
固体,要生成 沉淀,溶液中
沉淀,溶液中 最小为
最小为_______ 。
(3)向浓度均为 和
和 混合液中逐滴加入
混合液中逐滴加入 溶液,先生成
溶液,先生成_______ 沉淀,当两种沉淀共存时,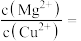
_______ 。
(4) +的水解平衡常数为
+的水解平衡常数为_______ 。
(5) ,已知
,已知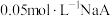 溶液
溶液 ,则
,则 的
的
_______ (近似值)。
(6) 时,向
时,向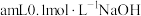 溶液中逐滴加入等浓度的
溶液中逐滴加入等浓度的 溶液
溶液 ,混合溶液恰好呈中性(体积变化忽略不计),已知
,混合溶液恰好呈中性(体积变化忽略不计),已知 的
的 ,
,
_______ 。
 时,
时,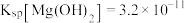 ,
,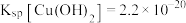 。
。(1)
 时,
时, 的溶解度为
的溶解度为(2)向
 溶液中加入
溶液中加入 固体,要生成
固体,要生成 沉淀,溶液中
沉淀,溶液中 最小为
最小为(3)向浓度均为
 和
和 混合液中逐滴加入
混合液中逐滴加入 溶液,先生成
溶液,先生成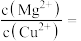
(4)
 +的水解平衡常数为
+的水解平衡常数为(5)
 ,已知
,已知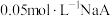 溶液
溶液 ,则
,则 的
的
(6)
 时,向
时,向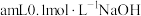 溶液中逐滴加入等浓度的
溶液中逐滴加入等浓度的 溶液
溶液 ,混合溶液恰好呈中性(体积变化忽略不计),已知
,混合溶液恰好呈中性(体积变化忽略不计),已知 的
的 ,
,
您最近一年使用:0次
6 . 将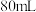 一定物质的量浓度的
一定物质的量浓度的 溶液分成A、B两等份,分别向A、B中通入物质的量不等的
溶液分成A、B两等份,分别向A、B中通入物质的量不等的 ,充分反应后,再继续向两溶液中分别逐滴加入
,充分反应后,再继续向两溶液中分别逐滴加入 的盐酸,边滴边振荡,产生的
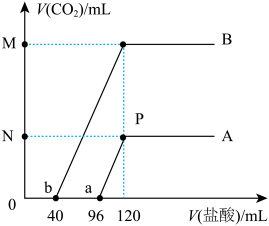
的盐酸,边滴边振荡,产生的 气体体积(假设所产生的气体全部逸出)与所加的盐酸体积之间的关系如图所示,回答下列问题:
气体体积(假设所产生的气体全部逸出)与所加的盐酸体积之间的关系如图所示,回答下列问题:
已知:①不考虑水电离出的 和
和 及
及 和
和 与水发生的反应;
与水发生的反应;
②不考虑溶液混合时引起的体积和温度的变化;
③只考虑反应过程中盐酸的酸性。
(1)由曲线A可知:
①相同状况下,
_______ 。
②P点溶液中,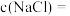
_______  (用含x的代数式表示)。
(用含x的代数式表示)。
(2)由曲线B可知:
①“ ”段发生反应的离子方程式为
”段发生反应的离子方程式为_______ 。
②向原B等份的 溶液中通入
溶液中通入 后,所得溶液中的溶质为
后,所得溶液中的溶质为_______ (填化学式),其质量之比为_______ 。
(3)若将M、N两处所产生的气体全部通入足量的某未知浓度的澄清石灰水中,所得沉淀的质量为_______ g(用含x的代数式表示,不考虑气体的逸出,下同),原 溶液中溶质的质量为
溶液中溶质的质量为_______ g。
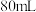 一定物质的量浓度的
一定物质的量浓度的 溶液分成A、B两等份,分别向A、B中通入物质的量不等的
溶液分成A、B两等份,分别向A、B中通入物质的量不等的 ,充分反应后,再继续向两溶液中分别逐滴加入
,充分反应后,再继续向两溶液中分别逐滴加入 的盐酸,边滴边振荡,产生的
的盐酸,边滴边振荡,产生的 气体体积(假设所产生的气体全部逸出)与所加的盐酸体积之间的关系如图所示,回答下列问题:
气体体积(假设所产生的气体全部逸出)与所加的盐酸体积之间的关系如图所示,回答下列问题:
已知:①不考虑水电离出的
 和
和 及
及 和
和 与水发生的反应;
与水发生的反应;②不考虑溶液混合时引起的体积和温度的变化;
③只考虑反应过程中盐酸的酸性。
(1)由曲线A可知:
①相同状况下,
②P点溶液中,
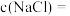
 (用含x的代数式表示)。
(用含x的代数式表示)。(2)由曲线B可知:
①“
 ”段发生反应的离子方程式为
”段发生反应的离子方程式为②向原B等份的
 溶液中通入
溶液中通入 后,所得溶液中的溶质为
后,所得溶液中的溶质为(3)若将M、N两处所产生的气体全部通入足量的某未知浓度的澄清石灰水中,所得沉淀的质量为
 溶液中溶质的质量为
溶液中溶质的质量为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
7 . 工业上,裂解正丁烷可以获得乙烯、丙烯等化工原料。
反应1:C4H10(g,正丁烷) CH4(g)+C3H6(g),ΔH1
CH4(g)+C3H6(g),ΔH1
反应2:C4H10(g,正丁烷) C2H6(g)+C2H4(g),ΔH2
C2H6(g)+C2H4(g),ΔH2
在一定温度下,向密闭容器中投入正丁烷,同时发生反应1和反应2。测得部分物质的浓度与时间的关系如下图,平衡时压强为17akPa。
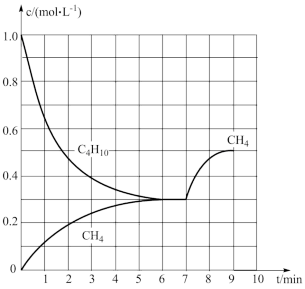
该温度下,反应1的平衡常数Kp=_______kPa。(提示:组分分压=总压×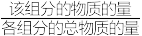 )
)
反应1:C4H10(g,正丁烷)
 CH4(g)+C3H6(g),ΔH1
CH4(g)+C3H6(g),ΔH1反应2:C4H10(g,正丁烷)
 C2H6(g)+C2H4(g),ΔH2
C2H6(g)+C2H4(g),ΔH2在一定温度下,向密闭容器中投入正丁烷,同时发生反应1和反应2。测得部分物质的浓度与时间的关系如下图,平衡时压强为17akPa。

该温度下,反应1的平衡常数Kp=_______kPa。(提示:组分分压=总压×
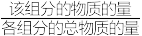 )
)
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题:
(1)已知25℃, 的
的 ,
, 的
的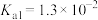 ,
,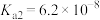 。若氨水的浓度为
。若氨水的浓度为 ,溶液中的
,溶液中的
_______  ,将
,将 通入该氨水中,当
通入该氨水中,当 降至
降至 时,溶液中的
时,溶液中的
_______ 。
(2) 可以被
可以被 溶液捕获。若所得溶液
溶液捕获。若所得溶液 ,
, 主要转化为
主要转化为_______ (写离子符号);若所得溶液 ,溶液
,溶液
_______ 。(室温下, 的
的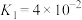 ;
; )
)
(3)在25℃下,将 的氨水与
的氨水与 的盐酸等体积混合,反应平衡时溶液中
的盐酸等体积混合,反应平衡时溶液中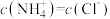 ,则溶液显性
,则溶液显性_______ (填“酸”、“碱”或“中”);用含a的代数式表示 的电离常数
的电离常数
_______ 。
(4)常温下,向一定体积的
 溶液中滴加等体积的
溶液中滴加等体积的 的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数
的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数
_______ 。
(5)已知 ,若向
,若向
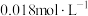 的
的 溶液中加入
溶液中加入
 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的 的浓度为
的浓度为_______  ,pH为
,pH为_______ 。
(1)已知25℃,
 的
的 ,
, 的
的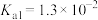 ,
,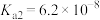 。若氨水的浓度为
。若氨水的浓度为 ,溶液中的
,溶液中的
 ,将
,将 通入该氨水中,当
通入该氨水中,当 降至
降至 时,溶液中的
时,溶液中的
(2)
 可以被
可以被 溶液捕获。若所得溶液
溶液捕获。若所得溶液 ,
, 主要转化为
主要转化为 ,溶液
,溶液
 的
的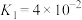 ;
; )
)(3)在25℃下,将
 的氨水与
的氨水与 的盐酸等体积混合,反应平衡时溶液中
的盐酸等体积混合,反应平衡时溶液中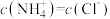 ,则溶液显性
,则溶液显性 的电离常数
的电离常数
(4)常温下,向一定体积的

 溶液中滴加等体积的
溶液中滴加等体积的 的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数
的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数
(5)已知
 ,若向
,若向
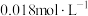 的
的 溶液中加入
溶液中加入
 的盐酸,混合后溶液中的
的盐酸,混合后溶液中的 的浓度为
的浓度为 ,pH为
,pH为
您最近一年使用:0次
2022-12-25更新
|
506次组卷
|
2卷引用:天津市耀华中学2022-2023学年高三上学期统练三 化学试题
22-23高二上·全国·课时练习
名校
解题方法
9 . 反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
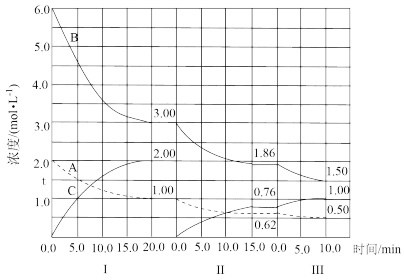
问题:
(1)反应的化学方程式中a∶b∶c为____ 。
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为____ 。
(3)B的平衡转化率αI(B)、αII(B)、αIII(B)中最小的是____ ,其值是____ 。
(4)由第一次平衡到第二次平衡,平衡向____ 移动,采取的措施是____ 。
(5)比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低;T2____ T3(填“<”“>”“=”),判断的理由是____ 。
 cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
问题:
(1)反应的化学方程式中a∶b∶c为
(2)A的平均反应速率vI(A)、vII(A)、vIII(A)从大到小排列次序为
(3)B的平衡转化率αI(B)、αII(B)、αIII(B)中最小的是
(4)由第一次平衡到第二次平衡,平衡向
(5)比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低;T2
您最近一年使用:0次
2022-10-18更新
|
1094次组卷
|
4卷引用:2.2.3 化学反应速率和化学平衡图像——同步学习必备知识
(已下线)2.2.3 化学反应速率和化学平衡图像——同步学习必备知识内蒙古包钢第一中学2022-2023学年高二上学期月考化学试题江西省赣州市十校协作2022-2023学年高二上学期期中联考化学试题河南省郑州中学2023-2024学年高三上学期第二次月考化学试题
10 . 按要求回答下列问题。
(1)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol·L-1 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入_______ mL 2 mol·L-1的盐酸(忽略加入盐酸体积)。
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为_______ 。
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=_______ 。
(4)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中 c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为_______ 。
(1)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol·L-1 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略
 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=(4)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中 c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为
您最近一年使用:0次