解题方法
1 . 工业上以氟磷灰石[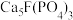 ]为原料生产磷酸二氢钾晶体和石膏,工艺流程如下:
]为原料生产磷酸二氢钾晶体和石膏,工艺流程如下: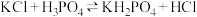 ,其中反应产生的
,其中反应产生的 易溶于有机萃取剂。
易溶于有机萃取剂。
(1)为提高酸解效率,可采取的措施为___________ 。
a.进一步粉碎矿石 b.适当增大硫酸溶液浓度 c.降低酸解温度
(2)写出氟磷灰石在酸解过程中发生的主要反应的化学方程式___________ 。
(3)操作Ⅰ是___________ ,洗涤时最好选取的洗涤剂是___________ (填“蒸馏水”或“稀硫酸”)。
(4)已知盐酸的酸性比磷酸强,但萃取过程中可以通过反应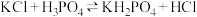 在水相里得到
在水相里得到 ,其原因是
,其原因是___________ 。
(5)为避免废水中 的污染,常在其中加入石灰,将磷元素全部转化成磷酸钙,进行回收利用。已知常温下
的污染,常在其中加入石灰,将磷元素全部转化成磷酸钙,进行回收利用。已知常温下 ,当处理后的废水中
,当处理后的废水中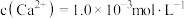 时,则溶液中
时,则溶液中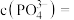
___________  。
。
(6)已知 时
时 的
的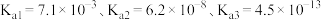 ,称取一定量
,称取一定量 ,加适量
,加适量 稀溶液溶解,加水稀释可制得
稀溶液溶解,加水稀释可制得 磷酸盐缓冲溶液。该缓冲液中含磷粒子浓度的大到小的顺序是
磷酸盐缓冲溶液。该缓冲液中含磷粒子浓度的大到小的顺序是___________ 。
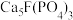 ]为原料生产磷酸二氢钾晶体和石膏,工艺流程如下:
]为原料生产磷酸二氢钾晶体和石膏,工艺流程如下: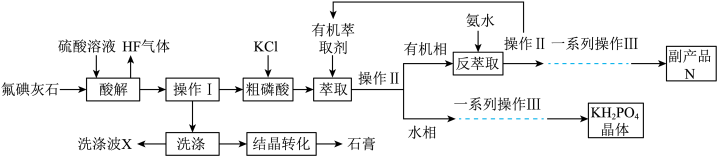
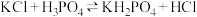 ,其中反应产生的
,其中反应产生的 易溶于有机萃取剂。
易溶于有机萃取剂。(1)为提高酸解效率,可采取的措施为
a.进一步粉碎矿石 b.适当增大硫酸溶液浓度 c.降低酸解温度
(2)写出氟磷灰石在酸解过程中发生的主要反应的化学方程式
(3)操作Ⅰ是
(4)已知盐酸的酸性比磷酸强,但萃取过程中可以通过反应
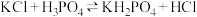 在水相里得到
在水相里得到 ,其原因是
,其原因是(5)为避免废水中
 的污染,常在其中加入石灰,将磷元素全部转化成磷酸钙,进行回收利用。已知常温下
的污染,常在其中加入石灰,将磷元素全部转化成磷酸钙,进行回收利用。已知常温下 ,当处理后的废水中
,当处理后的废水中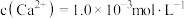 时,则溶液中
时,则溶液中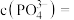
 。
。(6)已知
 时
时 的
的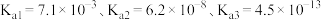 ,称取一定量
,称取一定量 ,加适量
,加适量 稀溶液溶解,加水稀释可制得
稀溶液溶解,加水稀释可制得 磷酸盐缓冲溶液。该缓冲液中含磷粒子浓度的大到小的顺序是
磷酸盐缓冲溶液。该缓冲液中含磷粒子浓度的大到小的顺序是
您最近一年使用:0次
2 . 随着生活水平的提升,人们的卫生意识日益增强,消毒剂已走进千家万户,项目小组选择了两款市面上常见的含氯消毒剂进行制备和研究。
Ⅰ.ClO2是一种高效广谱消毒剂,可有效灭活多种细菌病毒,极易溶于水,在碱性环境中稳定性较差,易分解,体积分数大于10%时可能爆炸,故工业上常用 和NaOH混合溶液吸收ClO2,将其转化为NaClO2便于运输保存。项目小组1查阅资料设计实验制备NaClO2,装置和药品如下:
和NaOH混合溶液吸收ClO2,将其转化为NaClO2便于运输保存。项目小组1查阅资料设计实验制备NaClO2,装置和药品如下:
②装置B中发生的主要: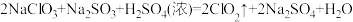
请回答下列问题:
(1)已知75%浓硫酸密度是1.67g/cm³,其物质的量浓度为_____ mol/L(保留小数点后一位)。用98%浓硫酸配制100mL该硫酸溶液,除量筒、烧杯、玻璃棒和胶头滴管之外还需要的仪器是____ 。
(2)装置B中NaClO3须稍微过量,目的是_______ 。
(3)装置C中,H2O2和NaOH与ClO2反应制取NaClO2的离子方程式为_______ ;装置C需采用冰水浴的可能原因是_______ (答出一条即可)。
Ⅱ.项目小组2探究84消毒液的性质,实验如下:
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
①向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
②向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
③测得84消毒液在不同温度时ORP随时间的变化曲线如下。_______ 。由实验③可得不同温度下ORP值不同的原因可能是_______ 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义为每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。以上三种含氯消毒剂ClO2、NaClO2、NaClO,还原产物均为Cl-,这三种含氯消毒剂的有效氯含量由大到小的顺序为_______ 。
Ⅰ.ClO2是一种高效广谱消毒剂,可有效灭活多种细菌病毒,极易溶于水,在碱性环境中稳定性较差,易分解,体积分数大于10%时可能爆炸,故工业上常用
 和NaOH混合溶液吸收ClO2,将其转化为NaClO2便于运输保存。项目小组1查阅资料设计实验制备NaClO2,装置和药品如下:
和NaOH混合溶液吸收ClO2,将其转化为NaClO2便于运输保存。项目小组1查阅资料设计实验制备NaClO2,装置和药品如下: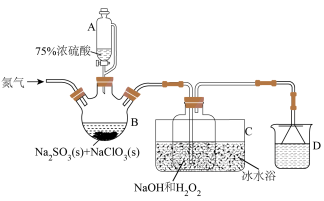
②装置B中发生的主要:
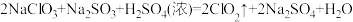
请回答下列问题:
(1)已知75%浓硫酸密度是1.67g/cm³,其物质的量浓度为
(2)装置B中NaClO3须稍微过量,目的是
(3)装置C中,H2O2和NaOH与ClO2反应制取NaClO2的离子方程式为
Ⅱ.项目小组2探究84消毒液的性质,实验如下:
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
①向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
②向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
③测得84消毒液在不同温度时ORP随时间的变化曲线如下。
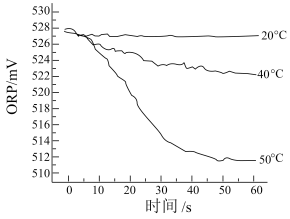
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义为每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。以上三种含氯消毒剂ClO2、NaClO2、NaClO,还原产物均为Cl-,这三种含氯消毒剂的有效氯含量由大到小的顺序为
您最近一年使用:0次
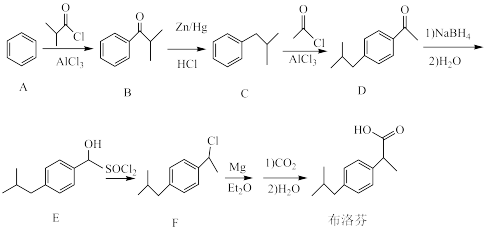
3 . 布洛芬是一种治疗关节炎的药物。一种合成布洛芬的路线如图所示:
(1)化合物A中碳的 轨道形成
轨道形成___________ 中心___________ 电子的大π键。
(2)B中官能团名称是___________ 。
(3)C→D的反应类型是___________ ;D→E中 的作用是
的作用是___________ 。
(4)2mol E和1mol 反应生成F的化学方程式为
反应生成F的化学方程式为___________ 。
(5)在B的芳香族同分异构体中,能发生银镜反应且苯环上有2个取代基的结构有___________ 种(不包括立体异构体),其中在核磁共振氢谱上有五组峰且峰的面积比为1∶1∶2∶2∶6的结构简式为___________ 。
(6)参照上述流程,以 为原料合成
为原料合成 ,设计合成路线:
,设计合成路线:___________ (其他试剂自选)。
(1)化合物A中碳的
 轨道形成
轨道形成(2)B中官能团名称是
(3)C→D的反应类型是
 的作用是
的作用是(4)2mol E和1mol
 反应生成F的化学方程式为
反应生成F的化学方程式为(5)在B的芳香族同分异构体中,能发生银镜反应且苯环上有2个取代基的结构有
(6)参照上述流程,以
 为原料合成
为原料合成 ,设计合成路线:
,设计合成路线:
您最近一年使用:0次
昨日更新
|
71次组卷
|
2卷引用:江西省稳派上进2025届高三上学期秋季入学摸底考试 化学试题
名校
解题方法
4 . 中国政府网于2020年2月17日发布了关于磷酸氯喹对感染新冠状病毒患者疗效的说明。查阅“磷酸氯喹”合成的相关文献,得到磷酸氯喹中间体合成路线如下:
②E为汽车防冻液的主要成分。
③ 。
。_______ ;
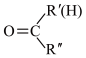
(2)C中含有的官能团的名称为_______ ;C→D的反应类型为_______ ;
(3)写出G生成H反应的化学方程式_______ 。
(4)1molJ与氢氧化钠溶液共热最多消耗_______ molNaOH;M与足量 完全加成后的产物中手性碳原子的数目为
完全加成后的产物中手性碳原子的数目为_______ 。
(5)H有多种同分异构体,满足下列条件的同分异构体的结构简式_______ (任写一种)。
①只含有两种含氧官能团
②能发生银镜反应
③1mol该物质与足量的Na反应生成
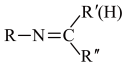
(6)参照上述合成路线及信息,设计由硝基苯和 为原料合成
为原料合成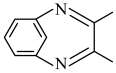 的路线(无机试剂任选)
的路线(无机试剂任选)_______ 。
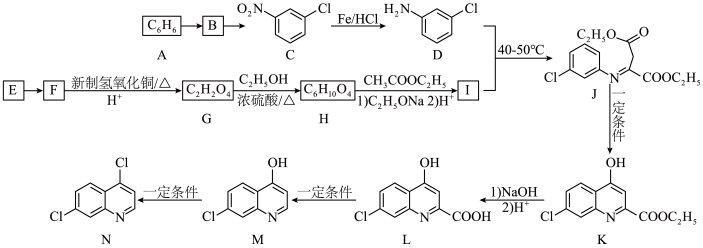
②E为汽车防冻液的主要成分。
③
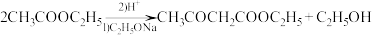 。
。④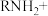

 。
。
(2)C中含有的官能团的名称为
(3)写出G生成H反应的化学方程式
(4)1molJ与氢氧化钠溶液共热最多消耗
 完全加成后的产物中手性碳原子的数目为
完全加成后的产物中手性碳原子的数目为(5)H有多种同分异构体,满足下列条件的同分异构体的结构简式
①只含有两种含氧官能团
②能发生银镜反应
③1mol该物质与足量的Na反应生成

(6)参照上述合成路线及信息,设计由硝基苯和
 为原料合成
为原料合成 的路线(无机试剂任选)
的路线(无机试剂任选)
您最近一年使用:0次
解题方法
5 . 三草酸合铁酸钾 呈翠绿色,易溶于水,难溶于乙醇,是制备活性铁催化剂的原料。用
呈翠绿色,易溶于水,难溶于乙醇,是制备活性铁催化剂的原料。用 制备三草酸合铁酸钾的过程如下:
制备三草酸合铁酸钾的过程如下:
I.向烧杯中加入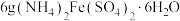 固体,加稀硫酸使其完全溶解,再加入
固体,加稀硫酸使其完全溶解,再加入 饱和
饱和 溶液,加热搅拌一段时间,冷却后得到黄色沉淀
溶液,加热搅拌一段时间,冷却后得到黄色沉淀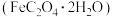 ,过滤洗涤。
,过滤洗涤。
II.向黄色沉淀中加入 饱和
饱和 溶液,加热至
溶液,加热至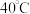 ,恒温下缓慢滴加
,恒温下缓慢滴加 溶液
溶液 ,沉淀转化为深棕色;将溶液加热至微沸
,沉淀转化为深棕色;将溶液加热至微沸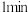 ,再加入
,再加入 饱和
饱和 溶液,沉淀完全溶解,溶液变为翠绿色;冷却后向溶液中加入无水乙醇和饱和
溶液,沉淀完全溶解,溶液变为翠绿色;冷却后向溶液中加入无水乙醇和饱和 溶液,析出晶体,过滤后用无水乙醇洗涤、抽干得到产品。
溶液,析出晶体,过滤后用无水乙醇洗涤、抽干得到产品。
回答下列问题:
(1)步骤I中生成黄色沉淀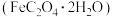 的离子方程式为
的离子方程式为___________ 。
(2)步骤II发生反应: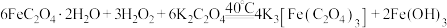
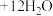 ,温度控制在
,温度控制在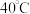 可采取的方法是
可采取的方法是___________ ;先低温加热后加热至微沸的原因是___________ 。
(3)步骤II中饱和 溶液的作用是
溶液的作用是___________ 。
(4)步骤II中过滤后用无水乙醇洗涤的目的是___________ 。
(5)称取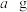 产品配成
产品配成 溶液,取
溶液,取 于锥形瓶瓶中,加混酸,水浴加热,趁热用
于锥形瓶瓶中,加混酸,水浴加热,趁热用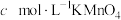 标准溶液滴定至终点,重复实验三次,平均消耗
标准溶液滴定至终点,重复实验三次,平均消耗 溶液
溶液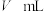 ,则产品的纯度为
,则产品的纯度为___________  (用c、V、a的式子表示,三草酸合铁酸钾的摩尔质量为
(用c、V、a的式子表示,三草酸合铁酸钾的摩尔质量为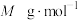 ,且杂质不反应);若滴定管未用待测液润洗,则产品纯度
,且杂质不反应);若滴定管未用待测液润洗,则产品纯度___________ (填“偏高”“偏低”或“无影响”)。
 呈翠绿色,易溶于水,难溶于乙醇,是制备活性铁催化剂的原料。用
呈翠绿色,易溶于水,难溶于乙醇,是制备活性铁催化剂的原料。用 制备三草酸合铁酸钾的过程如下:
制备三草酸合铁酸钾的过程如下:I.向烧杯中加入
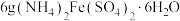 固体,加稀硫酸使其完全溶解,再加入
固体,加稀硫酸使其完全溶解,再加入 饱和
饱和 溶液,加热搅拌一段时间,冷却后得到黄色沉淀
溶液,加热搅拌一段时间,冷却后得到黄色沉淀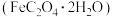 ,过滤洗涤。
,过滤洗涤。II.向黄色沉淀中加入
 饱和
饱和 溶液,加热至
溶液,加热至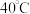 ,恒温下缓慢滴加
,恒温下缓慢滴加 溶液
溶液 ,沉淀转化为深棕色;将溶液加热至微沸
,沉淀转化为深棕色;将溶液加热至微沸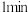 ,再加入
,再加入 饱和
饱和 溶液,沉淀完全溶解,溶液变为翠绿色;冷却后向溶液中加入无水乙醇和饱和
溶液,沉淀完全溶解,溶液变为翠绿色;冷却后向溶液中加入无水乙醇和饱和 溶液,析出晶体,过滤后用无水乙醇洗涤、抽干得到产品。
溶液,析出晶体,过滤后用无水乙醇洗涤、抽干得到产品。回答下列问题:
(1)步骤I中生成黄色沉淀
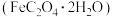 的离子方程式为
的离子方程式为(2)步骤II发生反应:
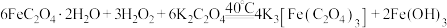
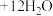 ,温度控制在
,温度控制在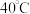 可采取的方法是
可采取的方法是(3)步骤II中饱和
 溶液的作用是
溶液的作用是(4)步骤II中过滤后用无水乙醇洗涤的目的是
(5)称取
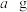 产品配成
产品配成 溶液,取
溶液,取 于锥形瓶瓶中,加混酸,水浴加热,趁热用
于锥形瓶瓶中,加混酸,水浴加热,趁热用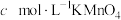 标准溶液滴定至终点,重复实验三次,平均消耗
标准溶液滴定至终点,重复实验三次,平均消耗 溶液
溶液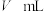 ,则产品的纯度为
,则产品的纯度为 (用c、V、a的式子表示,三草酸合铁酸钾的摩尔质量为
(用c、V、a的式子表示,三草酸合铁酸钾的摩尔质量为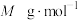 ,且杂质不反应);若滴定管未用待测液润洗,则产品纯度
,且杂质不反应);若滴定管未用待测液润洗,则产品纯度
您最近一年使用:0次
6 . 氮的氧化物是大气污染物之一,研究它们的反应机理,对于消除环境污染,促进社会可持续发展有重要意义。回答下列问题:
(1)已知:①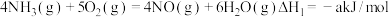 ;
;
②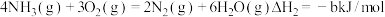 。
。
写出 与
与 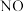 反应生成
反应生成  和
和  的热化学方程式
的热化学方程式_______ 。
(2)氢气选择性催化还原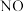 是一种比
是一种比  还原
还原 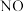 更为理想的方法,备受研究者关注。以
更为理想的方法,备受研究者关注。以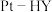 为催化剂,氢气选择性催化还原
为催化剂,氢气选择性催化还原 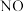 在催化剂表面的反应机理如图:
在催化剂表面的反应机理如图: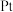 原子表面上发生的反应除
原子表面上发生的反应除 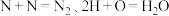 外还有
外还有_______ (不包括吸附解离过程),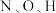 的电负性由大到小顺序为
的电负性由大到小顺序为_______ 。
(3)在密闭容器中充入 和
和  ,发生反应
,发生反应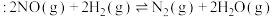
 ,平衡时
,平衡时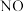 的体积分数随温度、压强的变化关系如图:
的体积分数随温度、压强的变化关系如图: 点对反应容器升温的同时缩小容器体积使体系压强增大,重新达到的平衡状态可能是图中
点对反应容器升温的同时缩小容器体积使体系压强增大,重新达到的平衡状态可能是图中  中的点
中的点 _______ 。
②下列物理量中,图中 点小于
点小于  点的是
点的是_______ 。
A.逆反应速率 B. 的体积分数 C.
的体积分数 C. 的物质的量浓度 D.平衡常数
的物质的量浓度 D.平衡常数
③ 点达平衡后,保持温度和容器体积不变,再充人
点达平衡后,保持温度和容器体积不变,再充人 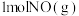 和
和  ,则平衡
,则平衡_______ (填“向左”“向右”或“不”)移动。
(4)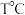 时,向容积为
时,向容积为  的恒容容器中充人
的恒容容器中充人 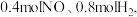 发生反应:
发生反应: ,体系的总压强
,体系的总压强  随时间
随时间  的变化如下表所示:
的变化如下表所示:
① 内该反应的平均反应速率
内该反应的平均反应速率 
_______  。
。
②该温度下反应的平衡常数
_______  (用平衡分压代替平衡浓度,平衡分压=总压
(用平衡分压代替平衡浓度,平衡分压=总压  物质的量分数)。
物质的量分数)。
(1)已知:①
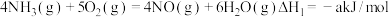 ;
;②
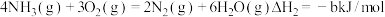 。
。写出
 与
与 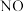 反应生成
反应生成  和
和  的热化学方程式
的热化学方程式(2)氢气选择性催化还原
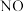 是一种比
是一种比  还原
还原 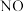 更为理想的方法,备受研究者关注。以
更为理想的方法,备受研究者关注。以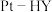 为催化剂,氢气选择性催化还原
为催化剂,氢气选择性催化还原 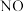 在催化剂表面的反应机理如图:
在催化剂表面的反应机理如图: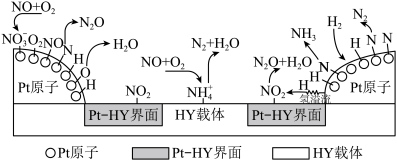
 原子表面上发生的反应除
原子表面上发生的反应除 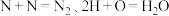 外还有
外还有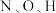 的电负性由大到小顺序为
的电负性由大到小顺序为(3)在密闭容器中充入
 和
和  ,发生反应
,发生反应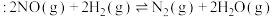
 ,平衡时
,平衡时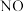 的体积分数随温度、压强的变化关系如图:
的体积分数随温度、压强的变化关系如图: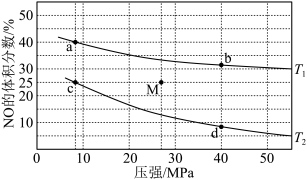
 点对反应容器升温的同时缩小容器体积使体系压强增大,重新达到的平衡状态可能是图中
点对反应容器升温的同时缩小容器体积使体系压强增大,重新达到的平衡状态可能是图中  中的点
中的点 ②下列物理量中,图中
 点小于
点小于  点的是
点的是A.逆反应速率 B.
 的体积分数 C.
的体积分数 C. 的物质的量浓度 D.平衡常数
的物质的量浓度 D.平衡常数③
 点达平衡后,保持温度和容器体积不变,再充人
点达平衡后,保持温度和容器体积不变,再充人  和
和  ,则平衡
,则平衡(4)
 时,向容积为
时,向容积为  的恒容容器中充人
的恒容容器中充人 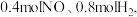 发生反应:
发生反应: ,体系的总压强
,体系的总压强  随时间
随时间  的变化如下表所示:
的变化如下表所示: | 0 | 10 | 20 | 30 | 40 |
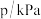 | 240 | 226 | 216 | 210 | 210 |
 内该反应的平均反应速率
内该反应的平均反应速率 
 。
。②该温度下反应的平衡常数

 (用平衡分压代替平衡浓度,平衡分压=总压
(用平衡分压代替平衡浓度,平衡分压=总压  物质的量分数)。
物质的量分数)。
您最近一年使用:0次
解题方法
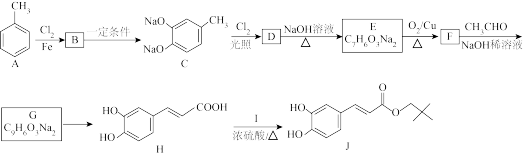
7 . 有机物J是具有扩张血管、抗脑缺血等作用的药物。以甲苯为原料合成J的路线如图所示:
(1)H所含官能团的名称为______ 。
(2)Ⅰ的结构简式为______ 。
(3)由D生成E的化学方程式为______ 。
(4)从F转化为G的过程中所涉及的两种反应类型是______ 。
(5)G→H需要先加入新制Cu(OH)2氧化,再加入过量的稀盐酸,若盐酸未过量,生成的H中可能含的有机物杂质的结构简式是______ 。
(6)X是F充分酸化后的产物,满足下列条件的X的同分异构体有______ 种(X除外,不包括立体异构体)。
①能与FeCl3溶液发生显色反应;②能发生银镜反应。
其中,核磁共振氢谱有4组峰的X的同分异构体的结构简式是______ 。
已知:RCHO+R1CH2CHO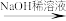
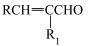 +H2O(R、R1为烃基或氢原子)
+H2O(R、R1为烃基或氢原子)
(1)H所含官能团的名称为
(2)Ⅰ的结构简式为
(3)由D生成E的化学方程式为
(4)从F转化为G的过程中所涉及的两种反应类型是
(5)G→H需要先加入新制Cu(OH)2氧化,再加入过量的稀盐酸,若盐酸未过量,生成的H中可能含的有机物杂质的结构简式是
(6)X是F充分酸化后的产物,满足下列条件的X的同分异构体有
①能与FeCl3溶液发生显色反应;②能发生银镜反应。
其中,核磁共振氢谱有4组峰的X的同分异构体的结构简式是
您最近一年使用:0次
解题方法
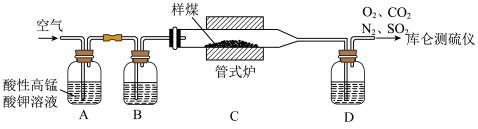
8 . 在煤中硫以有机硫和无机硫(CaSO4、硫化物及微量单质硫等)的形态存在。库仑滴定法是常用的快捷检测煤中含硫量的方法,其实验装置如图所示(煤在催化剂作用下,在管式炉中燃烧)。 I
I ),仪器便立即自动电解KI使
),仪器便立即自动电解KI使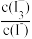 回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
回答下列问题:
(1)装置A中盛放酸性高锰酸钾溶液的作用是______ 。
(2)高温下,碳单质将CaSO4完全转化为SO2的反应中氧化剂与还原剂的物质的量之比是______ 。
(3)①SO2破坏库仑测硫仪中I2的KI溶液中KI3-KI电对的电位平衡的原因是_______ (用离子方程式表示)。
②装置D中盛放的试剂是______ ,若无装置D,造成的后果是______ 。
③库仑测硫仪中,电解过程中使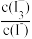 回到原定值的反应在
回到原定值的反应在______ (填“阳”或“阴”)极进行,该极的电极反应式为______ 。
 I
I ),仪器便立即自动电解KI使
),仪器便立即自动电解KI使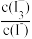 回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。回答下列问题:
(1)装置A中盛放酸性高锰酸钾溶液的作用是
(2)高温下,碳单质将CaSO4完全转化为SO2的反应中氧化剂与还原剂的物质的量之比是
(3)①SO2破坏库仑测硫仪中I2的KI溶液中KI3-KI电对的电位平衡的原因是
②装置D中盛放的试剂是
③库仑测硫仪中,电解过程中使
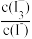 回到原定值的反应在
回到原定值的反应在
您最近一年使用:0次
9 . 铁是一种重要的金属元素,铁的单质及化合物在社会生产、生活和科学研究中应用广泛。回答下列问题:
(1)基态Fe的价层电子排布式为___________ ,其中含有的单电子数为___________ 。
(2)已知 的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则
的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则 的晶体类型为
的晶体类型为___________ ;画出 二聚体的结构式(不要求立体结构):
二聚体的结构式(不要求立体结构):___________ 。
(3)已知反式尖晶石结构晶体的通式为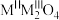 ,属于立方晶系。其晶胞中一半
,属于立方晶系。其晶胞中一半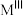 占据所有
占据所有 构成的四面体空隙,
构成的四面体空隙,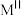 与另外一半
与另外一半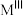 占据所有
占据所有 构成的八面体空隙。
构成的八面体空隙。 晶体为反式尖晶石结构,1个
晶体为反式尖晶石结构,1个 晶胞中,
晶胞中, 堆积共形成四面体空隙和八面体空隙的总和为24,则1个
堆积共形成四面体空隙和八面体空隙的总和为24,则1个 晶胞中
晶胞中 构成的四面体空隙的数目为
构成的四面体空隙的数目为___________ 。
(4)研究储氢材料对解决未来能源问题具有重要意义。某种Mg与Fe形成的储氢材料储氢后的晶胞结构如图所示(H原子位置未标出),晶胞参数(晶胞棱长)为a pm,H原子以正八面体、6配位的配位模式分布在Fe原子的周围,晶胞中每条棱上有2个H原子,H原子与Fe原子的最短距离为 。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为
。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为___________ %(Mg原子的填隙率 );该材料的化学式为
);该材料的化学式为___________ ;晶体中Mg原子与H原子之间的最短距离为___________ pm。
(1)基态Fe的价层电子排布式为
(2)已知
 的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则
的熔点为307.6℃,沸点为316℃,易升华,温度较低时以二聚体形式存在,Fe的配位数为4,则 的晶体类型为
的晶体类型为 二聚体的结构式(不要求立体结构):
二聚体的结构式(不要求立体结构):(3)已知反式尖晶石结构晶体的通式为
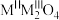 ,属于立方晶系。其晶胞中一半
,属于立方晶系。其晶胞中一半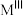 占据所有
占据所有 构成的四面体空隙,
构成的四面体空隙,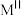 与另外一半
与另外一半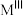 占据所有
占据所有 构成的八面体空隙。
构成的八面体空隙。 晶体为反式尖晶石结构,1个
晶体为反式尖晶石结构,1个 晶胞中,
晶胞中, 堆积共形成四面体空隙和八面体空隙的总和为24,则1个
堆积共形成四面体空隙和八面体空隙的总和为24,则1个 晶胞中
晶胞中 构成的四面体空隙的数目为
构成的四面体空隙的数目为(4)研究储氢材料对解决未来能源问题具有重要意义。某种Mg与Fe形成的储氢材料储氢后的晶胞结构如图所示(H原子位置未标出),晶胞参数(晶胞棱长)为a pm,H原子以正八面体、6配位的配位模式分布在Fe原子的周围,晶胞中每条棱上有2个H原子,H原子与Fe原子的最短距离为
 。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为
。Mg原子处于Fe原子形成的四面体空隙的中心,Mg原子的填隙率为 );该材料的化学式为
);该材料的化学式为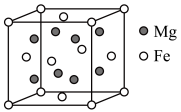
您最近一年使用:0次
7日内更新
|
5次组卷
|
2卷引用:陕西省榆林市2023-2024学年高三下学期开学理综试题-高中化学
名校
10 . I、含钌(Ru)催化剂在能源等领域应用广泛,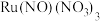 是制备负载型钌催化剂的前驱体,一种制备高级
是制备负载型钌催化剂的前驱体,一种制备高级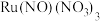 的技术路线如下。(部分试剂、步骤及反应条件略)
的技术路线如下。(部分试剂、步骤及反应条件略)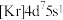 ,Ru在周期表中的位置是
,Ru在周期表中的位置是_______ ; 的空间构型为
的空间构型为_______ 。
(2)基态N原子处于最高能级的电子云轮廓图为_______ ,能量最低的激发态 的核外电子排布式为
的核外电子排布式为_______ 。
(3)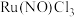 中存在配位键,用仪器测得如下图所示,则测定的仪器是_______。
中存在配位键,用仪器测得如下图所示,则测定的仪器是_______。
Ⅱ、稀土元素是指钪(Sc)、钇(Y)和镧系元素,共17种,位于元素周期表中第ⅢB族,均为金属元素,在工业生产中有重要的作用。
(4)稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA(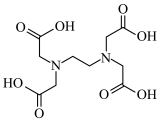 )是
)是_______ 齿配位体。
(5)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。_______ (填“ ”或“
”或“ ”)。
”)。
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是_______ 。
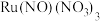 是制备负载型钌催化剂的前驱体,一种制备高级
是制备负载型钌催化剂的前驱体,一种制备高级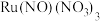 的技术路线如下。(部分试剂、步骤及反应条件略)
的技术路线如下。(部分试剂、步骤及反应条件略)
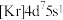 ,Ru在周期表中的位置是
,Ru在周期表中的位置是 的空间构型为
的空间构型为(2)基态N原子处于最高能级的电子云轮廓图为
 的核外电子排布式为
的核外电子排布式为(3)
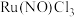 中存在配位键,用仪器测得如下图所示,则测定的仪器是_______。
中存在配位键,用仪器测得如下图所示,则测定的仪器是_______。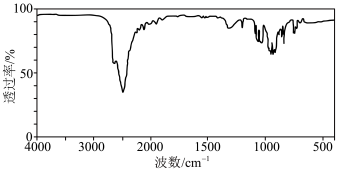
| A.质谱仪 | B.核磁共振氢谱仪 | C.红外光谱仪 | D.X射线衍射仪 |
Ⅱ、稀土元素是指钪(Sc)、钇(Y)和镧系元素,共17种,位于元素周期表中第ⅢB族,均为金属元素,在工业生产中有重要的作用。
(4)稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA(
 )是
)是(5)甘氨酸铜有顺式和反式两种同分异构体,结构如下图。
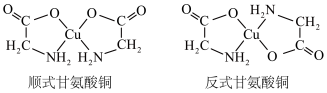
 ”或“
”或“ ”)。
”)。②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水的原因可能是
您最近一年使用:0次



