解题方法
1 . 下表是元素周期表的部分内容,请根据表中信息回答下列问题:____ 种元素。
(2)①-④的四种元素中非金属性最强的是______ (填序号)。
(3)元素②和元素④的原子中半径较大的是______ (填元素符号)。
(4)元素④的最高价氧化物对应的水化物是______ (填“强”或“弱”)酸。
(5)元素③的单质_____ (填“能”或“不能”)与水反应。
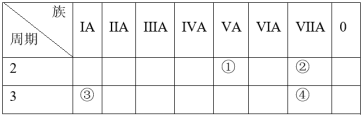
(2)①-④的四种元素中非金属性最强的是
(3)元素②和元素④的原子中半径较大的是
(4)元素④的最高价氧化物对应的水化物是
(5)元素③的单质
您最近一年使用:0次
2 . 下图是二氧化锰和浓盐酸反应制取氯气、并验证其部分化学性质的实验装置,请回答下列问题:_____ 色气体。
(2)装置 中,仪器
中,仪器 中盛装的试剂是
中盛装的试剂是_____ (填“浓硫酸”或“浓盐酸”)。
(3)当有少量氯气通过后,可观察到装置 中溶液变成
中溶液变成____ 色。
(4)当氯气持续通过时,装置 中红色鲜花颜色
中红色鲜花颜色______ 。
(5)装置 的作用是
的作用是_____ 。
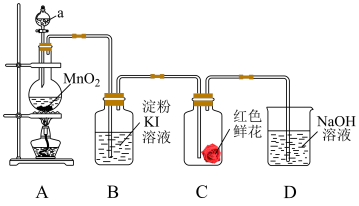
(2)装置
 中,仪器
中,仪器 中盛装的试剂是
中盛装的试剂是(3)当有少量氯气通过后,可观察到装置
 中溶液变成
中溶液变成(4)当氯气持续通过时,装置
 中红色鲜花颜色
中红色鲜花颜色(5)装置
 的作用是
的作用是
您最近一年使用:0次
2024-07-06更新
|
162次组卷
|
2卷引用:2023年吉林省普通高中学业水平合格性考试化学试卷
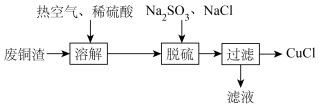
3 . 氯化亚铜(CuCl)微溶于水,易被氧化,广泛应用于医药等行业。以废铜渣(铜单质的质量分数为64%,CuO的质量分数为8%,其他杂质不含铜元素)为原料制备CuCl流程如下: 反应生成可溶于水的离子
反应生成可溶于水的离子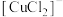 。
。
(1)用 固体配制
固体配制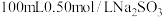 溶液时,需要的玻璃仪器有烧杯、玻璃棒、胶体滴管、
溶液时,需要的玻璃仪器有烧杯、玻璃棒、胶体滴管、________ (填仪器名称);
(2)“溶解”步骤装置如图所示。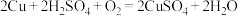 、
、________ 。通入热空气的目的是________ 。
(3)NaCl的用量对铜的沉淀率的影响如图所示。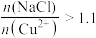 ,CuCl的沉淀率下降的原因是
,CuCl的沉淀率下降的原因是________ 。 溶液中,待样品完全溶解后过滤,将滤液及洗涤液一并转移到锥形瓶中,加入指示剂2滴,立刻滴入0.20mol/L硫酸铈[
溶液中,待样品完全溶解后过滤,将滤液及洗涤液一并转移到锥形瓶中,加入指示剂2滴,立刻滴入0.20mol/L硫酸铈[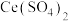 ]标准溶液,至恰好反应时,消耗
]标准溶液,至恰好反应时,消耗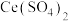 标准溶液20.00mL。(已知:
标准溶液20.00mL。(已知: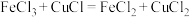 、
、 ,且杂质不参与反应。)
,且杂质不参与反应。)
计算样品中CuCl的质量分数为________ 。(写出计算过程)
 反应生成可溶于水的离子
反应生成可溶于水的离子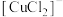 。
。(1)用
 固体配制
固体配制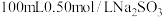 溶液时,需要的玻璃仪器有烧杯、玻璃棒、胶体滴管、
溶液时,需要的玻璃仪器有烧杯、玻璃棒、胶体滴管、(2)“溶解”步骤装置如图所示。
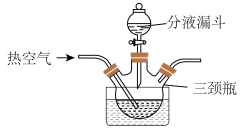
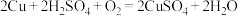 、
、(3)NaCl的用量对铜的沉淀率的影响如图所示。
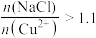 ,CuCl的沉淀率下降的原因是
,CuCl的沉淀率下降的原因是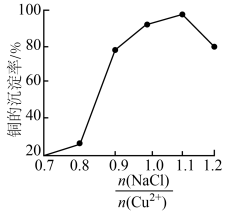
 溶液中,待样品完全溶解后过滤,将滤液及洗涤液一并转移到锥形瓶中,加入指示剂2滴,立刻滴入0.20mol/L硫酸铈[
溶液中,待样品完全溶解后过滤,将滤液及洗涤液一并转移到锥形瓶中,加入指示剂2滴,立刻滴入0.20mol/L硫酸铈[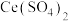 ]标准溶液,至恰好反应时,消耗
]标准溶液,至恰好反应时,消耗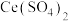 标准溶液20.00mL。(已知:
标准溶液20.00mL。(已知: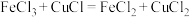 、
、 ,且杂质不参与反应。)
,且杂质不参与反应。)计算样品中CuCl的质量分数为
您最近一年使用:0次
4 .  是一种易溶于水的黄绿色气体,可用作安全高效的水处理剂,制备
是一种易溶于水的黄绿色气体,可用作安全高效的水处理剂,制备 并被吸收的原理及装置如下:
并被吸收的原理及装置如下: (主反应)
(主反应)
 (副反应)
(副反应)
(1)装置B中发生的主要反应的化学方程式为____________ 。
(2)实验过程中不断缓慢通入 的目的是
的目的是____________ 。
(3)单位体积 吸收液中含有
吸收液中含有 的质量的实验测定步骤如下:
的质量的实验测定步骤如下:
步骤1.配制 溶液:准确称取一定质量的
溶液:准确称取一定质量的 ,用新煮沸并冷却的蒸馏水配成0.08 mol/L的溶液。
,用新煮沸并冷却的蒸馏水配成0.08 mol/L的溶液。
步骤2.准确移取1.00 mL装置C中的吸收液加入锥形瓶中,加入丙二酸静置后,再加入适量硫酸及稍过量的KI溶液(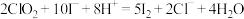 )。
)。
步骤3.向步骤2的锥形瓶的反应液中加入1mL淀粉溶液作指示剂,再向其中滴加步骤1配制的 溶液(发生反应
溶液(发生反应 ),至恰好完全反应时消耗
),至恰好完全反应时消耗 溶液20.00 mL。
溶液20.00 mL。
①配制 溶液时,蒸馏水需煮沸的原因是
溶液时,蒸馏水需煮沸的原因是____________ 。
②计算装置C中,每1.00 mL 吸收液中含有
吸收液中含有 的质量为
的质量为____________ mg。(写出计算过程)
 是一种易溶于水的黄绿色气体,可用作安全高效的水处理剂,制备
是一种易溶于水的黄绿色气体,可用作安全高效的水处理剂,制备 并被吸收的原理及装置如下:
并被吸收的原理及装置如下: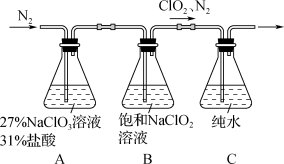
 (主反应)
(主反应) (副反应)
(副反应)(1)装置B中发生的主要反应的化学方程式为
(2)实验过程中不断缓慢通入
 的目的是
的目的是(3)单位体积
 吸收液中含有
吸收液中含有 的质量的实验测定步骤如下:
的质量的实验测定步骤如下:步骤1.配制
 溶液:准确称取一定质量的
溶液:准确称取一定质量的 ,用新煮沸并冷却的蒸馏水配成0.08 mol/L的溶液。
,用新煮沸并冷却的蒸馏水配成0.08 mol/L的溶液。步骤2.准确移取1.00 mL装置C中的吸收液加入锥形瓶中,加入丙二酸静置后,再加入适量硫酸及稍过量的KI溶液(
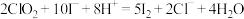 )。
)。步骤3.向步骤2的锥形瓶的反应液中加入1mL淀粉溶液作指示剂,再向其中滴加步骤1配制的
 溶液(发生反应
溶液(发生反应 ),至恰好完全反应时消耗
),至恰好完全反应时消耗 溶液20.00 mL。
溶液20.00 mL。①配制
 溶液时,蒸馏水需煮沸的原因是
溶液时,蒸馏水需煮沸的原因是②计算装置C中,每1.00 mL
 吸收液中含有
吸收液中含有 的质量为
的质量为
您最近一年使用:0次
解题方法
5 . 工业合成氨对提高农业生产意义重大。回答下列问题:_____ ( 用含
用含 和
和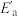 的代数式表示)。
的代数式表示)。
(2)10L密闭容器中充入 和
和 ,一定条件下反应,10min末,
,一定条件下反应,10min末, 的浓度为
的浓度为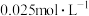 ,则0~10min时间内
,则0~10min时间内 的平均反应速率为
的平均反应速率为
_____  。此时,将容器体积压缩为5L,则达到平衡后,
。此时,将容器体积压缩为5L,则达到平衡后,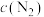
_____ (填“>”“<”或“=”) ,平衡常数K
,平衡常数K_____ (填“增大”“减小”或“不变”)。
(3)工业合成氨控制压强范围为10~30MPa,压强太低则_____ (结合速率平衡作答),压强太高对设备要求高
(4)反应物在铁催化剂表面上合成氨的反应历程可简化为图2所示,吸附在铁催化剂表面上的物种用*标注。
①该历程中能垒
_____ eV(用含a和b的代数式表示),写出该历程的化学方程式_____ 。
②铁催化合成氨时,铁表面吸附 的速率比
的速率比 快得多,则
快得多,则_____ (填“ ”或“
”或“ ”)的吸附速率决定了合成氨的整体反应速率。
”)的吸附速率决定了合成氨的整体反应速率。
③下列关于合成氨实际生产的说法正确的是_____ 。
A.选择400-500℃是因该温度下氨的平衡产率最高
B.将含 和
和 的原料气循环使用可以提高原料的转化率
的原料气循环使用可以提高原料的转化率
C.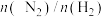 常采用1∶2.8而不是1∶3,原因是
常采用1∶2.8而不是1∶3,原因是 适度过量可加快
适度过量可加快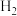 转化率
转化率
D.催化剂活性位点若被杂质气体占据,会导致 和
和 的反应速率变快
的反应速率变快

 用含
用含 和
和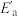 的代数式表示)。
的代数式表示)。(2)10L密闭容器中充入
 和
和 ,一定条件下反应,10min末,
,一定条件下反应,10min末, 的浓度为
的浓度为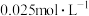 ,则0~10min时间内
,则0~10min时间内 的平均反应速率为
的平均反应速率为
 。此时,将容器体积压缩为5L,则达到平衡后,
。此时,将容器体积压缩为5L,则达到平衡后,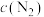
 ,平衡常数K
,平衡常数K(3)工业合成氨控制压强范围为10~30MPa,压强太低则
(4)反应物在铁催化剂表面上合成氨的反应历程可简化为图2所示,吸附在铁催化剂表面上的物种用*标注。
①该历程中能垒

②铁催化合成氨时,铁表面吸附
 的速率比
的速率比 快得多,则
快得多,则 ”或“
”或“ ”)的吸附速率决定了合成氨的整体反应速率。
”)的吸附速率决定了合成氨的整体反应速率。③下列关于合成氨实际生产的说法正确的是
A.选择400-500℃是因该温度下氨的平衡产率最高
B.将含
 和
和 的原料气循环使用可以提高原料的转化率
的原料气循环使用可以提高原料的转化率C.
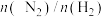 常采用1∶2.8而不是1∶3,原因是
常采用1∶2.8而不是1∶3,原因是 适度过量可加快
适度过量可加快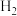 转化率
转化率D.催化剂活性位点若被杂质气体占据,会导致
 和
和 的反应速率变快
的反应速率变快
您最近一年使用:0次
6 . R是一种亲氯有机物,属于非电解质,易溶于水,在含 的溶液中能发生反应:
的溶液中能发生反应:
反应Ⅰ: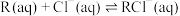 ;反应Ⅱ:
;反应Ⅱ: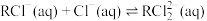
回答下列问题:
(1)写出反应Ⅰ平衡常数的表达式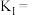
_____ 。
(2)常温下,向R溶液中加入适量NaCl,下列情况能说明反应Ⅰ和反应Ⅱ已达到平衡状态的是_____(填序号)
(3)某学习小组想研究氯水与R的反应。向水中通入 得到1L氯水(设
得到1L氯水(设 无逸出)。
无逸出)。
①写出 与
与 反应的离子方程式
反应的离子方程式_____ 。
②用pH计连续监测发现,新制氯水pH缓慢变小,原因是_____ 。
③实验测得该氯水的pH=4,计算溶液中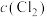 为多少?
为多少?_____ (注:写出计算过程,忽略水和HClO的电离,忽略HClO的分解)
(4)①向氯水中加入R,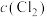 会
会_____ (填“变大”或“变小”)
②室温下,向初始浓度 的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种
的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种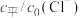 随
随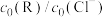 的数据记录如下表(b和d代表数字,忽略溶液体积变化):
的数据记录如下表(b和d代表数字,忽略溶液体积变化):
根据表中数据分析d=_____ 。
 的溶液中能发生反应:
的溶液中能发生反应:反应Ⅰ:
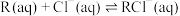 ;反应Ⅱ:
;反应Ⅱ: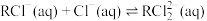
回答下列问题:
(1)写出反应Ⅰ平衡常数的表达式
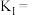
(2)常温下,向R溶液中加入适量NaCl,下列情况能说明反应Ⅰ和反应Ⅱ已达到平衡状态的是_____(填序号)
A.溶液中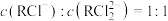 |
B.容器中生成一个R分子的同时产生一个 |
C.溶液中 不再发生变化 不再发生变化 |
| D.R的消耗速率等于生成速率 |
(3)某学习小组想研究氯水与R的反应。向水中通入
 得到1L氯水(设
得到1L氯水(设 无逸出)。
无逸出)。①写出
 与
与 反应的离子方程式
反应的离子方程式②用pH计连续监测发现,新制氯水pH缓慢变小,原因是
③实验测得该氯水的pH=4,计算溶液中
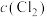 为多少?
为多少?(4)①向氯水中加入R,
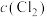 会
会②室温下,向初始浓度
 的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种
的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种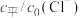 随
随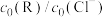 的数据记录如下表(b和d代表数字,忽略溶液体积变化):
的数据记录如下表(b和d代表数字,忽略溶液体积变化):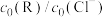 | 0 | 0.25 | 0.50 | 0.75 | 1.00 | |
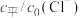 |  | 1.00 | 0.79 | 0.64 | 0.54 | 0.46 |
 | 0 | 0.09 | 0.16 | 0.22 | 0.28 | |
 | 0 | 0.06 | b | d | 0.13 | |
您最近一年使用:0次
解题方法
7 . 锂是一种重要的战略性金属,从废旧磷酸铁锂正极材料(含石墨、Al、 等,还有少量不溶性杂质)中浸取锂的工艺流程如下:
等,还有少量不溶性杂质)中浸取锂的工艺流程如下: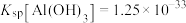 ;②
;② 。
。
(1)粉碎研磨废旧电池正极材料的目的是_____ 。
(2)完全浸出时发生主要反应的化学方程式:_____ 。
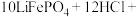 _____
_____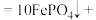 _____
_____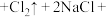 _____;
_____;
浸出时Al与酸作用的离子方程式为_____ 。
(3)滤泥中主要成分为_____ (填化学式)。
(4)当 恰好完全沉淀(浓度等于
恰好完全沉淀(浓度等于 )时,净化液中
)时,净化液中
_____ ,此时溶液pH=_____ 。
(5)沉锂后母液中可回收利用的主要物质为_____ (填名称)。
(6)已知磷酸( )为三元弱酸,“浸出”时,盐酸用量对各元素的浸出率影响如图,当盐酸用量超过1.0倍后,Fe、P元素浸出率随盐酸用量增多而增大,用平衡移动原理解释可能的原因
)为三元弱酸,“浸出”时,盐酸用量对各元素的浸出率影响如图,当盐酸用量超过1.0倍后,Fe、P元素浸出率随盐酸用量增多而增大,用平衡移动原理解释可能的原因_____ 。
 等,还有少量不溶性杂质)中浸取锂的工艺流程如下:
等,还有少量不溶性杂质)中浸取锂的工艺流程如下:
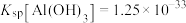 ;②
;② 。
。(1)粉碎研磨废旧电池正极材料的目的是
(2)完全浸出时发生主要反应的化学方程式:
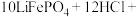 _____
_____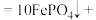 _____
_____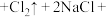 _____;
_____;浸出时Al与酸作用的离子方程式为
(3)滤泥中主要成分为
(4)当
 恰好完全沉淀(浓度等于
恰好完全沉淀(浓度等于 )时,净化液中
)时,净化液中
(5)沉锂后母液中可回收利用的主要物质为
(6)已知磷酸(
 )为三元弱酸,“浸出”时,盐酸用量对各元素的浸出率影响如图,当盐酸用量超过1.0倍后,Fe、P元素浸出率随盐酸用量增多而增大,用平衡移动原理解释可能的原因
)为三元弱酸,“浸出”时,盐酸用量对各元素的浸出率影响如图,当盐酸用量超过1.0倍后,Fe、P元素浸出率随盐酸用量增多而增大,用平衡移动原理解释可能的原因
您最近一年使用:0次
解题方法
8 . 过氧化氢( )是一种用途广泛的工业原料。回答下列问题:
)是一种用途广泛的工业原料。回答下列问题:
(1)已知:反应①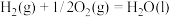
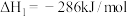
反应②
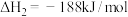
则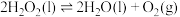 的
的
_____ kJ/mol;不同温度下 分解反应的平衡常数
分解反应的平衡常数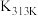
_____  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 是一种极弱的酸,在水中电离的示意图如下:
是一种极弱的酸,在水中电离的示意图如下:
①实验i和ii探究浓度对反应速率的影响,则a=_____ ,b=_____ 。
②实验_____ (填编号)探究催化剂对速率的影响,能说明催化剂加快反应速率的实验记录是_____ 。
③温度越高反应速率越快,用碰撞理论解释正确的是_____ 。
A.单位体积内活化分子数增多 B.活化分子百分数不变
C.单位体积内有效碰撞的次数增大 D.改变了反应的路径
④实验i中几乎没有收集到气体,可能原因是_____ 。
(3)写出 在生活中的一种用途
在生活中的一种用途_____ 。
 )是一种用途广泛的工业原料。回答下列问题:
)是一种用途广泛的工业原料。回答下列问题:(1)已知:反应①
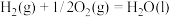
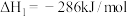
反应②

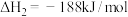
则
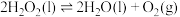 的
的
 分解反应的平衡常数
分解反应的平衡常数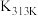
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 是一种极弱的酸,在水中电离的示意图如下:
是一种极弱的酸,在水中电离的示意图如下:| 编号 | 温度/℃ | 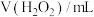 |  | 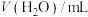 |  |
| i | 25 | 10.0 | 0 | 10.0 |  |
| ii | 25 | 15.0 | a | b |  |
| iii | 25 | 10.0 | 2.0 | c | 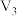 |
| iv | 60 | d | 0 | 10.0 | 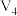 |
②实验
③温度越高反应速率越快,用碰撞理论解释正确的是
A.单位体积内活化分子数增多 B.活化分子百分数不变
C.单位体积内有效碰撞的次数增大 D.改变了反应的路径
④实验i中几乎没有收集到气体,可能原因是
(3)写出
 在生活中的一种用途
在生活中的一种用途
您最近一年使用:0次
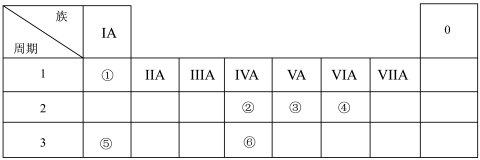
9 . 元素①~⑥在周期表中的位置如图所示。
(1)元素①单质的电子式为_______ 。
(2)元素①和④形成原子个数比为1:1的化合物的化学式为_______ ,该化合物为_______ (填“离子”或“共价”)化合物。
(3)比较元素②和③的原子半径大小_______ >_______ (填元素符号)。
(4)元素⑤的单质与水反应的化学方程式为_______ 。
(5)元素②和⑥的最高价氧化物对应的水化物中酸性较强的是_______ (填酸的名称或化学式)。
(1)元素①单质的电子式为
(2)元素①和④形成原子个数比为1:1的化合物的化学式为
(3)比较元素②和③的原子半径大小
(4)元素⑤的单质与水反应的化学方程式为
(5)元素②和⑥的最高价氧化物对应的水化物中酸性较强的是
您最近一年使用:0次
10 . 某化学反应 2A(g) ⇌B(g)+C(g)在3种不同条件下进行,B、C的起始浓度均为0.反应物 A的浓度随反应时间的变化情况见下表。
(1)实验1中,0~10 min 的平均反应速率V(A)=_______ mol/(L·min)。
(2)在实验1、2中,有一个实验使用了催化剂,判断是实验_______ (填“1”或“2”)。
(3)实验3最快可能在_______ (填“10~20”或“20~30”)min 之间达到平衡状态。下列情况能说明该反应一定达到平衡状态的是________ (填字母代号)。
A.容器内A、B、C的分子数之比为 2∶1∶1
B.生成B的速率和消耗C的速率相等
C.产物B的浓度不再发生改变
D.气体的总物质的量不再发生改变
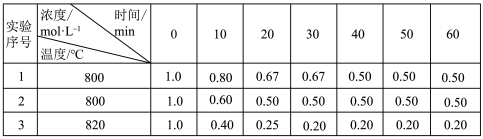
(1)实验1中,0~10 min 的平均反应速率V(A)=
(2)在实验1、2中,有一个实验使用了催化剂,判断是实验
(3)实验3最快可能在
A.容器内A、B、C的分子数之比为 2∶1∶1
B.生成B的速率和消耗C的速率相等
C.产物B的浓度不再发生改变
D.气体的总物质的量不再发生改变
您最近一年使用:0次



