名校
解题方法
1 . 向 和
和 混合溶液中滴加稀盐酸,
混合溶液中滴加稀盐酸, 的生成量与加入
的生成量与加入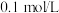 盐酸的体积的关系如图所示。下列判断正确的是
盐酸的体积的关系如图所示。下列判断正确的是
 和
和 混合溶液中滴加稀盐酸,
混合溶液中滴加稀盐酸, 的生成量与加入
的生成量与加入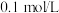 盐酸的体积的关系如图所示。下列判断正确的是
盐酸的体积的关系如图所示。下列判断正确的是
| A.在0-a范围内,只发生中和反应 |
B.ab段发生反应的离子方程式为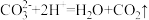 |
C. |
D.原混合溶液中 与Na2CO3的物质的量之比为 与Na2CO3的物质的量之比为 |
您最近一年使用:0次
2024-01-27更新
|
217次组卷
|
34卷引用:浙江省丽水外国语实验学校2020-2021学年高一上学期第三次月考化学试题
浙江省丽水外国语实验学校2020-2021学年高一上学期第三次月考化学试题福建省莆田二中2019-2020学年高一上学期期末检测化学试题内蒙古自治区包钢第一中学2021-2022学年高三上学期10月月考化学试题浙江省诸暨市2016-2017学年高一上学期期末考试化学试题 浙江省诸暨市2017-2018学年高二下学期期末考试化学试题 青海省湟川中学2020-2021学年高一下学期开学考试化学试题新疆巴音郭楞蒙古自治州第二中学2021届高三上学期开学摸底考试化学试题浙江省宁波市效实中学2020-2021学年高一下学期期中考试化学(学考)试题重庆市秀山高级中学校2021-2022学年高三上学期9月月考化学试题山东省滨州市惠民县第二中学致远高中部2021-2022学年高三10月月考化学试题(已下线)专题06 常见金属及其化合物-备战2022年高考化学学霸纠错(全国通用)黑龙江省鹤岗市第一中学2021-2022学年高一上学期期末考试化学试题江西省新余市2021-2022学年高一上学期期末考试化学试题江西省抚州市临川区第一中学2021-2022学年高一下学期第一次月考化学试题浙江省当湖高级中学2021-2022学年高一上学期12月阶段性测试化学试题浙江省宁波市六校2021-2022学年高一下学期期中联考化学试题黑龙江省哈尔滨市第七十三中学校2020-2021学年高二下学期期中考试化学试题(已下线)第06讲 钠及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)浙江省部分重点中学普通高中2022届高三学业水平模拟考试化学试题山东省枣庄市滕州市第一中学2022-2023学年高三上学期10月考试化学试题浙江省温州市瑞安市第六中学2021-2022学年高一下学期5月月考化学试题浙江省温州新力量联盟2022-2023学年高一上学期期中联考 化学试题上海市复兴高级中学2022-2023学年高三上学期10月月考化学试题浙江省绍兴鲁迅高级中学2021-2022学年高一上学期期中考试化学试题浙江省湖州市2022-2023学年高一上学期期末检测化学试题(已下线)第三章 金属及其化合物 第12练 Na2CO3、NaHCO3碱金属(已下线)浙江省柯桥中学2023-2024学年高一上学期期中检测化学试题 河北省石家庄市第四十二中学2023-2024学年高一上学期第二次月考化学试题 安徽省合肥市第一中学2023-2024学年高一上学期素质拓展训练(四)化学试题浙江省杭州第十一中学2023-2024学年高一上学期期中考试化学试题15-2023新东方高一上期中考化学12-2023新东方高二上期中考化学12陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题浙江省湖州市南浔高级中学2023-2024学年高一上学期十二月月考化学试题
2 . 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为________________ mol.L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______________(填字母)。
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol.L-1的稀盐酸。
①该学生需要量取_______________ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面________
b定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水________
(4)①假设该同学成功配制了0.400mol.L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取_______________ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是_______________ 。(填字母)
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g.cm-3 HCl的质量分数:36.5% |
(1)该浓盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______________(填字母)。
| A.溶液中HCl的物质的量 | B.溶液的物质的量浓度 |
| C.溶液中Cl-的数目 | D.溶液的密度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol.L-1的稀盐酸。
①该学生需要量取
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面
b定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)①假设该同学成功配制了0.400mol.L-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
2024-01-07更新
|
20次组卷
|
2卷引用:内蒙古自治区赤峰四中2021-2022学年高一上学期第一次月考化学试题
3 . 成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
| A.木已成舟 | B.蜡炬成灰 | C.铁杵成针 | D.滴水成冰 |
您最近一年使用:0次
2023-02-21更新
|
204次组卷
|
7卷引用:内蒙古呼伦贝尔市满洲里远方中学2023-2024学年高一上学期第二次考试化学试题
20-21高一上·全国·期末
4 . 已知反应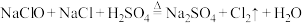 ,为探究氯气的性质,某同学设计了如图所示的实验装置。
,为探究氯气的性质,某同学设计了如图所示的实验装置。
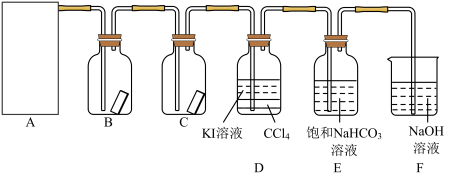
试回答下列问题:
(1)在该实验中,以下可用于制取氯气的装置是_______ (填字母)。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是_______ ,请提出合理的改进方法:_______ 。
(3)写出氯气与 溶液反应的离子方程式:
溶液反应的离子方程式:_______ ,该反应中氧化剂与还原剂的物质的量之比为_______ 。为验证尾气吸收后的溶液中存在 ,正确的操作是
,正确的操作是_______ 。
(4)氯气通入饱和 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明 与
与 反应的产物中含有
反应的产物中含有_______ (填化学式)。
 ,为探究氯气的性质,某同学设计了如图所示的实验装置。
,为探究氯气的性质,某同学设计了如图所示的实验装置。
试回答下列问题:
(1)在该实验中,以下可用于制取氯气的装置是

(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是
(3)写出氯气与
 溶液反应的离子方程式:
溶液反应的离子方程式: ,正确的操作是
,正确的操作是(4)氯气通入饱和
 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明 与
与 反应的产物中含有
反应的产物中含有
您最近一年使用:0次
2024-03-04更新
|
52次组卷
|
7卷引用:期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
(已下线)期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)第二章单元检测 (测)--2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)内蒙古自治区通辽市科尔沁左翼中旗实验高级中学2023-2024学年高一上学期1月期末化学试题重庆市巫山县官渡中学2020-2021学年高一下学期第一次月考化学试题四川省天府新区太平中学2022-2023学年高一上学期期末考试化学试题四川省宜宾市叙州区第二中学校2022-2023学年高一下学期开学考试化学试题安徽省宿州市泗县第一中学2023-2024学年高一下学期开学考试化学试题
5 . 二氧化氯( )是国际公认的新一代高效、广谱、安全杀菌保鲜剂。
)是国际公认的新一代高效、广谱、安全杀菌保鲜剂。 沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备
沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备 并转化为“稳定态二氧化氯(
并转化为“稳定态二氧化氯( )”的装置如下(夹持装置省略):
)”的装置如下(夹持装置省略):
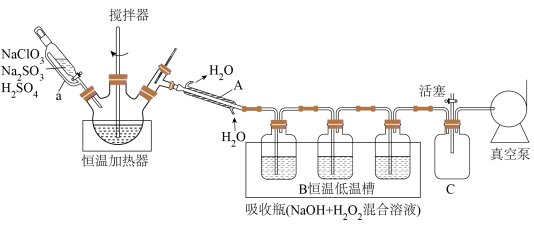
回答下列问题:
(1)仪器A的名称为___________ ,恒压分液漏斗导管a的作用是___________ ;恒温加热器内三颈瓶中发生反应生成 的化学方程式为
的化学方程式为___________ 。
(2)三个吸收瓶( 混合溶液)中发生反应的离子方程式为
混合溶液)中发生反应的离子方程式为___________ ,装置B“恒温低温槽”选择低温的原因是___________ 。
(3)装置C的作用是___________ 。
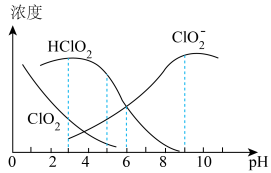
(4) 溶液中存在
溶液中存在 、
、 、
、 、
、 等四种含氧元素的微粒。经测定,25℃时
等四种含氧元素的微粒。经测定,25℃时 溶液中部分含氯元素微粒的浓度随pH变化情况如图所示(
溶液中部分含氯元素微粒的浓度随pH变化情况如图所示( 没有标出),则25℃时
没有标出),则25℃时 的电离平衡常数为
的电离平衡常数为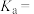
___________ ;pH=5时含氯元素的微粒浓度由大到小的关系为___________ 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为___________ g。(计算结果保留两位小数)
 )是国际公认的新一代高效、广谱、安全杀菌保鲜剂。
)是国际公认的新一代高效、广谱、安全杀菌保鲜剂。 沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备
沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备 并转化为“稳定态二氧化氯(
并转化为“稳定态二氧化氯( )”的装置如下(夹持装置省略):
)”的装置如下(夹持装置省略):
回答下列问题:
(1)仪器A的名称为
 的化学方程式为
的化学方程式为(2)三个吸收瓶(
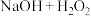 混合溶液)中发生反应的离子方程式为
混合溶液)中发生反应的离子方程式为(3)装置C的作用是
(4)
 溶液中存在
溶液中存在 、
、 、
、 、
、 等四种含氧元素的微粒。经测定,25℃时
等四种含氧元素的微粒。经测定,25℃时 溶液中部分含氯元素微粒的浓度随pH变化情况如图所示(
溶液中部分含氯元素微粒的浓度随pH变化情况如图所示( 没有标出),则25℃时
没有标出),则25℃时 的电离平衡常数为
的电离平衡常数为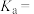

(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
解题方法
6 . 短周期主族元素X、Y、Z、W的原子序数依次增大,Y、W同主族;X元素是组成化合物最多的元素;Y元素原子的最外层电子数是次外层电子数的3倍;Z元素原子的半径是同周期元素原子中最大的。下列说法正确的是
A.原子半径: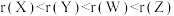 |
| B.简单气态氢化物的稳定性:Y>W |
| C.Y与Z形成的化合物中只含有离子键 |
| D.X的最高价氧化物的水化物是强酸 |
您最近一年使用:0次
解题方法
7 . 铜、锌原子结构的特殊性,决定了它们的单质及其化合物在化工生产中发挥着重要的作用,回答下列问题。
(1)基态锌原子的价电子排布式为___________ ,基态 的核外电子存在
的核外电子存在___________ 种不同的空间运动状态。
(2)当黄铜受到氨腐蚀时,会出现“龟裂”现象,生成四氨合铜配合物。
① 中各非金属元素电负性由大到小的顺序为
中各非金属元素电负性由大到小的顺序为___________ ;阴离子中心原子的杂化轨道类型是___________ ,空间构型为___________ 。
② 中
中 的键角比独立
的键角比独立 的键角
的键角___________ (填“大”“小”或“相等”),原因是___________ 。
(3) 的熔点为872℃,
的熔点为872℃, 的熔点为275℃,
的熔点为275℃, 和
和 熔点差异大的原因为
熔点差异大的原因为___________ 。
(4)立方ZnS晶体常用作半导体材料,其晶胞结构如图甲所示,密度为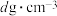 。
。
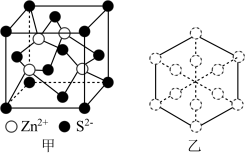
①两个S原子之间的最短距离为___________ nm(已知 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含 、d的代数式表示)。
、d的代数式表示)。
②若ZnS晶胞沿体对角线方向投影,所得的Zn原子投影外围图形为正六边形,如图乙所示,则S原子的投影外围图形为___________ 。
(1)基态锌原子的价电子排布式为
 的核外电子存在
的核外电子存在(2)当黄铜受到氨腐蚀时,会出现“龟裂”现象,生成四氨合铜配合物。
①
 中各非金属元素电负性由大到小的顺序为
中各非金属元素电负性由大到小的顺序为②
 中
中 的键角比独立
的键角比独立 的键角
的键角(3)
 的熔点为872℃,
的熔点为872℃, 的熔点为275℃,
的熔点为275℃, 和
和 熔点差异大的原因为
熔点差异大的原因为(4)立方ZnS晶体常用作半导体材料,其晶胞结构如图甲所示,密度为
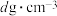 。
。
①两个S原子之间的最短距离为
 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含 、d的代数式表示)。
、d的代数式表示)。②若ZnS晶胞沿体对角线方向投影,所得的Zn原子投影外围图形为正六边形,如图乙所示,则S原子的投影外围图形为
您最近一年使用:0次
8 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.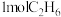 和 和 的混合物中含有的电子数是 的混合物中含有的电子数是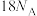 |
B.常温下,27g铝在足量浓硝酸中反应,转移的电子数为 |
C. 和 和 混合气体中含有的氧原子数为 混合气体中含有的氧原子数为 |
D.标况下,22.4L甲醇中含有的化学键数目为 |
您最近一年使用:0次
解题方法
9 . 在催化剂作用下,HCOOH分解生成 和
和 可能的反应机理如图所示。下列说法不正确的是
可能的反应机理如图所示。下列说法不正确的是
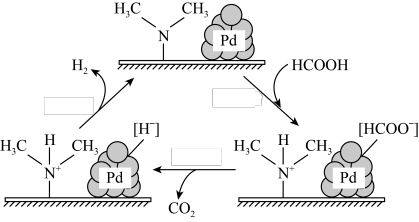
 和
和 可能的反应机理如图所示。下列说法不正确的是
可能的反应机理如图所示。下列说法不正确的是
A.该反应的总反应为 |
| B.其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳 |
| C.改变催化剂的用量和表面积,可改变化学反应速率 |
D.HCOOD在催化剂作用下可释放出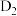 |
您最近一年使用:0次
10 . 利用太阳能等可再生能源,通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇,发生的主要反应是 ,请回答下列有关问题。
,请回答下列有关问题。
(1)常压下,二氧化碳加氢制甲醇反应时的能量变化如图1所示,则该反应的反应热
___________ 。

(2)若二氧化碳加氢制甲醇反应在恒温恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到 时刻达到平衡状态的是___________(填字母序号)。
时刻达到平衡状态的是___________(填字母序号)。
(3) ℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入
℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入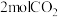 和
和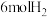 ,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
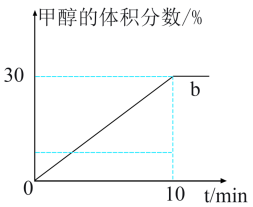
①容器b中0~10min氢气的平均反应速率
___________  ;
; ℃,反应的平衡常数为
℃,反应的平衡常数为___________ 。
②达到平衡后容器a中 的平衡转化率
的平衡转化率___________ 75%(填“>”“<”或“=”)。
③若起始时,容器b中其他条件不变,加入催化剂,则反应情况会由曲线b变为曲线c,则请在图2中画出曲线c的趋势___________ 。
(4)二氧化碳加氢制甲醇的反应历程如图3所示,方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV);其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
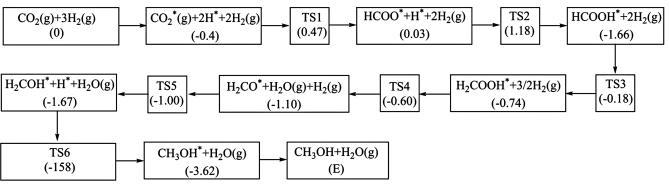
则生成甲醇的决速步骤的反应方程式为___________ 。
 ,请回答下列有关问题。
,请回答下列有关问题。(1)常压下,二氧化碳加氢制甲醇反应时的能量变化如图1所示,则该反应的反应热


(2)若二氧化碳加氢制甲醇反应在恒温恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到
 时刻达到平衡状态的是___________(填字母序号)。
时刻达到平衡状态的是___________(填字母序号)。A.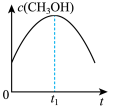 | B. | C.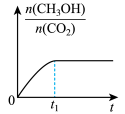 | D.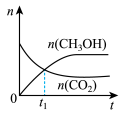 |
(3)
 ℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入
℃,在容积(均为2L)相同的a,b两个密闭容器中分别均投入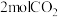 和
和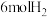 ,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
,进行二氧化碳加氢制甲醇的反应。容器a中保持压强不变,容器b保持容积不变,容器b中甲醇的体积分数与时间关系如图2所示。
①容器b中0~10min氢气的平均反应速率

 ;
; ℃,反应的平衡常数为
℃,反应的平衡常数为②达到平衡后容器a中
 的平衡转化率
的平衡转化率③若起始时,容器b中其他条件不变,加入催化剂,则反应情况会由曲线b变为曲线c,则请在图2中画出曲线c的趋势
(4)二氧化碳加氢制甲醇的反应历程如图3所示,方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV);其中,TS表示过渡态、*表示吸附在催化剂上的微粒。

则生成甲醇的决速步骤的反应方程式为
您最近一年使用:0次



