1 . 请分析下列各组物质,用序号填写出它们的对应关系:
①碳架异构、②官能团位置异构、③官能团类别异构、④顺反异构、⑤对映异构、⑥同一物(填序号)
(1)C2H5OH和CH3OCH3_____________________ ;
(2)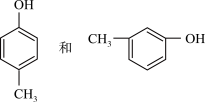
______________________ ;
(3)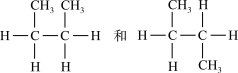
__________________ ;
(4)
________________________ ;
(5)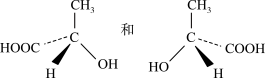
____________________________ ;
(6)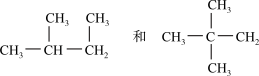
________________________________ ;
①碳架异构、②官能团位置异构、③官能团类别异构、④顺反异构、⑤对映异构、⑥同一物(填序号)
(1)C2H5OH和CH3OCH3
(2)

(3)
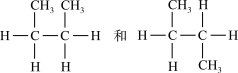
(4)

(5)

(6)
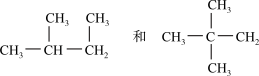
您最近一年使用:0次
2019-07-22更新
|
394次组卷
|
3卷引用:第一单元 有机化合物的结构与性质 烃(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版选修5)
(已下线)第一单元 有机化合物的结构与性质 烃(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版选修5)云南省丘北二中2018-2019学年高二下学期期末考试化学试题云南省玉溪市通海县第三中学2019-2020学年高二上学期12月月考化学试题
2 . 配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:
I.向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是______ 。
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为______ 。
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于______ (填字母代号)。
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:______ ;能使该反应发生的可能原因是______ 。
II.已知: 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色
在溶液中为黄色
(1)下列反应曾用于检测司机是否酒后驾驶:2 +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
①基态Cr原子外围电子排布图为______ ;配合物[Cr(H2O)6]3+中与Cr3+形成配位键的原子是______ (填元素符号)。
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为______ 。
(2)有下列实验:
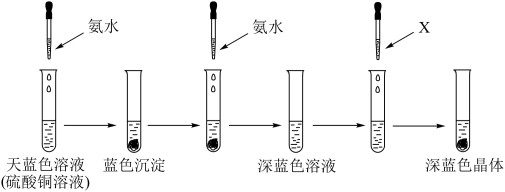
①呈天蓝色的离子的化学式为______ ,溶剂X可以是______ (填名称),继续添加氨水,沉淀溶解的离子方程式为______ 。
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是______ 。
③下列有关化学实验的“操作→现象→解释”均正确的是______ 。
I.向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:
II.已知:
 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色
在溶液中为黄色(1)下列反应曾用于检测司机是否酒后驾驶:2
 +3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH①基态Cr原子外围电子排布图为
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为
(2)有下列实验:

①呈天蓝色的离子的化学式为
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是
③下列有关化学实验的“操作→现象→解释”均正确的是
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | Fe3++3SCN-=Fe(SCN)3↓ |
| B | 向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知Cr3+的配位数为6,则 CrCl3·6H2O的化学式可表示为[Cr(H2O)5Cl]Cl2·H2O |
| C | 向溶液K2Cr2O7溶液中先滴加3滴浓硫酸,再改加10滴浓NaOH | 溶液先橙色加深,后变为黄 色 | 溶液中存在 +H2O⇌2 +H2O⇌2 +2H+ +2H+ |
| D | 向AgCl悬浊液中滴加氨水 | 沉淀溶解 | AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
您最近一年使用:0次
名校
解题方法
3 . 铜元素及其化合物在生产实际中有许多重要用途。磷化铜(Cu3P2)常用于制造磷青铜(含少量锡、磷的铜合金)。请回答下列有关问题:
(1)现代化学中,常利用_______ 上的特征谱线来鉴定元素。
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于_____ 。

(3)基态磷原子中,电子占据的最高能层符号为______ ;该能层中具有的能量最高的电子所在能级有_____ 个伸展方向,原子轨道呈_____ 形。
(4)磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为____ ;P、S的第一电离能(I1)的大小为I1(P)______ I1(S)(填“>”“<”或“=”);PH3的沸点______ (填“高于”或“低于”)NH3的沸点,原因是______ 。
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的______ 的空隙中。若晶体密度为agcm-3,则P与最近的Cu原子的核间距为______ nm(用含NA的代数式表示)。

(1)现代化学中,常利用
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于

(3)基态磷原子中,电子占据的最高能层符号为
(4)磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的

您最近一年使用:0次
2021-03-01更新
|
921次组卷
|
5卷引用:第03章 不同聚集状态的物质与性质(A卷基础强化篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)
(已下线)第03章 不同聚集状态的物质与性质(A卷基础强化篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)安徽省安庆市2021届普通高中高考模拟考试(一模)理综化学试题(已下线)3.3 金属晶体与离子晶体(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)(已下线)第1周 周测卷-备战2022年高考化学周测与晚练(新高考专用)新疆乌鲁木齐市第101中学2022-2023学年高二下学期4月期中化学试题
20-21高一下·全国·单元测试
解题方法
4 . 某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。(制取氨气的反应原理:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O)
CaCl2+2NH3↑+2H2O)

(实验探究)
(1)A装置N元素的化合价是__ 该反应是否是氧化还原反应:__ 。
(2)用5.35gNH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为___ L。(NH4Cl的摩尔质量为53.5g•mol-1)
(3)气体通过C、D装置时,试纸颜色会发生变化的是D,原因是:___ 。
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是___ 。
(5)检验氨气是否收集满的方法是___ 。
(6)某同学用如图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有__ 性质 填序号
填序号 。
。

a.还原性
b.极易溶于水
c.与水反应生成碱性物质
(7)氨气的用途很广。如可用氨气处理二氧化氮:8NH3+6NO2=7N2+12H2O该反应中氨气体现___ (填“氧化性”或“还原性”)。
 CaCl2+2NH3↑+2H2O)
CaCl2+2NH3↑+2H2O)
(实验探究)
(1)A装置N元素的化合价是
(2)用5.35gNH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为
(3)气体通过C、D装置时,试纸颜色会发生变化的是D,原因是:
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是
(5)检验氨气是否收集满的方法是
(6)某同学用如图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有
 填序号
填序号 。
。
a.还原性
b.极易溶于水
c.与水反应生成碱性物质
(7)氨气的用途很广。如可用氨气处理二氧化氮:8NH3+6NO2=7N2+12H2O该反应中氨气体现
您最近一年使用:0次
解题方法
5 . 镁单质及其化合物在电池制造储氢及大气治理等方面用途十分广泛。以硼镁泥(主要成分为 、
、 及少量
及少量 、
、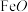 和
和 )为原料制备
)为原料制备 晶体的流程如下:
晶体的流程如下:

已知:常温下此体系中各氢氧化物开始沉淀与沉淀完全时的 如下表所示:
如下表所示:
请回答下列问题:
(1)“浸取”时,为了提高镁的浸取率可行的措施为_______ 。
a.将硼镁泥制成浆料 b.降低浸取温度 c.用盐酸多次浸取
(2)“浸取”时, 与盐酸反应的化学方程式为
与盐酸反应的化学方程式为_______ 。
(3)“氧化”步骤中工业上常用 代替
代替 ,除
,除 成本高外,还可能的原因是
成本高外,还可能的原因是_______ 。
(4)“除铁、铝”时,需调节溶液 范围为
范围为_______ ,加热煮沸的目的是_______ 。
(5)“除 ”步骤中发生反应的离子方程式为
”步骤中发生反应的离子方程式为_______ ;要从 粗品中得到纯度更高的
粗品中得到纯度更高的 晶体,可通过
晶体,可通过_______ 的方法提纯。
(6)一种镁锂双离子二次电池装置如图所示

①放电时,迁移至正极区的离子是_______ 。
②充电时,阳极的电极反应式为_______ 。
 、
、 及少量
及少量 、
、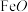 和
和 )为原料制备
)为原料制备 晶体的流程如下:
晶体的流程如下:
已知:常温下此体系中各氢氧化物开始沉淀与沉淀完全时的
 如下表所示:
如下表所示: 值 值 |  |  | 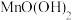 |  |  |  |
| 开始沉淀时 |  | 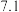 |  | 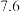 | 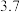 |  |
| 沉淀完全时 |  |  |  |  |  | 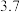 |
请回答下列问题:
(1)“浸取”时,为了提高镁的浸取率可行的措施为
a.将硼镁泥制成浆料 b.降低浸取温度 c.用盐酸多次浸取
(2)“浸取”时,
 与盐酸反应的化学方程式为
与盐酸反应的化学方程式为(3)“氧化”步骤中工业上常用
 代替
代替 ,除
,除 成本高外,还可能的原因是
成本高外,还可能的原因是(4)“除铁、铝”时,需调节溶液
 范围为
范围为(5)“除
 ”步骤中发生反应的离子方程式为
”步骤中发生反应的离子方程式为 粗品中得到纯度更高的
粗品中得到纯度更高的 晶体,可通过
晶体,可通过(6)一种镁锂双离子二次电池装置如图所示

①放电时,迁移至正极区的离子是
②充电时,阳极的电极反应式为
您最近一年使用:0次
6 . 下列关于物质特殊聚集状态的叙述中,错误的是
| A.在电场存在的情况下,液晶分子沿着电场方向有序排列 |
| B.非晶体的内部原子或分子的排列杂乱无章 |
| C.液晶最重要的用途是制造液晶显示器 |
| D.由纳米粒子构成的纳米陶瓷有极高的硬度,但低温下不具有优良的延展性 |
您最近一年使用:0次
2021-02-07更新
|
316次组卷
|
4卷引用:第03章 不同聚集状态的物质与性质(A卷基础强化篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)
(已下线)第03章 不同聚集状态的物质与性质(A卷基础强化篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)(鲁科版2019)选择性必修2 第3章 不同聚集状态的物质与性质 第3节 液晶、纳米材料与超分子鲁科版2019选择性必修2第3章 不同聚集状态的物质与性质 第3节 液晶、纳米材料与超分子3.3液晶、纳米材料与超分子(课后)-鲁科版选择性必修2
名校
7 . 钠及其化合物在化工生产和日常生活中都有广泛的用途。
Ⅰ.目前,世界多数国家采用电解熔融氯化钠的方法来生产金属钠: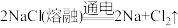 。已知物质A、B、C、D、E、F、G有如图转化关系(部分反应条件及产物已省略):
。已知物质A、B、C、D、E、F、G有如图转化关系(部分反应条件及产物已省略):

(1)写出上述转化关系中对应物质的化学式:D_______ ,E_______ 。
(2)写出物质A、B在加热条件下发生反应②的实验现象:_______ 。
(3)写出在水溶液中进行反应⑦的离子方程式为_______ 。
(4)若把物质A投入到D的水溶液中,该过程所发生反应的离子方程式为(若为分步反应则分步写离子方程式)_______
Ⅱ.部分碳酸盐是家庭常用食品膨松剂,例如蒸馒头过程中,面团在微生物作用下发酵时产生 气体,从而变得疏松,但同时也会产生一些有机弱酸,这时需要加入纯碱调节酸性。
气体,从而变得疏松,但同时也会产生一些有机弱酸,这时需要加入纯碱调节酸性。
(5)下列关于纯碱的认识正确的是_______ 。
A.受热易分解 B.水溶液显碱性 C.属于碱 D.可与酸反应
(6)探究用 调节面团酸度,而不用
调节面团酸度,而不用 的原因。取质量均为1g的
的原因。取质量均为1g的 与
与 分别与足量酸反应生成
分别与足量酸反应生成 时,消耗
时,消耗 的量更多的是
的量更多的是_______ (填化学式)。
(7)如果面团发酵得不好,气孔少且略有酸味,可改用 替代纯碱。此时
替代纯碱。此时 的作用有(请用化学方程式结合文字表述)
的作用有(请用化学方程式结合文字表述)_______ 。
Ⅰ.目前,世界多数国家采用电解熔融氯化钠的方法来生产金属钠:
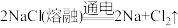 。已知物质A、B、C、D、E、F、G有如图转化关系(部分反应条件及产物已省略):
。已知物质A、B、C、D、E、F、G有如图转化关系(部分反应条件及产物已省略):
(1)写出上述转化关系中对应物质的化学式:D
(2)写出物质A、B在加热条件下发生反应②的实验现象:
(3)写出在水溶液中进行反应⑦的离子方程式为
(4)若把物质A投入到D的水溶液中,该过程所发生反应的离子方程式为(若为分步反应则分步写离子方程式)
Ⅱ.部分碳酸盐是家庭常用食品膨松剂,例如蒸馒头过程中,面团在微生物作用下发酵时产生
 气体,从而变得疏松,但同时也会产生一些有机弱酸,这时需要加入纯碱调节酸性。
气体,从而变得疏松,但同时也会产生一些有机弱酸,这时需要加入纯碱调节酸性。(5)下列关于纯碱的认识正确的是
A.受热易分解 B.水溶液显碱性 C.属于碱 D.可与酸反应
(6)探究用
 调节面团酸度,而不用
调节面团酸度,而不用 的原因。取质量均为1g的
的原因。取质量均为1g的 与
与 分别与足量酸反应生成
分别与足量酸反应生成 时,消耗
时,消耗 的量更多的是
的量更多的是(7)如果面团发酵得不好,气孔少且略有酸味,可改用
 替代纯碱。此时
替代纯碱。此时 的作用有(请用化学方程式结合文字表述)
的作用有(请用化学方程式结合文字表述)
您最近一年使用:0次
2021-03-22更新
|
1014次组卷
|
3卷引用:第二章 海水中的重要元素——钠和氯(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
(已下线)第二章 海水中的重要元素——钠和氯(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)河北省石家庄市第二中学2020-2021学年高一上学期期中考试化学试卷广东省广州市真光中学2022-2023学年高一上学期期中考化学试题
20-21高二·全国·单元测试
名校
解题方法
8 . 三氟甲磺酸用途十分广泛,是已知超强酸之一。其化学式为:CF3SO3H,下列有关说法正确的是
| A.原子半径:H<C<O<F<S |
| B.稳定性:H2S<H2O<HF |
| C.熔沸点:CH4<H2S<H2O |
| D.上述元素中F的最高价含氧酸的酸性最强 |
您最近一年使用:0次
9 . 等离子体的用途十分广泛运用等离子体束来切割金属或者进行外科手术,利用了等离子体的特点是
| A.微粒带有电荷 | B.高能量 |
| C.基本构成微粒多样化 | D.准电中性 |
您最近一年使用:0次
2021-02-01更新
|
996次组卷
|
6卷引用:第03章 不同聚集状态的物质与性质(A卷基础强化篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)
(已下线)第03章 不同聚集状态的物质与性质(A卷基础强化篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)(人教版2019)选择性必修2 第三章 晶体结构与性质 第一节 物质的聚集状态与晶体的常识2(人教版2019)选择性必修2 第三章 晶体结构与性质 第一节 物质的聚集状态与晶体的常识 第1课时 物质的聚集状态 晶体与非晶体(已下线)3.1 物质的聚集状态与晶体的常识(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)(已下线)模块十三 物质结构与性质(选修3)(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)第4节 几类其他聚集状态的物质——A学习区 夯实基础(鲁科版选修3)
名校
10 .  、
、 在医药、电子工业中用途广泛。请回答下列问题:
在医药、电子工业中用途广泛。请回答下列问题:
(1)常温时, 溶液的
溶液的 。
。
①该溶液中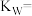
_______  ,由水电离出的
,由水电离出的
______  。
。
②该溶液中,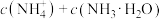
________ (填“>”“=”或“<”)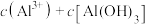 ;
;
________  。
。
(2)80℃时, 溶液的pH小于3,分析导致pH随温度变化的原因是
溶液的pH小于3,分析导致pH随温度变化的原因是_____ 。
(3)常温时,向100mL 溶液中滴加
溶液中滴加 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

①向 溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为__________ 。
②图中a、b、c、d点中水的电离程度最小的是_____________ 。
③ 溶液中各离子浓度由大到小的排列顺序是
溶液中各离子浓度由大到小的排列顺序是_____________ 。
 、
、 在医药、电子工业中用途广泛。请回答下列问题:
在医药、电子工业中用途广泛。请回答下列问题:(1)常温时,
 溶液的
溶液的 。
。①该溶液中
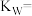
 ,由水电离出的
,由水电离出的
 。
。②该溶液中,
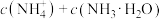
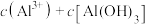 ;
;
 。
。(2)80℃时,
 溶液的pH小于3,分析导致pH随温度变化的原因是
溶液的pH小于3,分析导致pH随温度变化的原因是(3)常温时,向100mL
 溶液中滴加
溶液中滴加 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
①向
 溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为②图中a、b、c、d点中水的电离程度最小的是
③
 溶液中各离子浓度由大到小的排列顺序是
溶液中各离子浓度由大到小的排列顺序是
您最近一年使用:0次
2020-10-12更新
|
809次组卷
|
6卷引用:第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)
(已下线)第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)选择性必修1(SJ)专题3第三单元课时3 溶液中粒子浓度的大小关系四川省大竹中学2021-2022学年高二上学期期中达标测化学试题(提高卷)(已下线)3.3.4 溶液中粒子浓度的关系(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第2节 弱电解质的电离 盐类的水解 课时4 溶液中粒子浓度的大小关系人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第三节 盐类的水解 课时3 溶液中粒子浓度的大小关系



