解题方法
1 . 氮、硫、碳的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系: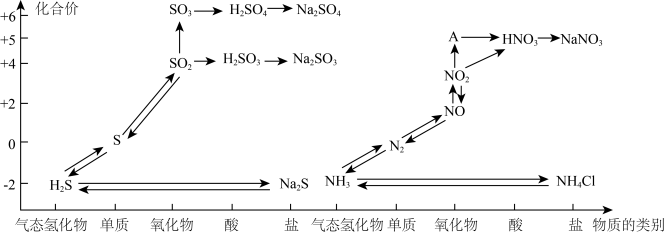
(1)根据A对应的化合价和物质类别,A为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有____________ 。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择________ ,反应的离子方程式为______________ 。
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:_______________ 。
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为_____ 。
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式_______ 。
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为____________ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为
您最近一年使用:0次
2020-05-29更新
|
741次组卷
|
2卷引用:第五章 化工生产中的重要非金属元素 单元测试
名校
解题方法
2 . 氮元素可形成丰富的化合物,在生产生活中具有广泛用途。
(1) 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为_____ ;从轨道重叠方式的角度分析 的成键,
的成键, 分子中氮原子的
分子中氮原子的_____ 轨道与氢原子的 轨道重叠形成
轨道重叠形成 键。
键。
(2) 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
_____ (填“>”或“<”) 。
。
(3) (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是_____
②比较沸点:
_____ (填“>”或“<”,下同) ,水溶性:
,水溶性:
_____  。
。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
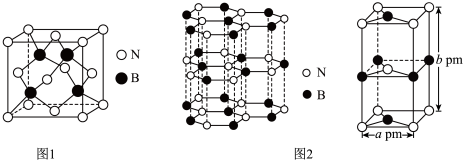
 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为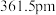 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为_____ (只列计算式) 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
_____ (列含a、b、d的计算式即可)
(1)
 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为 的成键,
的成键, 分子中氮原子的
分子中氮原子的 轨道重叠形成
轨道重叠形成 键。
键。(2)
 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
 。
。(3)
 (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②比较沸点:

 ,水溶性:
,水溶性:
 。
。(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为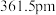 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
您最近一年使用:0次
2024-04-02更新
|
450次组卷
|
3卷引用:第三章晶体结构与性质(B卷)
解题方法
3 . 硼是一种用途广泛的工业原料,除了用于生产硼砂、硼酸和硼的各种化合物外,在制备储氢材料方面也有重要的用途,试回答下列问题:
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为___________ , 的价层电子对数是
的价层电子对数是___________ 。
(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为___________ ;基态Q原子核外成对电子数和未成对电子数之比为___________ 。
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(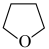 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: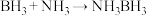 。
。
①测定晶体结构最常用的方法为___________ 。
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是___________ 。_
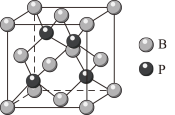
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有___________ 个;每个晶胞中的原子总数为___________ 。
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为
 的价层电子对数是
的价层电子对数是(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(
 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: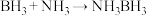 。
。①测定晶体结构最常用的方法为
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有

您最近一年使用:0次
4 . 硅、硫、氮是重要的非金属元素。回答下列问题:
(1)SiO2属于___________ (填“酸性”“碱性”或“两性”)氧化物。盛装NaOH等碱性溶液的试剂瓶不能用玻璃塞,其原因为___________ (用化学方程式表示)。
(2)工业上用石英砂和焦炭混合高温制取粗硅,其反应的化学方程式为___________ ;硅的用途有___________ (任写1个)。
(3)由SO3制备H2SO4的过程中,一般用98.3%的浓硫酸吸收SO3,而不是直接用蒸馏水吸收的原因是___________ 。
(4)实验室利用含Fe3+的溶液吸收SO2,从而实现SO2的回收利用。写出Fe3+与SO2在水溶液中发生反应的离子方程式:___________ ;每消耗32gSO2,转移电子的物质的量为___________ mol。
(5)氨气遇氯化氢时会产生白烟,写出白烟化学成分的电子式:___________ 。
(1)SiO2属于
(2)工业上用石英砂和焦炭混合高温制取粗硅,其反应的化学方程式为
(3)由SO3制备H2SO4的过程中,一般用98.3%的浓硫酸吸收SO3,而不是直接用蒸馏水吸收的原因是
(4)实验室利用含Fe3+的溶液吸收SO2,从而实现SO2的回收利用。写出Fe3+与SO2在水溶液中发生反应的离子方程式:
(5)氨气遇氯化氢时会产生白烟,写出白烟化学成分的电子式:
您最近一年使用:0次
名校
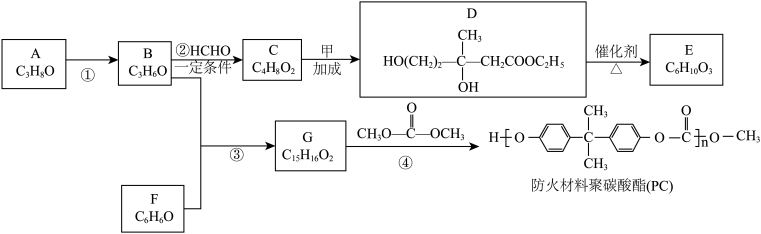
5 . A为重要的有机化工原料,B分子的核磁共振氢谱图中只有一个吸收峰,下列是合成防火材料聚碳酸酯(PC)和有广泛用途的内酯 的路线:
的路线:
已知:i: (
( 、
、 为氢原子或烃基)
为氢原子或烃基)
ii: (R、
(R、 、
、 代表烃基)
代表烃基)
请回答下列问题:
(1)A的名称为___________ 。
(2)反应①的反应类型为___________ 。
(3)C分子含有的官能团是___________ 。
(4)化合物甲的分子式为___________ 。
(5)反应④的方程式为___________ 。
(6)E分子内含有六元环,可发生水解反应,其结构简式是___________ 。
(7)X是 的同分异构体,符合下列条件的
的同分异构体,符合下列条件的 的结构简式是
的结构简式是___________ 。
①
 能与足量银氨溶液生成
能与足量银氨溶液生成
 ;
;
② 中核磁共振氢谱中出现3组吸收峰,峰面积比为
中核磁共振氢谱中出现3组吸收峰,峰面积比为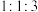 。
。
(8)以物质B为原料选用必要的无机试剂经过以下3步反应合成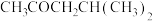 。
。
B CH3OCH2CH(CH3)2
CH3OCH2CH(CH3)2
写出中间产物1和中间产物2的结构简式:中间产物1_______ 、中间产物2________ 。
 的路线:
的路线:
已知:i:
 (
(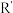 、
、 为氢原子或烃基)
为氢原子或烃基)ii:
 (R、
(R、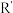 、
、 代表烃基)
代表烃基)请回答下列问题:
(1)A的名称为
(2)反应①的反应类型为
(3)C分子含有的官能团是
(4)化合物甲的分子式为
(5)反应④的方程式为
(6)E分子内含有六元环,可发生水解反应,其结构简式是
(7)X是
 的同分异构体,符合下列条件的
的同分异构体,符合下列条件的 的结构简式是
的结构简式是①

 能与足量银氨溶液生成
能与足量银氨溶液生成
 ;
;②
 中核磁共振氢谱中出现3组吸收峰,峰面积比为
中核磁共振氢谱中出现3组吸收峰,峰面积比为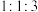 。
。(8)以物质B为原料选用必要的无机试剂经过以下3步反应合成
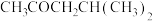 。
。B
 CH3OCH2CH(CH3)2
CH3OCH2CH(CH3)2写出中间产物1和中间产物2的结构简式:中间产物1
您最近一年使用:0次
6 . 镁及其合金是用途很广的金属材料。工业上冶炼镁的方法有两种,电解法和皮江法。电解法是电解熔融的 ,皮江法是Si在高温下还原MgO。
,皮江法是Si在高温下还原MgO。
已知:相关各物质熔点见下表:
Ⅰ.电解法冶炼镁。
化工厂利用卤水(主要成分为NaCl和 )生产金属镁的一种工艺流程如图所示:
)生产金属镁的一种工艺流程如图所示:

(1)Y与Z反应后的产物溶于水可得X溶液,从而实现了Y的再利用,则Z的化学式为___________ 。
(2)“沉淀”中除 外,还可能含有的杂质为
外,还可能含有的杂质为___________ (填化学式)。
(3)工业上不用电解MgO制金属镁的原因为___________ 。
Ⅱ.皮江法冶炼镁,工业流程如下:
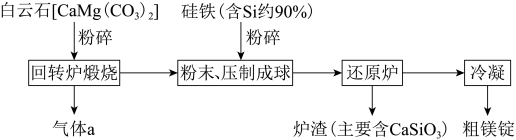
(4)气体a为___________ (填化学式)。
(5)白云石煅烧前粉碎的目的为___________ 。
(6)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有___________ 、 。
。
 ,皮江法是Si在高温下还原MgO。
,皮江法是Si在高温下还原MgO。已知:相关各物质熔点见下表:
| 物质 | MgO |  | Mg | Si |
| 熔点 | 2852 | 714 | 649 | 1410 |
化工厂利用卤水(主要成分为NaCl和
 )生产金属镁的一种工艺流程如图所示:
)生产金属镁的一种工艺流程如图所示:
(1)Y与Z反应后的产物溶于水可得X溶液,从而实现了Y的再利用,则Z的化学式为
(2)“沉淀”中除
 外,还可能含有的杂质为
外,还可能含有的杂质为(3)工业上不用电解MgO制金属镁的原因为
Ⅱ.皮江法冶炼镁,工业流程如下:

(4)气体a为
(5)白云石煅烧前粉碎的目的为
(6)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有
 。
。
您最近一年使用:0次
2022-07-14更新
|
802次组卷
|
7卷引用:第八章 化学与可持续发展【单元测试B卷】
(已下线)第八章 化学与可持续发展【单元测试B卷】(已下线)第八章 化学与可持续发展(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)河北省石家庄市2021-2022学年高一下学期期末考试化学试题(已下线)期末模拟预测卷A-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)吉林省长春外国语学校2022-2023学年高一下学期6月月考化学试题 青海省西宁市2022-2023学年高一下学期期末考试化学试题湖南省南雅中学2023-2024学年高二上学期第一次月考化学试题
7 . 自然界中不存在氟的单质,得到单质氟的过程中,不少科学家为此献出了宝贵的生命.1886年,法国化学家莫瓦桑发明了莫氏电炉,用电解法成功地制取了单质氟,因此荣获1906年诺贝尔化学奖,氟及其化合物在生产及生活中有着广泛的用途。
请回答下列问题:
(1)氟磷灰石可用于制取磷肥,其中 原子的L层电子排布式为
原子的L层电子排布式为_______ .基态P原子有_______ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为_______ 。
(2)氟气可以用于制取情性强于 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。
① 分子的空间结构为
分子的空间结构为_______ 。
②S、P、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为_______ 。
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯,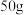 四氟乙烯含
四氟乙烯含 键的数目为
键的数目为_______
(4)工业上电解 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石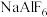 降低
降低 的熔点.
的熔点. 、
、 、F的电负性由小到大的顺序为
、F的电负性由小到大的顺序为_______ ,工业上不用电解 制取铝的原因为
制取铝的原因为_______ 。
请回答下列问题:
(1)氟磷灰石可用于制取磷肥,其中
 原子的L层电子排布式为
原子的L层电子排布式为 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取情性强于
 的保护气
的保护气 ,也可以用于制取聚合反应的催化剂
,也可以用于制取聚合反应的催化剂 ,
, 可以作为工业制取硅单质的中间物质(
可以作为工业制取硅单质的中间物质( )的原料。
)的原料。①
 分子的空间结构为
分子的空间结构为②S、P、
 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯,
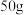 四氟乙烯含
四氟乙烯含 键的数目为
键的数目为(4)工业上电解
 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石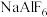 降低
降低 的熔点.
的熔点. 、
、 、F的电负性由小到大的顺序为
、F的电负性由小到大的顺序为 制取铝的原因为
制取铝的原因为
您最近一年使用:0次
2021-02-06更新
|
1152次组卷
|
4卷引用:第二章分子结构与性质(B卷)
名校
8 . 下列有关功能高分子材料的用途的叙述中,不正确的是( )
| A.高吸水性树脂主要用于干旱地区抗旱保水、改良土壤、改造沙漠 |
| B.离子交换树脂主要用于分离和提纯物质 |
| C.医用高分子材料可用于制造医用器械和人造器官 |
| D.聚乙炔膜可用于分离工业废水和海水淡化 |
您最近一年使用:0次
2016-12-09更新
|
712次组卷
|
12卷引用:第五章单元专项提升
(已下线)第五章单元专项提升2020年人教版高二化学选修5有机化学第五章《进入合成高分子时代》练习3-12015-2016学年山西省右玉一中高二下学期期中考试化学试卷人教版2017-2018学年高二化学同步练习:选修五 5-3 功能高分子材料1河南省安阳市第一中学2019-2020学年高二下学期阶段性测试化学试题高二选择性必修3(人教版2019)第五章 合成高分子 第二节 高分子材料 课时2 功能高分子材料宁夏银川市第二中学2021-2022学年高二上学期期末考试化学试题(已下线)第27讲 高分子材料(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)(已下线)考点43 合成高分子-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)【知识图鉴】单元讲练测选择性必修3第5单元01讲核心(已下线)合成高分子——课时2高分子材料3.3合成高分子化合物(课前)-鲁科版选择性必修3



