1 . 根据下图所示转化关系判断下列说法中正确的是
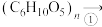 葡萄糖
葡萄糖 乙醇
乙醇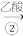 乙酸乙酯
乙酸乙酯
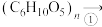 葡萄糖
葡萄糖 乙醇
乙醇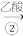 乙酸乙酯
乙酸乙酯A.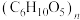 可以是淀粉或纤维素,二者均属于多糖,互为同分异构体 可以是淀粉或纤维素,二者均属于多糖,互为同分异构体 |
| B.可以利用银镜反应证明葡萄糖为还原糖 |
| C.酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸 |
| D.向反应②得到的混合物中加入饱和氢氧化钠溶液振荡、静置后分液可得到纯净的乙酸乙酯 |
您最近一年使用:0次
2 . 某学习小组设计的蔗糖水解反应如图所示(夹持装置省略)。下列说法错误的是( )
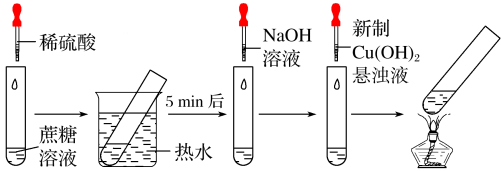

| A.稀硫酸和热水浴都能加快蔗糖水解速率 |
| B.滴加NaOH溶液的目的是调溶液的pH至碱性 |
| C.加热至沸腾后试管内生成黑色沉淀 |
| D.实验现象证明蔗糖水解有还原性物质生成 |
您最近一年使用:0次
2020-06-01更新
|
660次组卷
|
16卷引用:第四章 生物大分子(B卷)
(已下线)第四章 生物大分子(B卷)四川省宜宾市普通高中2020届高三高考适应性考试(三诊)理综-化学试题四川省攀枝花市第十五中学校2019-2020学年高二期末模拟考试化学试卷湖南省长沙县第九中学2019-2020学年高二下学期期末检测化学试题(已下线)4.2 糖类(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版选修5)江西省抚州市南城一中2020-2021学年高二下学期期中联考化学试题(已下线)考向31 生命中的的基础化学物质 有机合成高分子-备战2022年高考化学一轮复习考点微专题专题6 生命活动的物质基础——糖类、油脂、蛋白质 第一单元 糖类和油脂 第1课时 糖类第四章 本章复习提升山东省菏泽市单县第二中学2021-2022学年高二下学期四月月考化学试题(已下线)易错点30 大分子和高分子-备战2023年高考化学考试易错题(已下线)第一部分 二轮专题突破 专题19 有机选择题题型分析(已下线)第九章 有机化学基础 必做实验提升(七) 有机化合物中常见官能团的检验6.1.1糖类 课后黑龙江省双鸭山市第一中学2022-2023学年高二下学期期末考试化学试题河南省焦作市博爱县第一中学2022-2023学年高三下学期5月月考化学试题
解题方法
3 . 酶在生物活动中起着至关重要的作用,某实验小组为了证明酶的催化作用具有专一性,现设计实验如下:

①在试管A、B中分别加入2 mL 1%的淀粉溶液,试管C、D中分别加入2 mL 2%的蔗糖溶液。
②在试管A、C中再分别加入2 mL稀释唾液,试管B、D中再分别加入2 mL蒸馏水。
③将A、B、C、D四支试管放在37 ℃温水中保温10~15 min。
④然后在四支试管中分别加入新制的Cu(OH)2,加热煮沸。
试回答下列问题。
(1)写出淀粉在唾液作用下发生反应生成二糖的化学方程式:
(2)如何证明淀粉已经完全水解?
(3)第④步实验后,A、B、C、D四支试管中能生成砖红色沉淀的是
您最近一年使用:0次
名校
解题方法
4 . 某化学兴趣小组设计了研究溴苯制备原理并检验产物的实验,部分物质数据如下:苯密度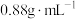 ,沸点
,沸点 ℃:溴苯密度
℃:溴苯密度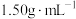 ,沸点
,沸点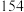 ℃。请回答下列问题:
℃。请回答下列问题:
I.粗溴苯的制备
按如图所示的装置连接好各仪器,经检查气密性良好后,加入相应试剂。_______ 。
(2)溴苯的制备需在无水条件下进行,原因是_______ 。
(3)装置丙中应该盛装_______ (填试剂名称)。能够证明该反应为取代反应的实验现象为_______ ;若撤去装置丙,_______ (填“能”或“不能”)证明该反应为取代反应。
Ⅱ.溴苯的精制如下图所示: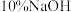 溶液洗涤时,反应的离子方程式为
溶液洗涤时,反应的离子方程式为_______ 。
(5)有机层Ⅲ经干燥后分离出纯净溴苯的操作为_______ (填操作名称)。
(6)若实验时使用 苯,最终精制得到
苯,最终精制得到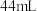 溴苯,则溴苯的产率为
溴苯,则溴苯的产率为_______ (保留两位有效数字)。
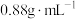 ,沸点
,沸点 ℃:溴苯密度
℃:溴苯密度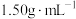 ,沸点
,沸点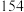 ℃。请回答下列问题:
℃。请回答下列问题:I.粗溴苯的制备
按如图所示的装置连接好各仪器,经检查气密性良好后,加入相应试剂。
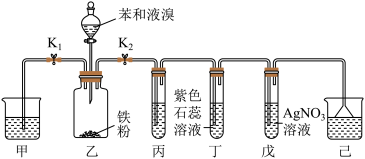
(2)溴苯的制备需在无水条件下进行,原因是
(3)装置丙中应该盛装
Ⅱ.溴苯的精制如下图所示:
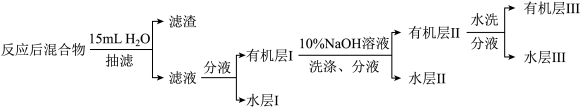
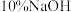 溶液洗涤时,反应的离子方程式为
溶液洗涤时,反应的离子方程式为(5)有机层Ⅲ经干燥后分离出纯净溴苯的操作为
(6)若实验时使用
 苯,最终精制得到
苯,最终精制得到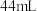 溴苯,则溴苯的产率为
溴苯,则溴苯的产率为
您最近一年使用:0次
2023-07-12更新
|
652次组卷
|
3卷引用:第二章 烃(A卷)
名校
解题方法
5 . 某小组同学欲研究SO2及Na2S2O3的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是_______ 。
(2)利用下图所示的装置研究SO2的性质:(熔点:SO2-76.1℃,SO316.8℃;沸点:SO2-10℃,SO345℃)

①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是_______ 。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是_______ ;装置III中溶液逐渐褪色,生成Mn2+,则该反应的离子方程式是_______ 。
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40mL2.5mol•L-1NaOH溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式_______ 。
(3)已知Na2S2O3溶液与Cl2反应时,1molNa2S2O3转移8mol电子。该反应的离子方程式是_______ 。甲同学设计如下实验流程探究Na2S2O3的化学性质。
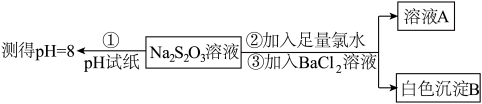
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和_______ 性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是_______ 。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是_______ (填“甲”或“乙”),理由是_______ 。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |

①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40mL2.5mol•L-1NaOH溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式
(3)已知Na2S2O3溶液与Cl2反应时,1molNa2S2O3转移8mol电子。该反应的离子方程式是

(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是
您最近一年使用:0次
2023-03-18更新
|
1144次组卷
|
3卷引用:第五章 化工生产中的重要非金属元素 单元测试
6 . 已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A原子的电子只有一种自旋取向,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C处于同一周期,两者可以形成许多种共价化合物,C、F处于同一主族,B原子最外p能级上的电子处于半充满状态,C的最外层电子数是内层电子数的3倍,E的最外层电子数比最内层电子数多1。元素H原子M能层为全充满状态,且核外只有一个未成对电子的某金属元素,回答下列问题:
(1)E元素基态原子的简化电子排布式为____ 。F元素基态原子的价电子排布图为____ 。
(2)F、G元素对应的最高价含氧酸中酸性较强的化学式为___ 。离子半径:D+___ (填“<”“>”或“=”)B3-。
(3)元素C的简单气态氢化物的沸点____ (填“高于”或“低于”)元素F的简单气态氢化物的沸点,其主要原因是____ 。
(4)元素C与氟元素相比,非金属性较强的是____ (用元素符号表示),下列表述中能证明这一事实的是____ (填序号字母)。
a.常温下氟气的颜色比C单质的颜色深 b.氟气与C的氢化物剧烈反应,产生C的单质
c.氟与C形成的化合物中C元素呈正价态 d.比较两元素的单质与氢气化合时得电子的数目
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为____ 。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:____ 。
(6)E元素原子的第一电离能____ 镁(填“>”“<”或“=”),镁燃烧时会产生耀眼的白光,原因是____ 。
(7)元素H的原子核外电子有____ 种空间运动状态,化合物HC在加热条件下容易转化为H2C,从原子结构的角度解释原因____ 。
(1)E元素基态原子的简化电子排布式为
(2)F、G元素对应的最高价含氧酸中酸性较强的化学式为
(3)元素C的简单气态氢化物的沸点
(4)元素C与氟元素相比,非金属性较强的是
a.常温下氟气的颜色比C单质的颜色深 b.氟气与C的氢化物剧烈反应,产生C的单质
c.氟与C形成的化合物中C元素呈正价态 d.比较两元素的单质与氢气化合时得电子的数目
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为
(6)E元素原子的第一电离能
(7)元素H的原子核外电子有
您最近一年使用:0次
7 . 煤是一种重要能源,工业上常把煤进行气化和液化处理,变为清洁能源。由水蒸气和炽热的无烟煤反应可得水煤气,水煤气是混合气体,主要由两种无色无味气体组成,是重要的工业原料。
(1)工业上生产水煤气时,燃料层的温度会下降,这说明_______ 。
(2)提出猜想:水煤气的成分可能是①CO和氢气,②_______ (填化学式)和氢气。提出以上猜想的依据是_______ 。
设计实验:请从下列装置中选择一种,设计简单的实验证明猜想。
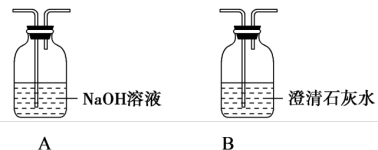
(3)你选择的装置是_______ (填字母代号)。
(4)实验结论:如果_______,那么猜想_______(填序号)合理_______ 。
(1)工业上生产水煤气时,燃料层的温度会下降,这说明
(2)提出猜想:水煤气的成分可能是①CO和氢气,②
设计实验:请从下列装置中选择一种,设计简单的实验证明猜想。

(3)你选择的装置是
(4)实验结论:如果_______,那么猜想_______(填序号)合理
您最近一年使用:0次
名校
8 . 氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的关键环节。
I.C60可用作储存氢气的材料,结构如下图所示。
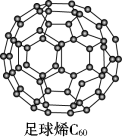
(1)继C60后,科学家合成了Si60、N60,三者结构相似。下列说法正确的是_______(填序号)
II.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示),每个平面小上下最多可吸附10个H2分子。
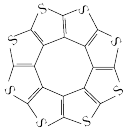
(2)C16S8与H2间以_______ (填微粒间作用力类型)结合。
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):_______ 。
III.LiBH4是储氢材料,已知其由Li+和BH 构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
(4)锂位于元素周期表的_______ 。
(5)由元素周期律能得到_______。(填序号)。
(6)LiBH4中不存在的作用力有_______(填序号)。
(7)氢化锂(LiH)是离子化合物,写出其电子式_______ ,LiH中负离子半径大于正离子半径,其原因是_______ 。
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为_______ 个。
I.C60可用作储存氢气的材料,结构如下图所示。

(1)继C60后,科学家合成了Si60、N60,三者结构相似。下列说法正确的是_______(填序号)
| A.C60、Si60、N60都属于共价晶体 |
| B.C60、Si60、N60分子内共用电子对数目相同 |
| C.由于N-N键能小于N≡N,故N60的稳定性弱于N2 |
| D.由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
II.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示),每个平面小上下最多可吸附10个H2分子。

(2)C16S8与H2间以
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):
III.LiBH4是储氢材料,已知其由Li+和BH
 构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。(4)锂位于元素周期表的
(5)由元素周期律能得到_______。(填序号)。
| A.碱性:LiOH<NaOH | B.与水反应的剧烈程度:Li<Na |
| C.溶解度:LiOH<NaOH | D.密度:Li<Na |
| A.离子键 | B.共价键 | C.金属键 | D.分子间作用力 |
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为
您最近一年使用:0次
名校
解题方法
9 . 某化学兴趣小组对有关SO2性质进行如下探究活动。___________ ,装置A中发生反应的化学方程式为___________ 。
(2)①B中品红溶液褪色,是因为SO2具有___________ (填“氧化”“还原”或“漂白”,下同)性,C装置中酸性KMnO4溶液褪色,表明SO2具有___________ 性。
②证明亚硫酸酸性比碳酸酸性强的实验现象是___________ ;
③若将SO2气体直接通入澄清石灰水中,溶液变浑浊,则该反应的离子方程式为___________ 。
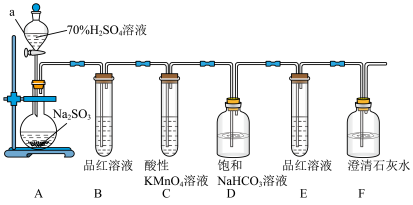
(2)①B中品红溶液褪色,是因为SO2具有
②证明亚硫酸酸性比碳酸酸性强的实验现象是
③若将SO2气体直接通入澄清石灰水中,溶液变浑浊,则该反应的离子方程式为
您最近一年使用:0次
2022-01-03更新
|
2188次组卷
|
8卷引用:第五章 化工生产中的重要非金属元素【单元测试A卷】
(已下线)第五章 化工生产中的重要非金属元素【单元测试A卷】第五章 化工生产中的重要非金属元素(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)广东实验中学越秀学校2023-2024学年高一3月段考化学试题青海省西宁市第五中学2023-2024学年高一下学期4月月考化学试题湖南师范大学附属中学2020-2021学年高一上学期期末考试化学试题广东省揭阳市普宁市华侨中学2021—2022学年高一下学期第一次月考化学科试题(已下线)第04练 常见气体的制备与性质实验-2022年【暑假分层作业】高一化学(人教版2019必修第二册)四川省宜宾市叙州区第一中学校2022-2023学年高一下学期开学考试化学试题
10 . 某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。
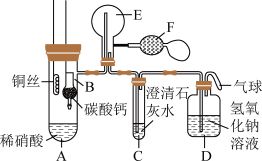
实验操作及现象:
试回答下列问题:
(1)操作I中产生气体的化学式为_______ 。操作I的目的是_______ 。D装置的作用是_______ 。
(2)C装置中白色沉淀的化学式是_______ 。操作II中当C装置中产生白色沉淀时立刻将B装置上提的原因是_______ 。
(3)操作III中A装置中产生无色气体的化学方程式是_______ 。
(4)E装置内气体颜色逐渐加深的原因是_______ 。
(5)操作V现象产生的原因是(用两个化学方程式说明)_______ ,_______ 。

实验操作及现象:
| 实验操作 | 现象 |
| I.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| II.当C装置中产生白色沉淀时,立刻将B装置上提 | |
| III.将A装置中铜丝放入稀硝酸中,给A装置微微加热 | A装置中产生无色气体,E装置中开始时出现浅红棕色气体 |
| IV.用F装置向E装置中鼓入空气 | E装置中气体颜色逐渐加深 |
| V.一段时间后 | C装置中白色沉淀溶解 |
(1)操作I中产生气体的化学式为
(2)C装置中白色沉淀的化学式是
(3)操作III中A装置中产生无色气体的化学方程式是
(4)E装置内气体颜色逐渐加深的原因是
(5)操作V现象产生的原因是(用两个化学方程式说明)
您最近一年使用:0次
2021-09-29更新
|
1788次组卷
|
14卷引用:第五章 化工生产中的重要非金属元素【单元测试B卷】
(已下线)第五章 化工生产中的重要非金属元素【单元测试B卷】第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)广东省广州市仲元中学2020-2021学年高一下学期期中考试化学试题(已下线)章末培优 第5章 化工生产中的重要非金属元素-2021-2022学年高一化学课后培优练(人教版2019必修第二册)广东省揭阳市普宁市华侨中学2021—2022学年高一下学期第一次月考化学科试题安徽省宣城市七校2021-2022学年高一下学期期中联考化学试卷广东省揭阳市惠来县第一中学2021-2022学年高一下学期第一次阶段考试化学试题(已下线)第04练 常见气体的制备与性质实验-2022年【暑假分层作业】高一化学(人教版2019必修第二册)(已下线)第02练 氮及其化合物-2022年【暑假分层作业】高一化学(人教版2019必修第二册)吉林省长春市第二实验中学2022-2023学年高一下学期4月月考化学试题黑龙江省富锦市第一中学2022-2023学年高一下学期第二次考试化学试题(已下线)第02练 氮及其化合物-2023年【暑假分层作业】高一化学(人教版2019必修第二册)广东省兴宁市沐彬中学2021-2022学年高一下学期期中段考化学试题山东省聊城市第二中学2023-2024学年高二上学期开学考试化学试题



