解题方法
1 . 某化学小组在实验室中对SO2进行探究。回答下列问题:
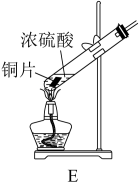
(1)①学生甲用如图E装置制备SO2。写出该反应的化学方程式___________ ,该反应中,硫酸体现的的性质有___________
A.氧化性 B.还原性 C.酸性 D.碱性
②学生乙以 粉末和
粉末和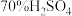 为原料制取SO2,反应的化学方程式是:
为原料制取SO2,反应的化学方程式是:___________
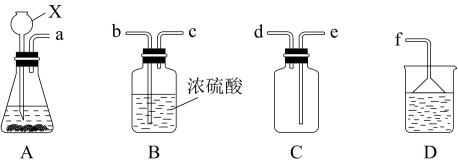
③现欲收集一瓶干燥的SO2,选用下图中的A、B、C、D装置,其连接顺序(按气流方向,用小写字母表示,可重复选用)为:___________
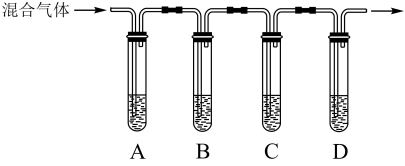
(2)学生丙用浓H2SO4和蔗糖反应,得到的气体中含有SO2、CO2。现选择下图中的装置,验证混合气体中存在CO2和SO2,A和C中盛放的是品红溶液,B中盛放的是酸性高锰酸钾溶液。其中,能证明存在CO2的现象是___________ 。
(3)学生甲实验中,大试管内产生了大量黑色固体。查阅资料知:
①黑色固体可能含有CuO、CuS、 。
。
②CuS和 不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
③向含微量 的溶液中滴加
的溶液中滴加 溶液,能产生红褐色沉淀。
溶液,能产生红褐色沉淀。
现取少量黑色沉淀,加入稀硫酸,充分振荡以后,再滴加 溶液,未见红褐色沉淀,由此所得结论是
溶液,未见红褐色沉淀,由此所得结论是___________ 。另取少量黑色沉淀,加入足量稀硝酸并加热,发现黑色固体最终完全溶解,溶液变为蓝色,有无色气泡生成,管口处出现红棕色。试写出CuS溶于足量稀硝酸的离子方程式:___________
为测定黑色沉淀中 的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应:
的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应: ,
,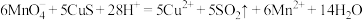 ,恰好用去KMnO4溶液23.50mL。则混合物中
,恰好用去KMnO4溶液23.50mL。则混合物中 的质量分数为
的质量分数为___________
(1)①学生甲用如图E装置制备SO2。写出该反应的化学方程式

A.氧化性 B.还原性 C.酸性 D.碱性
②学生乙以
 粉末和
粉末和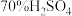 为原料制取SO2,反应的化学方程式是:
为原料制取SO2,反应的化学方程式是:③现欲收集一瓶干燥的SO2,选用下图中的A、B、C、D装置,其连接顺序(按气流方向,用小写字母表示,可重复选用)为:

(2)学生丙用浓H2SO4和蔗糖反应,得到的气体中含有SO2、CO2。现选择下图中的装置,验证混合气体中存在CO2和SO2,A和C中盛放的是品红溶液,B中盛放的是酸性高锰酸钾溶液。其中,能证明存在CO2的现象是

(3)学生甲实验中,大试管内产生了大量黑色固体。查阅资料知:
①黑色固体可能含有CuO、CuS、
 。
。②CuS和
 不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。③向含微量
 的溶液中滴加
的溶液中滴加 溶液,能产生红褐色沉淀。
溶液,能产生红褐色沉淀。现取少量黑色沉淀,加入稀硫酸,充分振荡以后,再滴加
 溶液,未见红褐色沉淀,由此所得结论是
溶液,未见红褐色沉淀,由此所得结论是为测定黑色沉淀中
 的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应:
的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应: ,
,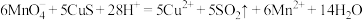 ,恰好用去KMnO4溶液23.50mL。则混合物中
,恰好用去KMnO4溶液23.50mL。则混合物中 的质量分数为
的质量分数为
您最近一年使用:0次
2021-05-20更新
|
359次组卷
|
2卷引用:江苏省无锡先锋高级中2020-2021学年高一下学期第一次月考化学试题
2 . 亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 Na2SO3的性质,进行了如下实验。
【性质预测】
(1)Na2SO3中硫元素的化合价是_______ ,属于S元素的中间价态,既具有氧化性,又具有还原性。
【实验验证】
资料:酸性条件下,KMnO4 被还原为无色的 Mn2+。
【分析解释】
(2)实验ⅰ中,反应的离子方程式是_______ 。
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是_______ 。
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO 具有氧化性,可产生 S;
具有氧化性,可产生 S;
假设 b:空气中存在 O2,在酸性条件下,由于_______ (用离子方程式表示),可产生 S;
假设 c:酸性溶液中的 SO 具有氧化性,可产生 S。
具有氧化性,可产生 S。
②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入_______ (填试剂名称),产生有臭鸡蛋气味的气体,离子方程式为_______ ,溶液未变浑浊。
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:_______ 。
【性质预测】
(1)Na2SO3中硫元素的化合价是
【实验验证】
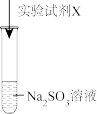 | 实验序号 | 实验试剂X | 实验现象 |
| ⅰ | KMnO4溶液、稀硫酸 | 紫色褪去,变为无色 | |
| ⅱ | Na2S 溶液、稀硫酸 | 加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊。 |
【分析解释】
(2)实验ⅰ中,反应的离子方程式是
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO
 具有氧化性,可产生 S;
具有氧化性,可产生 S;假设 b:空气中存在 O2,在酸性条件下,由于
假设 c:酸性溶液中的 SO
 具有氧化性,可产生 S。
具有氧化性,可产生 S。②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:
您最近一年使用:0次
名校
3 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。
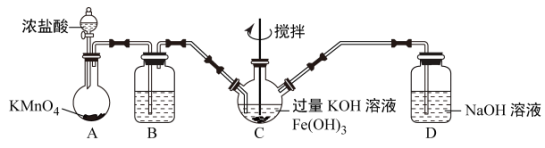
①K2FeO4中铁元素的化合价为___ 价。
②以上装置图中有一处明显的错误请你帮助指出来:___ 。
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式__ 。
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为___ 。
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:___ 。
②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是___ 。(用文字描述)
已知:①K2FeO4为紫色固体,微溶于KOH溶液
②在碱性条件下,次氯酸盐(MClO)可将Fe(OH)3氧化成高铁酸盐(M2FeO4)。
④K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO4并探究其性质。
(1)K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置路)。

①K2FeO4中铁元素的化合价为
②以上装置图中有一处明显的错误请你帮助指出来:
③A装置作用是产生黄绿色氯气(Cl2),写出A中发生反应的离子方程式
④C中发生的反应有Cl2+2KOH=KCl+KClO+H2O,还有生成K2FeO4的反应。写出得到K2FeO4的化学方程式为
(2)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4
①絮凝实验:甲同学取少量K2FeO4加入浑的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。查阅资料此时发生反应的离子方程式为:4FeO
 +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:
+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,请结合方程式,说明K2FeO4的净水原理:②乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是
您最近一年使用:0次
2021-09-17更新
|
323次组卷
|
2卷引用:陕西省榆林市第十二中学2021-2022学年高三上学期班级教学自主质量评估测试化学试题
解题方法
4 . 亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究Na2SO3的性质,进行了如下实验。
(1)Na2SO3中硫元素的化合价是___ ,属于S元素的中间价态,既具有氧化性,又具有还原性。
资料:酸性条件下,KMnO4为紫色,Mn2+为无色。
(2)实验ⅰ中,能说明Na2SO3具有___ (填“氧化性”或“还原性”)。
(3)实验ⅱ中,能说明Na2S在酸性条件下被氧化的实验现象是___ 。
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设a:酸性溶液中的SO 具有氧化性,可产生S;
具有氧化性,可产生S;
假设b:空气中存在O2,在酸性条件下,由于___ (用离子方程式表示),可产生S;
假设c:酸性溶液中的SO 具有氧化性,可产生S。
具有氧化性,可产生S。
②设计实验iii证实了假设a和b不是产生S的主要原因。
实验iii:向Na2S溶液中加入___ (填试剂),产生有臭鸡蛋气味的气体,溶液未变浑。
(1)Na2SO3中硫元素的化合价是
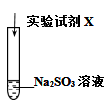 | 实验序号 | 实验试剂X | 实验现象 |
| ⅰ | KMnO4溶液、稀硫酸 | 紫色褪去,变为无色 | |
| ⅱ | Na2S溶液、稀硫酸 | 加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊 |
(2)实验ⅰ中,能说明Na2SO3具有
(3)实验ⅱ中,能说明Na2S在酸性条件下被氧化的实验现象是
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设a:酸性溶液中的SO
 具有氧化性,可产生S;
具有氧化性,可产生S;假设b:空气中存在O2,在酸性条件下,由于
假设c:酸性溶液中的SO
 具有氧化性,可产生S。
具有氧化性,可产生S。②设计实验iii证实了假设a和b不是产生S的主要原因。
实验iii:向Na2S溶液中加入
您最近一年使用:0次
5 . 某小组同学探究Cu和H2O2的反应。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________ 。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
(2)实验ⅱ中:溶液变蓝的原因是________ (用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________ 。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
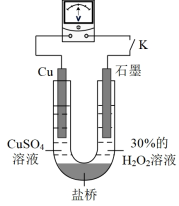
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________ 。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______ 。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________ 。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________ 。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
| 装置 | 序号 | 试剂a | 现象 |
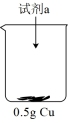 | ⅱ | 20 mL 30% H2O2与4 mL 5 mol/L H2SO4混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。

已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:
(6)基于以上实验,影响Cu与H2O2反应速率的因素有
您最近一年使用:0次
2020-06-06更新
|
339次组卷
|
3卷引用:北京市中央民族大学附属中学2021-2022学年高三上学期12月月考化学试题
名校
解题方法
6 . 探究亚硝酸钠( NaNO2 )的化学性质,实验如下:
资料: AgNO2是淡黄色难溶于水的固体;由上述实验所得结论不正确的是
| 实验 | 装置 | 试剂a | 现象 |
| ① | 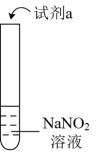 | 酚酞溶液 | 无色溶液变红 |
| ② | AgNO3溶液 | 产生淡黄色沉淀 | |
| ③ | 淀粉KI溶液+稀硫酸 | 无 色溶液立即变蓝 | |
| ④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
| A.NaNO2溶液显碱性 |
B.NaNO2可与某些盐发生复分解反应: +Ag+= AgNO2↓ +Ag+= AgNO2↓ |
C.NaNO2有氧化性: 2I- +2H++2 =I2+2NO2 ↑+H2O =I2+2NO2 ↑+H2O |
D.NaNO2有还原性: +3 +3 +8H+=3 +8H+=3 +2Cr3++4H2O +2Cr3++4H2O |
您最近一年使用:0次
2022-05-25更新
|
329次组卷
|
6卷引用:北京市北京中国人民大学附属中学2022届高三10月检测化学试卷
名校
解题方法
7 . 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色。某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有__ (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1.5molFeC2O4•2H2O,则参加反应的KMnO4为__ mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设:
假设一:全部是FeO
假设二:全部是四氧化三铁
假设三:氧化亚铁和四氧化三铁的混合物
(2)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成如表中内容。
【定量研究】课题组在文献中查阅到,FeC2O4•2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4•2H2O晶体受热分解的化学方程式为:___ 。
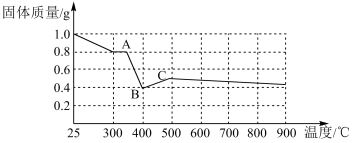
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:___ 。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成。这说明草酸亚铁晶体具有
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设:
假设一:全部是FeO
假设二:全部是四氧化三铁
假设三:氧化亚铁和四氧化三铁的混合物
(2)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成如表中内容。
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体 |

根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
您最近一年使用:0次
名校
8 . 某化学兴趣小组同学在查阅资料的基础上对乙醛与新制氢氧化铜的反应进行了探究。
(1)乙醛与新制氢氧化铜反应的化学方程式为___ 。
【查阅资料】i.乙醛在碱性条件下可发生缩合等反应生成有色物质;
ii.溶液的酸碱性可能会影响物质的氧化性、还原性。
【初步探究】
(2)实验Ⅰ的目的是 ___ 。
(3)甲同学为了检验实验Ⅱ中红色固体的成分进行了如下实验:取少量红色固体于试管中加入适量稀HNO3,振荡,观察到红色固体完全溶解,得蓝色溶液。
甲同学认为,该实验现象说明实验Ⅱ中反应生成了Cu。
乙同学认为甲的观点不正确,理由是Cu2O也可能被硝酸氧化,产生上述现象。该反应的离子方程式为___ 。
【深入探究】乙同学对比实验Ⅱ和实验Ⅲ,对实验Ⅱ能够发生反应的原因提出了猜想:
乙醛的还原性随着溶液碱性的增强而增强,并利用实验Ⅳ进行验证。
(4)实验IV-1中,Na2SO4溶液的作用是使B池溶液具有 ___ ;同时保证中性环境,与实验IV-2对比。
(5)实验IV-2中,B池中的试剂是___ 。
(6)根据实验现象,乙同学认为其猜想成立。乙同学观察到的实验现象是___ 。
(7)综合上述实验,小组同学经过深入讨论,认为除了乙同学的猜想外,与实验Ⅲ相比,实验Ⅱ能够发生反应的原因还可能有___ 和 ___ 。
(1)乙醛与新制氢氧化铜反应的化学方程式为
【查阅资料】i.乙醛在碱性条件下可发生缩合等反应生成有色物质;
ii.溶液的酸碱性可能会影响物质的氧化性、还原性。
【初步探究】
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 向试管中加入4mL10%NaOH溶液,滴入0.5mL水,加入0.5mL 40%乙醛溶液,振荡,在酒精灯上加热至沸腾后保持沸腾 | 无色溶液逐渐变黄并变浑浊加热后得黄色浊液之后无明显变化 |
| Ⅱ | 向试管中加入4mL10%NaOH溶液,滴入0.5mL 2mLCuSO4溶液,振荡,加入0.5%mL 40%乙醛溶液,振荡;在酒精灯上加热至沸腾后保持沸腾 | 蓝色浊液依次呈绿色、黄色、橙色最终生成红色固体之后无明显变化 |
| Ⅲ | 向试管中加入4mL水,滴入0.5mL 2mLCuSO4溶液,振荡,加入0.5mL 40%乙醛溶液,振荡,在酒精灯上加热至沸腾后保持沸腾 | 蓝色溶液无明显变化 |
(3)甲同学为了检验实验Ⅱ中红色固体的成分进行了如下实验:取少量红色固体于试管中加入适量稀HNO3,振荡,观察到红色固体完全溶解,得蓝色溶液。
甲同学认为,该实验现象说明实验Ⅱ中反应生成了Cu。
乙同学认为甲的观点不正确,理由是Cu2O也可能被硝酸氧化,产生上述现象。该反应的离子方程式为
【深入探究】乙同学对比实验Ⅱ和实验Ⅲ,对实验Ⅱ能够发生反应的原因提出了猜想:
乙醛的还原性随着溶液碱性的增强而增强,并利用实验Ⅳ进行验证。
| 实验装置 | 序号 | A池试剂 | B池试剂 | 实验现象 |
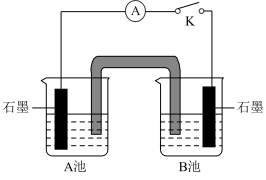 | Ⅳ-1 | 0.2% CuSO4溶液 | NaSO4溶液和40%乙醛溶液按体积比9:1混合 | 指针不偏转,A、B池中均无明显变化 |
| Ⅳ-2 | 0.2% CuSO4溶液 | —— | —— |
(5)实验IV-2中,B池中的试剂是
(6)根据实验现象,乙同学认为其猜想成立。乙同学观察到的实验现象是
(7)综合上述实验,小组同学经过深入讨论,认为除了乙同学的猜想外,与实验Ⅲ相比,实验Ⅱ能够发生反应的原因还可能有
您最近一年使用:0次
9 . Ⅰ.某化学小组在学习元素周期律后,对卤素单质和拟卤素 的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
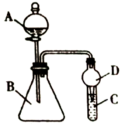
(1)仪器A的名称为______ ;干燥管D的作用为______ 。
(2)若A中加浓HSCN,B中加 ,已知
,已知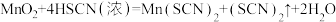 ,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性
,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性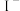
______  (填“
(填“ ”、“
”、“ ”、“
”、“ ”)。写出试管C中发生反应的离子方程式:
”)。写出试管C中发生反应的离子方程式:______ 。
Ⅱ.在探究 的性质实验时,做了以下3个实验:
的性质实验时,做了以下3个实验:
(3)试管1中反应的离子方程式为______ 。
(4)实验2前,小组同学预测经过步骤ii后溶液不应该呈现红色,依据是______ (结合方程式说明)。
(5)实验小组对白色沉淀的产生进行了深入探究,
查阅资料:i.CuSCN为难溶于水的白色固体;
ii. 被称为拟卤素离子,性质与卤素离子相似。
被称为拟卤素离子,性质与卤素离子相似。
经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能:
猜测①: 与KSCN发生了氧化还原反应,该反应的离子方程式
与KSCN发生了氧化还原反应,该反应的离子方程式______ ;
猜测②:亚铁离子将其还原 ,
,
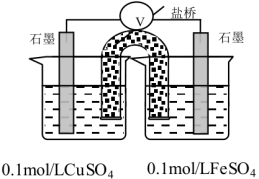
(6)根据实验3,得知猜测①是错误的。小组查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析生成CuSCN沉淀使 的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入
的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入______ 溶液,若电流计______ ,则可以证明以上分析正确。
 的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
(1)仪器A的名称为
(2)若A中加浓HSCN,B中加
 ,已知
,已知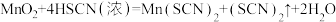 ,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性
,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性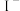
 (填“
(填“ ”、“
”、“ ”、“
”、“ ”)。写出试管C中发生反应的离子方程式:
”)。写出试管C中发生反应的离子方程式:Ⅱ.在探究
 的性质实验时,做了以下3个实验:
的性质实验时,做了以下3个实验:| 实验序号 | 试剂 | 实验步骤 | 实验现象 |
| 1 | 试管1中加2mL 0.05  溶液 溶液 | 加入1mL KSCN溶液 | 溶液变为血红色 |
| 2 | 试管2中加2mL 0.05  溶液 溶液 | I加入0.15g铜粉 | 黄色溶液变为澄清透明的浅蓝色 |
ii 再加入1滴0.1 KSCN溶液 KSCN溶液 | 液滴接触上方变为红色,下方有白色沉淀生成 | ||
| 3 | 试管3中加2mL 0.1  溶液 溶液 | 加入1mL KSCN溶液 | 溶液变成绿色 |
(4)实验2前,小组同学预测经过步骤ii后溶液不应该呈现红色,依据是
(5)实验小组对白色沉淀的产生进行了深入探究,
查阅资料:i.CuSCN为难溶于水的白色固体;
ii.
 被称为拟卤素离子,性质与卤素离子相似。
被称为拟卤素离子,性质与卤素离子相似。经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能:
猜测①:
 与KSCN发生了氧化还原反应,该反应的离子方程式
与KSCN发生了氧化还原反应,该反应的离子方程式猜测②:亚铁离子将其还原
 ,
,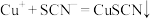
(6)根据实验3,得知猜测①是错误的。小组查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析生成CuSCN沉淀使
 的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入
的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入
您最近一年使用:0次
10 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验
已知:资料1: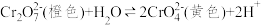
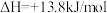 ;
;
资料2:+6价铬盐在一定条件下可被还原为 ,
, 在水溶液中为绿色。
在水溶液中为绿色。
(1)iii和i对比,推测iii的现象是____ 。
(2)ii和i对比,ii中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是 增大对平衡的影响。你认为是否需要再设计实验证明?
增大对平衡的影响。你认为是否需要再设计实验证明?____ (填“是”或“否”),理由是______ 。
(3)对比实验iv与v,可知:在______ 条件下,+6价 被还原为
被还原为______ ,其对应的离子方程式为________ 。
(4)为进一步确定铬(VI)盐溶液的氧化性与酸碱性的关系,某同学进行实验如下:
I.进行实验a和b:
用离子方程式解释a中现象:_______ 。
II.继续进行实验c:
为了说明产生上述现象的原因,补充实验d:向 蒸馏水中滴加
蒸馏水中滴加 的
的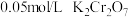 橙色溶液3滴,溶液变成浅橙色。
橙色溶液3滴,溶液变成浅橙色。
①补充实验d的目的是______ 。
②用化学平衡移动原理解释c中现象:_____ 。
③根据实验a~c,可推测: 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。
溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下, 溶液和铬(VI)盐溶液不发生氧化还原反应;
溶液和铬(VI)盐溶液不发生氧化还原反应;
b.______ 。
④向实验c所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是_____ 。
| 系列 实验I | 装置 | 滴管中的试剂 | 试管中的试剂 | 操作 | 现象 |
| i |
|  水 水 | 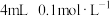  溶液 溶液 | 振荡 | 溶液颜色略微变浅 |
| ii | 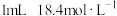 浓硫酸 浓硫酸 | 振荡 | 溶液橙色明显变深 | ||
| iii |  溶液 溶液 | 振荡 | ___________ | ||
| iv | 3滴浓 溶液 溶液 | iii中溶液 | 振荡 | 无明显现象 | |
| v | 过量稀硫酸 | iv中溶液 | 边滴边振荡 | 溶液颜色由黄色逐渐变橙色,最后呈绿色 |
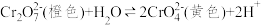
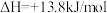 ;
;资料2:+6价铬盐在一定条件下可被还原为
 ,
, 在水溶液中为绿色。
在水溶液中为绿色。(1)iii和i对比,推测iii的现象是
(2)ii和i对比,ii中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是
 增大影响的结果;乙认为橙色加深一定是
增大影响的结果;乙认为橙色加深一定是 增大对平衡的影响。你认为是否需要再设计实验证明?
增大对平衡的影响。你认为是否需要再设计实验证明?(3)对比实验iv与v,可知:在
 被还原为
被还原为(4)为进一步确定铬(VI)盐溶液的氧化性与酸碱性的关系,某同学进行实验如下:
I.进行实验a和b:
| 序号 | 操作 | 现象 |
| a | 向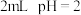 的 的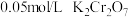 的橙色溶液中滴加饱和 的橙色溶液中滴加饱和 溶液( 溶液( 约为9)3滴 约为9)3滴 | 溶液变绿色 |
| b | 向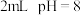 的 的 的 的 黄色溶液中滴加饱和 黄色溶液中滴加饱和 溶液3滴 溶液3滴 | 溶液没有明显变化 |
II.继续进行实验c:
| 序号 | 操作 | 现象 |
| c | 向 饱和 饱和 溶液中滴加 溶液中滴加 的 的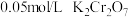 的橙色溶液3滴 的橙色溶液3滴 | 溶液变黄色 |
 蒸馏水中滴加
蒸馏水中滴加 的
的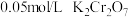 橙色溶液3滴,溶液变成浅橙色。
橙色溶液3滴,溶液变成浅橙色。①补充实验d的目的是
②用化学平衡移动原理解释c中现象:
③根据实验a~c,可推测:
 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。
溶液和铬(VI)盐溶液的反应与溶液酸碱性有关。a.碱性条件下,
 溶液和铬(VI)盐溶液不发生氧化还原反应;
溶液和铬(VI)盐溶液不发生氧化还原反应;b.
④向实验c所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是
您最近一年使用:0次




