1 . 完成下列问题。
(1)如图表示在密闭容器中反应: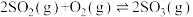 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是
达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是______ ;b→c过程中改变的条件可能是______ ;若增大压强时,反应速度变化情况画在c~d处______ 。 、4.5mol
、4.5mol ,经10min后反应达平衡时有3mol
,经10min后反应达平衡时有3mol 发生了反应。试填写下列空格:
发生了反应。试填写下列空格:
① 的转化率为
的转化率为______ 。
②平衡常数K为______ 。
(1)如图表示在密闭容器中反应:
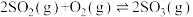 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是
达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是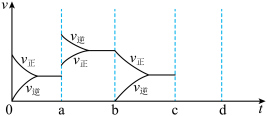
 、4.5mol
、4.5mol ,经10min后反应达平衡时有3mol
,经10min后反应达平衡时有3mol 发生了反应。试填写下列空格:
发生了反应。试填写下列空格:①
 的转化率为
的转化率为②平衡常数K为
您最近一年使用:0次
解题方法
2 . 实验室用固体烧碱配制480mL0.1mol⋅L−1NaOH溶液。
(1)配制上述溶液时需称量NaOH固体的质量为__________ g(保留两位小数)
(2)配制过程中不需要使用下列仪器中的_______ (填仪器序号),其中还缺少的玻璃仪器是_________ 、___________ (填仪器名称)。_______ 。
A.用适量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量蒸馏水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻度线1~2cm处
(4)在容量瓶内确定溶液体积的过程中,当液面离容量瓶颈部的刻度线1~2cm时的做法是_______
(5)下列的实验操作可能导致配制的溶液浓度偏高的是(填序号)_______ 。
①称量NaOH固体时,砝码生锈
②移液时,未洗涤烧杯和玻璃棒
③定容时俯视容量瓶刻度线
④摇匀后液面低于刻度线,继续加水至刻度线
⑤容量瓶内有少量水
(1)配制上述溶液时需称量NaOH固体的质量为
(2)配制过程中不需要使用下列仪器中的
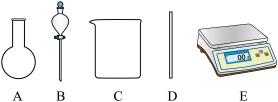
A.用适量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量蒸馏水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻度线1~2cm处
(4)在容量瓶内确定溶液体积的过程中,当液面离容量瓶颈部的刻度线1~2cm时的做法是
(5)下列的实验操作可能导致配制的溶液浓度偏高的是(填序号)
①称量NaOH固体时,砝码生锈
②移液时,未洗涤烧杯和玻璃棒
③定容时俯视容量瓶刻度线
④摇匀后液面低于刻度线,继续加水至刻度线
⑤容量瓶内有少量水
您最近一年使用:0次
解题方法
3 . 某学生欲用下列装置制取纯净FeCl3固体。其中A是Cl2的发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网,F为干燥的空广口瓶,烧杯G为尾气吸收装置。
(1)该装置中有一明显错误是____________ (填字母)。
(2)D中所装试剂为_____________ ,C装置的作用是___________________ 。
(3)A中发生反应的化学方程式是__________________ ,G中发生反应的离子方程式是________________ 。
(4)若用100mL 12mol/L盐酸与足量MnO2充分反应,生成的Cl2体积(标准状况)________________ (填“大于”“小于”或“等于”)6.72 L。
(5)用所制取的FeCl3固体制成Fe(OH)3胶体,区分胶体和溶液常用________ ,分离胶体和溶液常用的方法叫__________ 。

(1)该装置中有一明显错误是
(2)D中所装试剂为
(3)A中发生反应的化学方程式是
(4)若用100mL 12mol/L盐酸与足量MnO2充分反应,生成的Cl2体积(标准状况)
(5)用所制取的FeCl3固体制成Fe(OH)3胶体,区分胶体和溶液常用
您最近一年使用:0次
解题方法
4 . 利用铁元素价类二维图可以多角度研究含铁物质的性质及转化关系,请完成下列问题。__________ 。
A.Fe B. C.
C.
(2)下列说法正确的是___________ 。 粉末于烧杯中,加入适量盐酸至完全溶解,发生反应的离子方程式为
粉末于烧杯中,加入适量盐酸至完全溶解,发生反应的离子方程式为__________ ,
(4)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:___________ 。
(5)人体血红蛋白分子中含有 ,正是这些
,正是这些 使血红蛋白分子具有载氧功能。亚硝酸钠(
使血红蛋白分子具有载氧功能。亚硝酸钠( )可将人体血红蛋白中的
)可将人体血红蛋白中的 转化为
转化为 ,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中
,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中 发生
发生__________ 反应,说明亚硝酸钠具有__________ 性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具有__________ 性。
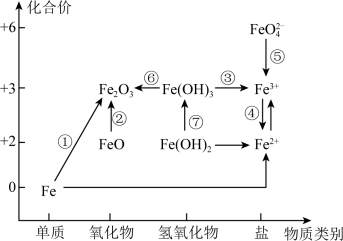
A.Fe B.
 C.
C.
(2)下列说法正确的是
A. 是碱性氧化物
是碱性氧化物
B.铁与高温水蒸气的反应可实现上述转化①
C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②
(3)取少量 粉末于烧杯中,加入适量盐酸至完全溶解,发生反应的离子方程式为
粉末于烧杯中,加入适量盐酸至完全溶解,发生反应的离子方程式为(4)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
(5)人体血红蛋白分子中含有
 ,正是这些
,正是这些 使血红蛋白分子具有载氧功能。亚硝酸钠(
使血红蛋白分子具有载氧功能。亚硝酸钠( )可将人体血红蛋白中的
)可将人体血红蛋白中的 转化为
转化为 ,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中
,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中 发生
发生
您最近一年使用:0次
解题方法
5 . I.根据物质的组成、结构、性质等进行分类,可预测物质的性质及变化:
现有下列九种物质:①HCl气体②固体Cu③乙醇④CO2⑤熔融NaCl⑥Al2O3固体⑦硫酸溶液⑧NaHCO3固体⑨BaSO4固体。按照不同的依据对其进行分类:
(1)所给状态能导电的是________ ,属于电解质的是_______ ;(均填序号)。
(2)属于酸式盐的物质为___________ (填序号),其电离方程式为___________ 。
Ⅱ.物质的量是联系宏观和微观的桥梁:
(3)40.5g某金属氧化物MCl2中含0.6molCl-,则该氯化物的摩尔质量为___________ 。
(4)标准状况下,与34g的H2S气体含相同H原子数的CH4的体积为___________ 。
(5)在同温同压下,等质量的CO和CO2.其体积之比为___________ ,密度之比为___________ 。
现有下列九种物质:①HCl气体②固体Cu③乙醇④CO2⑤熔融NaCl⑥Al2O3固体⑦硫酸溶液⑧NaHCO3固体⑨BaSO4固体。按照不同的依据对其进行分类:
(1)所给状态能导电的是
(2)属于酸式盐的物质为
Ⅱ.物质的量是联系宏观和微观的桥梁:
(3)40.5g某金属氧化物MCl2中含0.6molCl-,则该氯化物的摩尔质量为
(4)标准状况下,与34g的H2S气体含相同H原子数的CH4的体积为
(5)在同温同压下,等质量的CO和CO2.其体积之比为
您最近一年使用:0次
6 . 类比是研究物质性质的常用方法之一、下列类比正确的是
①Cu与 能化合生成
能化合生成 ,则Fe与
,则Fe与 能化合生成
能化合生成
②Mg在空气中燃烧生成MgO,则Na在空气中燃烧生成
③ 可以治疗胃酸过多,则NaOH也可以治疗胃酸过多
可以治疗胃酸过多,则NaOH也可以治疗胃酸过多
④Fe可以置换出 溶液中的铜,则Al也可以置换出
溶液中的铜,则Al也可以置换出 溶液中的铜
溶液中的铜
①Cu与
 能化合生成
能化合生成 ,则Fe与
,则Fe与 能化合生成
能化合生成
②Mg在空气中燃烧生成MgO,则Na在空气中燃烧生成

③
 可以治疗胃酸过多,则NaOH也可以治疗胃酸过多
可以治疗胃酸过多,则NaOH也可以治疗胃酸过多④Fe可以置换出
 溶液中的铜,则Al也可以置换出
溶液中的铜,则Al也可以置换出 溶液中的铜
溶液中的铜| A.①④ | B.②③ | C.①③ | D.②④ |
您最近一年使用:0次
7 . 常温常压下,用等质量的CH4、CO2、O2、SO2分别吹出四个气球,其中气体为CH4的是
|
|
|
|
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 研究水溶液中的粒子行为在研究中具有重要价值。
根据下表所列三种溶液在25℃时的相关数据,按要求填空:
(1)用离子方程式表示CH3COOH溶液显酸性的原因 ___________ 。
(2)比较溶液(Ⅱ)、(Ⅲ)中 的大小关系是(Ⅱ)
的大小关系是(Ⅱ)___________ (Ⅲ)(填“>”、“<”或“=”)。
(3)溶液(Ⅱ)中各离子浓度由大到小的顺序是___________ 。
(4)溶液(Ⅰ)和(Ⅱ)中由水电离出的 之比是
之比是 ___________ 。
根据下表所列三种溶液在25℃时的相关数据,按要求填空:
| 溶液 | 物质的量浓度 | pH | 用离子方程式表示溶液显酸性的原因 |
| (Ⅰ)CH3COOH | 0.1mol/L | 3 | _______ |
| (Ⅱ)NH4Cl | 0.1mol/L | 6 | / |
| (Ⅲ)NH4HSO4 | 0.1mol/L | 1 | / |
(2)比较溶液(Ⅱ)、(Ⅲ)中
 的大小关系是(Ⅱ)
的大小关系是(Ⅱ)(3)溶液(Ⅱ)中各离子浓度由大到小的顺序是
(4)溶液(Ⅰ)和(Ⅱ)中由水电离出的
 之比是
之比是
您最近一年使用:0次
9 . 已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如表:
(1)写出碳酸的第一步电离方程式 ___________ 。
(2) 的盐酸与醋酸溶液分别加蒸馏水稀释至
的盐酸与醋酸溶液分别加蒸馏水稀释至 ,稀释后溶液的
,稀释后溶液的 ,前者
,前者 ___________ 后者(填“>”、“<”或“=”)。
(3)25℃时,等浓度的三种溶液a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液, 由大到小的顺序为
由大到小的顺序为 ___________  填序号
填序号 。
。
(4)25℃时,向 溶液中通入少量
溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为 ___________ 。
| 醋酸 | 碳酸 | 氢氰酸 |
 |  、 、 |  |
(2)
 的盐酸与醋酸溶液分别加蒸馏水稀释至
的盐酸与醋酸溶液分别加蒸馏水稀释至 ,稀释后溶液的
,稀释后溶液的 ,前者
,前者 (3)25℃时,等浓度的三种溶液a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,
 由大到小的顺序为
由大到小的顺序为  填序号
填序号 。
。(4)25℃时,向
 溶液中通入少量
溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
10 . 写出下列离子方程式:
(1)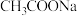 溶液呈碱性的原因:
溶液呈碱性的原因:___________ 。
(2) 溶液呈酸性的原因:
溶液呈酸性的原因:___________ 。
(3)泡沫灭火器(碳酸氢钠和硫酸铝)的原理:___________ 。
(1)
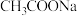 溶液呈碱性的原因:
溶液呈碱性的原因:(2)
 溶液呈酸性的原因:
溶液呈酸性的原因:(3)泡沫灭火器(碳酸氢钠和硫酸铝)的原理:
您最近一年使用:0次