解题方法
1 . 以萃铜余液为原料制备工业活性氧化锌,其生产工艺流程如图所示:
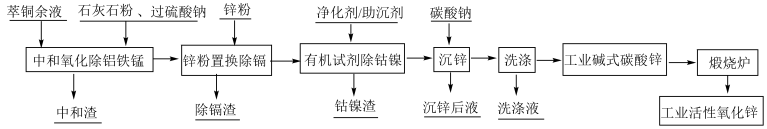
(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式_______ ;采用石灰石粉中和除去铝和铁,则中和渣中主要成分为_______ 。
(2)流程中用到最多的操作是_______ ,该操作中玻璃棒的作用是_______ 。
(3)用锌粉除镉(Cd2+ )的离子方程式为_______ ;沉锌生成碱式碳酸锌[2Zn(OH2)·ZnCO3·H2O]的化学方程式为_______ 。
(4)检验碱式碳酸锌洗涤干净的操作及现象为_______ 。
(5)煅烧炉中发生反应的化学方程式为_______ 。

(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式
(2)流程中用到最多的操作是
(3)用锌粉除镉(Cd2+ )的离子方程式为
(4)检验碱式碳酸锌洗涤干净的操作及现象为
(5)煅烧炉中发生反应的化学方程式为
您最近一年使用:0次
解题方法
2 . 以含钛高炉渣(主要成分为 ,还含有少量CaO、Fe2O3、
,还含有少量CaO、Fe2O3、 )为原料生产
)为原料生产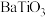 的工艺流程如下:
的工艺流程如下:
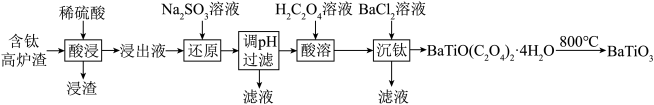
已知:
①浸出液的pH小于0.5
②相关金属离子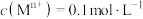 时,形成氢氧化物沉淀的pH范围如下:
时,形成氢氧化物沉淀的pH范围如下:
请回答以下问题:
(1)“浸渣”的主要成分为___________ (填化学式)。
(2)为了提高“酸浸”的浸取率,可采取的措施为___________ (任写一条)。
(3)加入 时所发生氧化还原反应的离子方程式为
时所发生氧化还原反应的离子方程式为___________ 。
 ,还含有少量CaO、Fe2O3、
,还含有少量CaO、Fe2O3、 )为原料生产
)为原料生产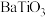 的工艺流程如下:
的工艺流程如下:
已知:
①浸出液的pH小于0.5
②相关金属离子
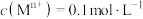 时,形成氢氧化物沉淀的pH范围如下:
时,形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |
| 开始沉淀的pH | 0.5 | 6.3 | 1.5 |
| 沉淀完全的pH | 2.5 | 8.3 | 2.8 |
(1)“浸渣”的主要成分为
(2)为了提高“酸浸”的浸取率,可采取的措施为
(3)加入
 时所发生氧化还原反应的离子方程式为
时所发生氧化还原反应的离子方程式为
您最近一年使用:0次
解题方法
3 . 氯化氰(CNCl),又名氯甲氰,是重要的化工中间体,在农药、医药、化工助剂等方面有着广泛的应用。某小组制备氯化氰并探究其性质,实验装置如图所示。回答下列问题:
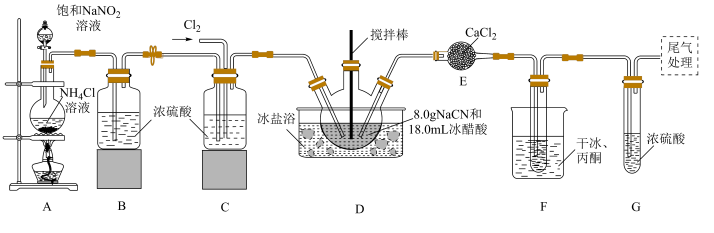
已知:①CNCl的熔点为−6.5℃,沸点为13.1℃,可溶于水并与水反应;NaCN具有较强的还原性。
②合成原理:在−10℃~−5℃条件下,Cl2+NaCN=NaCl+CNCl。
(1)N2可用装置A制备。盛放饱和NaNO2溶液的仪器名称为___________ ,写出装置A中发生反应的化学方程式:___________ 。
(2)装置F中干冰和丙酮的作用是降低温度,此时干冰___________ (填“升华”或“凝华”);装置G的作用是___________ 。
(3)实验中,先向D中通入___________ (填“N2”或“Cl2”),此操作的目的是___________ 。
(4)实验中必须保持温度在−10~−5℃,若高于−5℃,CNCl与NaCN反应产生NaCl和与卤素性质相似的气体___________ (填化学式)。
(5)向盛有少量Na2S溶液的试管中通入CNCl,然后向其中滴入一滴FeCl3溶液,溶液显红色,其原因是___________ (用离子方程式说明)。

已知:①CNCl的熔点为−6.5℃,沸点为13.1℃,可溶于水并与水反应;NaCN具有较强的还原性。
②合成原理:在−10℃~−5℃条件下,Cl2+NaCN=NaCl+CNCl。
(1)N2可用装置A制备。盛放饱和NaNO2溶液的仪器名称为
(2)装置F中干冰和丙酮的作用是降低温度,此时干冰
(3)实验中,先向D中通入
(4)实验中必须保持温度在−10~−5℃,若高于−5℃,CNCl与NaCN反应产生NaCl和与卤素性质相似的气体
(5)向盛有少量Na2S溶液的试管中通入CNCl,然后向其中滴入一滴FeCl3溶液,溶液显红色,其原因是
您最近一年使用:0次
4 . 某研究性学习小组探究硫的化合物的制备和性质。
Ⅰ.制备二氧化硫
用70%的浓硫酸与 固体反应制备
固体反应制备 气体。
气体。 气体最合适的发生装置是
气体最合适的发生装置是___________ (填写字母)。
Ⅱ.制备硫代硫酸钠
已知:硫代硫酸钠易与酸反应。
反应原理: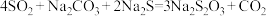
室温时,往 、
、 混合溶液中均匀通入
混合溶液中均匀通入 气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH值接近于7时,停止通入
气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH值接近于7时,停止通入 气体。
气体。
(2)制备 反应分三步进行
反应分三步进行
反应i: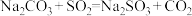 ;
;
反应ii: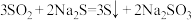 ;
;
反应iii的化学方程式为___________ 。
(3)当pH值接近于7时,停止通入 的原因是
的原因是___________ 。
Ⅲ.探究浓度对反应速率的影响
相同温度下,按下表中的体积将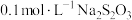 溶液、
溶液、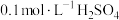 溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
通过实验绘制出的浑浊度随时间变化关系如图所示:___________ 溶液浓度对反应速率的影响。
②结合图像分析, 溶液、
溶液、 溶液二者相比,
溶液二者相比,___________ 溶液浓度的改变对化学反应速率的影响更大。
Ⅳ.探究性质
资料: 在酸性溶液中氧化
在酸性溶液中氧化 ,反应为:
,反应为: 。
。
向某浓度的过量 酸性溶液(含淀粉)中通入一定量后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
酸性溶液(含淀粉)中通入一定量后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
(5)某实验小组提出假设:t秒前生成了 ,但
,但 继续与溶液中的
继续与溶液中的 反应,且该反应速率较快,故溶液没有立刻变蓝,请写出
反应,且该反应速率较快,故溶液没有立刻变蓝,请写出 与
与 反应的离子方程式
反应的离子方程式___________ 。
Ⅰ.制备二氧化硫
用70%的浓硫酸与
 固体反应制备
固体反应制备 气体。
气体。
 气体最合适的发生装置是
气体最合适的发生装置是Ⅱ.制备硫代硫酸钠
已知:硫代硫酸钠易与酸反应。
反应原理:
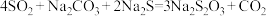
室温时,往
 、
、 混合溶液中均匀通入
混合溶液中均匀通入 气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH值接近于7时,停止通入
气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH值接近于7时,停止通入 气体。
气体。(2)制备
 反应分三步进行
反应分三步进行反应i:
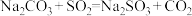 ;
;反应ii:
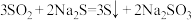 ;
;反应iii的化学方程式为
(3)当pH值接近于7时,停止通入
 的原因是
的原因是Ⅲ.探究浓度对反应速率的影响
相同温度下,按下表中的体积将
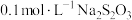 溶液、
溶液、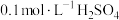 溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。| 实验标号 | 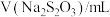 | 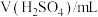 | V(蒸馏水)/mL |
| A | 1.5 | 3.5 | 10 |
| B | 2.5 | 3.5 | 9 |
| C | 3.5 | 3.5 | 8 |
| D | 3.5 | 2.5 | 9 |
| E | 3.5 | 1.5 | 10 |

②结合图像分析,
 溶液、
溶液、 溶液二者相比,
溶液二者相比,Ⅳ.探究性质
资料:
 在酸性溶液中氧化
在酸性溶液中氧化 ,反应为:
,反应为: 。
。向某浓度的过量
 酸性溶液(含淀粉)中通入一定量后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
酸性溶液(含淀粉)中通入一定量后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。(5)某实验小组提出假设:t秒前生成了
 ,但
,但 继续与溶液中的
继续与溶液中的 反应,且该反应速率较快,故溶液没有立刻变蓝,请写出
反应,且该反应速率较快,故溶液没有立刻变蓝,请写出 与
与 反应的离子方程式
反应的离子方程式
您最近一年使用:0次
名校
5 . 工业上制备相关物质,涉及的反应原理及部分流程较为合理的是
A.制取镁:海水 Mg(OH)2 Mg(OH)2 MgO MgO Mg Mg |
B.冶炼铝:铝土矿 NaAlO2 NaAlO2 无水AlCl3 无水AlCl3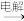 Al Al |
C.制纯碱:饱和NaCl(aq)  NaHCO3(s) NaHCO3(s) 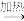 Na2CO3(s) Na2CO3(s) |
D.制碘:海带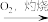 海带灰 海带灰 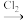 I2(aq) I2(aq) I2 I2 |
您最近一年使用:0次
2023-09-11更新
|
222次组卷
|
3卷引用:广东省阳江市2023-2024学年高一上学期10月月考化学试题
名校
解题方法
6 . 分类、归纳是学习化学的有效方法。甲、乙、丙均为初中化学常见的纯净物,I、II、III为初中化学常见的反应。下列说法错误的是
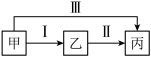
| A.若甲、乙常温下为气体且反应I通过植物光合作用可以实现,则丙一定为非金属氧化物 |
| B.若丙为食盐的主要成分,则甲、乙溶液的pH都可能大于7 |
| C.若乙和丙是常用的灭火剂,则甲可能是有机物燃料 |
| D.若甲属于碱、乙属于盐且二者均可用作建筑材料,则反应Ⅲ一定属于中和反应 |
您最近一年使用:0次
2023-09-09更新
|
119次组卷
|
2卷引用:广东省阳江市2023-2024学年高一上学期10月月考化学试题
名校
7 . 物质的用量可能影响反应的产物,下列离子方程式正确的是
A.向 Fe(NO3)3 溶液中加入少量的 HI 溶液: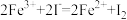 |
B.足量 NaOH 溶液与 H2C2O4 溶液反应: |
C.向 CuSO4 溶液中加入过量氨水: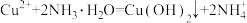 |
D.向 Mg(HCO3)2 溶液中加入过量的 NaOH 溶液: |
您最近一年使用:0次
2023-09-02更新
|
311次组卷
|
2卷引用:广东省阳江市2023-2024学年高一上学期10月月考化学试题
8 .  (亚氯酸钠)是造纸工业中常见的漂白剂,与可燃物接触易爆炸。一种制备
(亚氯酸钠)是造纸工业中常见的漂白剂,与可燃物接触易爆炸。一种制备 的流程如图所示,下列说法错误的是
的流程如图所示,下列说法错误的是

 (亚氯酸钠)是造纸工业中常见的漂白剂,与可燃物接触易爆炸。一种制备
(亚氯酸钠)是造纸工业中常见的漂白剂,与可燃物接触易爆炸。一种制备 的流程如图所示,下列说法错误的是
的流程如图所示,下列说法错误的是
A. 的漂白原理与 的漂白原理与 相似 相似 |
B.气体1、气体2分别是 、 、 |
C.反应3的离子方程式: |
| D.“分离”操作过程包括结晶、过滤、乙醇洗涤等 |
您最近一年使用:0次
2023-08-30更新
|
409次组卷
|
2卷引用:广东省阳江市2023-2024学年高二上学期10月月考化学试题
名校
9 . 下列离子方程式书写正确的是
A.将 固体投入 固体投入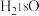 中: 中: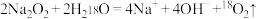 |
B.草酸加入酸性 溶液中: 溶液中: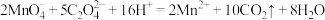 |
C.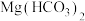 溶液与足量的 溶液与足量的 溶液反应: 溶液反应: |
D.向 溶液中滴加少量稀硫酸: 溶液中滴加少量稀硫酸: |
您最近一年使用:0次
2023-08-30更新
|
178次组卷
|
4卷引用:广东省阳江市2023-2024学年高一上学期10月月考化学试题
名校
解题方法
10 . 碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图。下列说法正确的是
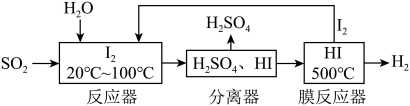

| A.分离器中的物质分离操作为过滤 |
| B.反应器中发生的氧化还原反应I2是还原剂 |
| C.该工艺中I2和HI的相互转化体现了“碘循环” |
| D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI |
您最近一年使用:0次
2023-08-29更新
|
132次组卷
|
2卷引用:广东省阳江市2023-2024学年高一上学期10月月考化学试题



