名校
1 . 《神农本草经》记载:“石硫磺(S),味酸,能化铜、铁”,据此可推断单质硫具有的性质是
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
2024-03-25更新
|
147次组卷
|
2卷引用:陕西省咸阳市实验中学2023-2024学年高一下学期第一次月考化学试题
名校
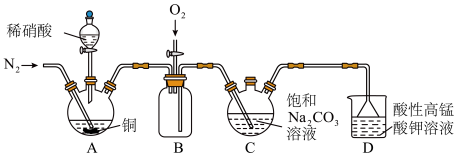
2 . 亚硝酸钠( )主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用
)主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用 表示)制备亚硝酸钠,简易流程如图。
表示)制备亚硝酸钠,简易流程如图。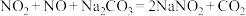 ,
,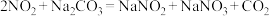
 溶液和饱和
溶液和饱和 溶液在加热条件下反应可制得
溶液在加热条件下反应可制得 ,该反应的化学方程式为
,该反应的化学方程式为_______ ;实验时装置B中应间断性通入适量的 ,其目的是
,其目的是_______ 。
(2)装置C中盛装饱和 溶液的仪器的名称是
溶液的仪器的名称是_______ ;NO不能单独被纯碱溶液吸收,为了使 完全被纯碱溶液吸收且产品纯度最高,
完全被纯碱溶液吸收且产品纯度最高,
_______ 。
(3)装置D的作用是_______ ,采用“倒置漏斗”措施的目的是_______ 。
(4)设计实验探究 的性质。制备
的性质。制备 实验完毕后,从装置C中分离出
实验完毕后,从装置C中分离出 固体粗产品(不含
固体粗产品(不含 杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
上述实验_______ (填标号)的结论不可靠。经实验测得实验丙反应后的溶液中氮元素仅以 的形式存在,酸性
的形式存在,酸性 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为_______ 。
 )主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用
)主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用 表示)制备亚硝酸钠,简易流程如图。
表示)制备亚硝酸钠,简易流程如图。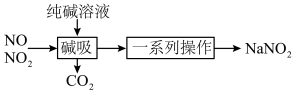
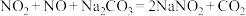 ,
,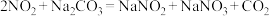
 溶液和饱和
溶液和饱和 溶液在加热条件下反应可制得
溶液在加热条件下反应可制得 ,该反应的化学方程式为
,该反应的化学方程式为 ,其目的是
,其目的是(2)装置C中盛装饱和
 溶液的仪器的名称是
溶液的仪器的名称是 完全被纯碱溶液吸收且产品纯度最高,
完全被纯碱溶液吸收且产品纯度最高,
(3)装置D的作用是
(4)设计实验探究
 的性质。制备
的性质。制备 实验完毕后,从装置C中分离出
实验完毕后,从装置C中分离出 固体粗产品(不含
固体粗产品(不含 杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。| 实验 | 实验操作及现象 | 结论 |
| 甲 | 滴入无色酚酞溶液中,无色酚酞溶液变红 |  是弱酸 是弱酸 |
| 乙 | 滴入少量酸性KI-淀粉溶液中,振荡,酸性KI-淀粉溶液变蓝 | 酸性条件下 具有氧化性 具有氧化性 |
| 丙 | 滴入少量酸性 溶液中,振荡,酸性 溶液中,振荡,酸性 溶液褪色 溶液褪色 | 酸性条件 具有还原性 具有还原性 |
 的形式存在,酸性
的形式存在,酸性 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
名校
3 . 如图为硫元素的“价-类”二维图,回答下列问题:__________ 。
(2) 与A溶液反应有淡黄色固体生成,该反应的化学方程式为
与A溶液反应有淡黄色固体生成,该反应的化学方程式为________ ,体现了A的____________ (填“氧化性”或“还原性”)。
(3) 和氯水都有漂白性,有人为增强漂白效果,将
和氯水都有漂白性,有人为增强漂白效果,将 和
和 混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因
混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因_____________________________ 。
(4) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的方法是
溶液是否变质的方法是_______________________ 。
(5)大苏打( )在照相、电影、纺织、皮革、农药等方面均有重要作用。现欲在实验室制备大苏打,从氧化还原角度分析,下列合理的是 (填字母)。
)在照相、电影、纺织、皮革、农药等方面均有重要作用。现欲在实验室制备大苏打,从氧化还原角度分析,下列合理的是 (填字母)。
(6)利用如下装置探究 气体与
气体与 的反应:
的反应: ,为了验证A中
,为了验证A中 与
与 发生了氧化还原反应,取A中的溶液,分成两份,设计如下实验:
发生了氧化还原反应,取A中的溶液,分成两份,设计如下实验:
方案①;向第一份溶液中加入少量酸性 溶液,紫红色褪去。
溶液,紫红色褪去。
方案②:向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是__________ (填“①”或“②”),原因是_______________________ 。
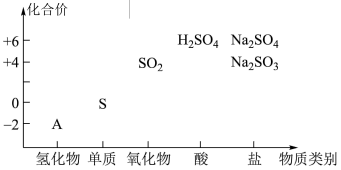
(2)
 与A溶液反应有淡黄色固体生成,该反应的化学方程式为
与A溶液反应有淡黄色固体生成,该反应的化学方程式为(3)
 和氯水都有漂白性,有人为增强漂白效果,将
和氯水都有漂白性,有人为增强漂白效果,将 和
和 混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因
混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因(4)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的方法是
溶液是否变质的方法是(5)大苏打(
 )在照相、电影、纺织、皮革、农药等方面均有重要作用。现欲在实验室制备大苏打,从氧化还原角度分析,下列合理的是 (填字母)。
)在照相、电影、纺织、皮革、农药等方面均有重要作用。现欲在实验室制备大苏打,从氧化还原角度分析,下列合理的是 (填字母)。A. | B. | C. | D. |
(6)利用如下装置探究
 气体与
气体与 的反应:
的反应: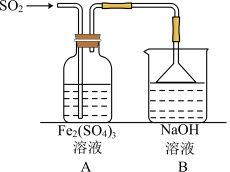
 ,为了验证A中
,为了验证A中 与
与 发生了氧化还原反应,取A中的溶液,分成两份,设计如下实验:
发生了氧化还原反应,取A中的溶液,分成两份,设计如下实验:方案①;向第一份溶液中加入少量酸性
 溶液,紫红色褪去。
溶液,紫红色褪去。方案②:向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是
您最近一年使用:0次
2024-03-25更新
|
548次组卷
|
5卷引用:陕西省咸阳市实验中学2023-2024学年高一下学期第一次月考化学试题
解题方法
4 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制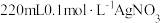 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: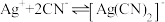 ,
,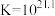 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是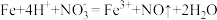 和
和___________ (用离子方程式表示,已知氧化性: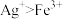 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中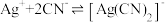 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为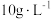 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由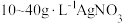 溶液和
溶液和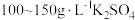 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: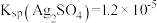 。
。
I.实验准备。
(1)用
 固体配制
固体配制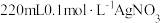 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
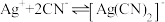 ,
,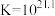 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的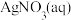 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
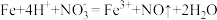 和
和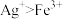 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
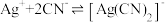 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(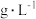 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为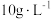 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
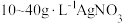 溶液和
溶液和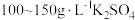 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
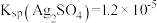 。
。
您最近一年使用:0次
2024-04-16更新
|
346次组卷
|
5卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届青海省玉树州高三下学期第四次联考理综试题-高中化学2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
5 . 硫脲 是一种杀菌剂。某小组设计实验制备硫脲并探究其性质。
是一种杀菌剂。某小组设计实验制备硫脲并探究其性质。
实验(一):制备硫脲。装置如图1所示(加热装置已省略)。
已知:① ;
;
②25℃时硫脲溶解度为14.2 g/100 g水;
③实验室常用FeS与稀H2SO4在常温下制H2S。______ ,B的加热方式宜选择______ (填标号)。
a.直接用酒精灯加热
b.油浴加热(100~250℃)
c.热水浴加热
(2)当C装置中出现______ (填实验现象)时表明B中生成了 。
。
(3)实验发现,硫脲产率与投料比{ }的关系如图2所示。
}的关系如图2所示。______ 。
实验(二):探究硫脲的性质。
资料显示:①150℃时 转化成NH4SCN。
转化成NH4SCN。
②酸性KMnO4溶液和硫脲反应,还原产物为 ,氧化产物为N2和
,氧化产物为N2和 。
。
(4)取少量 溶于水,加热至150℃,一段时间后再冷却至室温时,滴加
溶于水,加热至150℃,一段时间后再冷却至室温时,滴加______ ,可检验是否有 生成。
生成。
(5)取少量 溶于NaOH溶液,加入CuSO4溶液,过滤、洗涤,得到黑色固体,由此推知,
溶于NaOH溶液,加入CuSO4溶液,过滤、洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成______ (填离子符号)。
(6)甲同学取少量 溶于水,滴加几滴酸性KMnO4溶液,振荡,溶液褪色;再滴加BaCl2和盐酸溶液,产生白色沉淀。
溶于水,滴加几滴酸性KMnO4溶液,振荡,溶液褪色;再滴加BaCl2和盐酸溶液,产生白色沉淀。
①乙同学认为甲同学的实验不能证明生成了 ,理由是
,理由是______________ 。
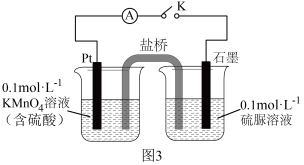
②乙同学设计如图3装置验证氧化产物中含有 。
。_____________ ,经检验石墨电极附近还有N2和CO2生成,每生成1 mol N2,电路中转移的电子数为______  。
。
 是一种杀菌剂。某小组设计实验制备硫脲并探究其性质。
是一种杀菌剂。某小组设计实验制备硫脲并探究其性质。实验(一):制备硫脲。装置如图1所示(加热装置已省略)。
已知:①
 ;
;②25℃时硫脲溶解度为14.2 g/100 g水;
③实验室常用FeS与稀H2SO4在常温下制H2S。

a.直接用酒精灯加热
b.油浴加热(100~250℃)
c.热水浴加热
(2)当C装置中出现
 。
。(3)实验发现,硫脲产率与投料比{
 }的关系如图2所示。
}的关系如图2所示。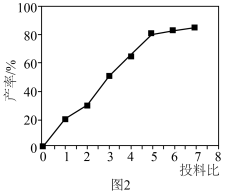
实验(二):探究硫脲的性质。
资料显示:①150℃时
 转化成NH4SCN。
转化成NH4SCN。②酸性KMnO4溶液和硫脲反应,还原产物为
 ,氧化产物为N2和
,氧化产物为N2和 。
。(4)取少量
 溶于水,加热至150℃,一段时间后再冷却至室温时,滴加
溶于水,加热至150℃,一段时间后再冷却至室温时,滴加 生成。
生成。(5)取少量
 溶于NaOH溶液,加入CuSO4溶液,过滤、洗涤,得到黑色固体,由此推知,
溶于NaOH溶液,加入CuSO4溶液,过滤、洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成(6)甲同学取少量
 溶于水,滴加几滴酸性KMnO4溶液,振荡,溶液褪色;再滴加BaCl2和盐酸溶液,产生白色沉淀。
溶于水,滴加几滴酸性KMnO4溶液,振荡,溶液褪色;再滴加BaCl2和盐酸溶液,产生白色沉淀。①乙同学认为甲同学的实验不能证明生成了
 ,理由是
,理由是②乙同学设计如图3装置验证氧化产物中含有
 。
。
 。
。
您最近一年使用:0次
解题方法
6 . 氯化铁常用于生物和矿物分析,可作为诊断试剂。某小组制备无水 并探究其性质。
并探究其性质。
实验(一)制备无水 。
。
资料显示:亚硫酰氯 沸点为
沸点为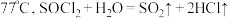 。
。
操作:将 和适量
和适量 混合共热制备无水
混合共热制备无水 ,装置如图所示。
,装置如图所示。_____ (填物质名称)。
(2)写出足量 和
和 反应的化学方程式:
反应的化学方程式:_____ 。
(3)反应完成后,取少量烧瓶中固体溶于蒸馏水中,滴加 溶液,产生蓝色沉淀,简要分析其原因:
溶液,产生蓝色沉淀,简要分析其原因:_____ 。
实验(二)测定 和
和 反应的热效应。
反应的热效应。
配制 溶液:取一定量
溶液:取一定量 固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
(4)浓盐酸的作用是_____ 。
(5)某小组设计两种方案测定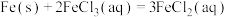
 。
。
方案1:直接法
取 溶液和
溶液和 反应,测量反应前、后溶液的温度计算反应热。
反应,测量反应前、后溶液的温度计算反应热。
方案2:间接法
分别测定
 和
和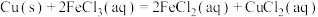
 ,利用盖斯定律计算反应热。
,利用盖斯定律计算反应热。
其中,方案_____ (填“1”或“2”)不可靠,原因是_____ 。
实验(三)探究 和
和 的反应。
的反应。
【查阅资料】 的氧化性大于
的氧化性大于 。
。
【提出假设】 和
和 的反应存在可逆性。
的反应存在可逆性。
【设计实验】如图所示。
(6)
_____ (填“>”“<”或“=”)0.上述实验说明,改变_____ 使反应向逆反应方向进行。
 并探究其性质。
并探究其性质。实验(一)制备无水
 。
。资料显示:亚硫酰氯
 沸点为
沸点为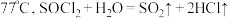 。
。操作:将
 和适量
和适量 混合共热制备无水
混合共热制备无水 ,装置如图所示。
,装置如图所示。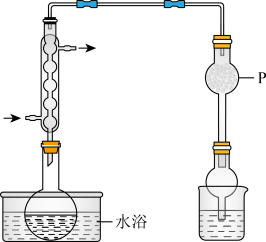
(2)写出足量
 和
和 反应的化学方程式:
反应的化学方程式:(3)反应完成后,取少量烧瓶中固体溶于蒸馏水中,滴加
 溶液,产生蓝色沉淀,简要分析其原因:
溶液,产生蓝色沉淀,简要分析其原因:实验(二)测定
 和
和 反应的热效应。
反应的热效应。配制
 溶液:取一定量
溶液:取一定量 固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
固体溶于浓盐酸中,加蒸馏水稀释至指定体积。(4)浓盐酸的作用是
(5)某小组设计两种方案测定
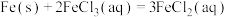
 。
。方案1:直接法
取
 溶液和
溶液和 反应,测量反应前、后溶液的温度计算反应热。
反应,测量反应前、后溶液的温度计算反应热。方案2:间接法
分别测定

 和
和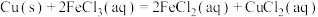
 ,利用盖斯定律计算反应热。
,利用盖斯定律计算反应热。其中,方案
实验(三)探究
 和
和 的反应。
的反应。【查阅资料】
 的氧化性大于
的氧化性大于 。
。【提出假设】
 和
和 的反应存在可逆性。
的反应存在可逆性。【设计实验】如图所示。
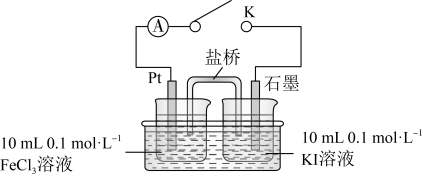
| 步骤 | 操作及现象 | 记录 |
| Ⅰ | 按装置图装好试剂,关闭 ,发现电流计指针向左偏转 ,发现电流计指针向左偏转 | 电流强度 为 为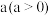 |
| Ⅱ | 一段时间后,电流计指针慢慢回归原位 | 指针回归至原位时,电流强度 为 为 |
| Ⅲ | 再向左烧杯里加入 浓溶液,电流计指针向右偏转 浓溶液,电流计指针向右偏转 | 电流强度 为 为 |
(6)

您最近一年使用:0次
名校
7 . 元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。
Ⅰ.上图是元素周期表的一部分,回答下列问题:
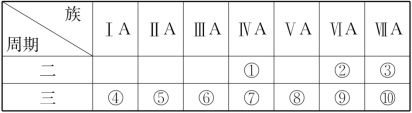
(1)⑧所对应的元素在周期表中的位置_______ 。
(2)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质的电子式_______ 。
(3)写出⑤的最高价氧化物对应的水化物与⑦的最高价氧化物反应的化学方程式_______ 。
(4)比较④与⑨的简单气态氢化物的稳定性_______>_______(填化学式)。______
Ⅱ.某小组为探究 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
(5)实验①中反应的离子方程式是_______ 。
(6)实验②观察到的现象是_______ ,甲同学根据此现象得出结论:氧化性 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是_______ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)⑧所对应的元素在周期表中的位置
(2)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质的电子式
(3)写出⑤的最高价氧化物对应的水化物与⑦的最高价氧化物反应的化学方程式
(4)比较④与⑨的简单气态氢化物的稳定性_______>_______(填化学式)。
Ⅱ.某小组为探究
 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 序号 | 实验① | 实验② |
| 实验操作 | 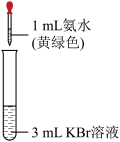 |  |
| 现象 | 溶液变为黄色 | _______ |
(6)实验②观察到的现象是
 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是
您最近一年使用:0次
2023-02-10更新
|
129次组卷
|
2卷引用:陕西省西安国际港务区铁一中陆港高级中学2023-2024学年高一上学期期末化学试题
名校
8 . 化学是以实验为基础的学科。下列根据实验操作和现象能得到相应结论的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向麦芽糖溶液中加入少量稀硫酸,加热,滴加NaOH溶液调至呈碱性,再加入银氨溶液,水浴加热,可观察到产生银镜 | 麦芽糖水解产物具有还原性 |
| B | 常温下,向 溶液中加入 溶液中加入 溶液,将带火星的木条放在试管口,木条复燃 溶液,将带火星的木条放在试管口,木条复燃 | 氧化性: |
| C | 向2mL 0.01 KI溶液中加入5mL 0.01 KI溶液中加入5mL 0.01  溶液,溶液呈棕黄色,再滴加几滴KSCN溶液,溶液变为红色 溶液,溶液呈棕黄色,再滴加几滴KSCN溶液,溶液变为红色 |  和 和 的反应存在限度 的反应存在限度 |
| D | 向2mL0.1  KCl溶液中先滴加4滴0.1 KCl溶液中先滴加4滴0.1  溶液,再滴加4滴0.1 溶液,再滴加4滴0.1 KI溶液,先产生白色沉淀,再产生黄色沉淀 KI溶液,先产生白色沉淀,再产生黄色沉淀 | AgCl转化为AgI,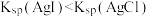 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-20更新
|
539次组卷
|
3卷引用:2024届陕西省西安市第一中学高三下学期第十次模拟考试理综试题-高中化学
名校
解题方法
9 . 实验小组制备高铁酸钾(K2FeO4) 并探究其性质。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
I. 制备K2FeO4 (夹持装置略)_____ 。
(2)装置B的作用是除杂,所用试剂为______ 。
(3)C中得到紫色固体和溶液。C中主要反应的化学方程式为:____ ,此反应表明:氧化性Cl2____  (填“>”或“<”)。
(填“>”或“<”)。
(4)C中除了发生(3)中的反应,还可能发生的化学反应(离子方程式):_____ 。
II. 探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
(5)此实验可证明氧化Cl-的物质只能是 。用KOH溶液洗涤的目的是
。用KOH溶液洗涤的目的是_____ 。
(6)此实验得出Cl2和 的氧化性强弱关系与制备实验时得出的结论相反,原因是
的氧化性强弱关系与制备实验时得出的结论相反,原因是___ 。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
I. 制备K2FeO4 (夹持装置略)
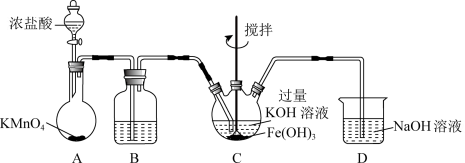
(2)装置B的作用是除杂,所用试剂为
(3)C中得到紫色固体和溶液。C中主要反应的化学方程式为:
 (填“>”或“<”)。
(填“>”或“<”)。(4)C中除了发生(3)中的反应,还可能发生的化学反应(离子方程式):
II. 探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
(5)此实验可证明氧化Cl-的物质只能是
 。用KOH溶液洗涤的目的是
。用KOH溶液洗涤的目的是(6)此实验得出Cl2和
 的氧化性强弱关系与制备实验时得出的结论相反,原因是
的氧化性强弱关系与制备实验时得出的结论相反,原因是
您最近一年使用:0次
2020-10-24更新
|
726次组卷
|
3卷引用:陕西省西安市蓝田县城关中学大学区联考2023-2024学年高一上学期1月期末化学试题
10 . I.1869年俄国科学家门捷列夫绘制出了第一张元素周期表,成为化学史上的里程碑之一,且大大地促进了化学学科的快速发展。下表是现代元素周期表的一部分,请据表回答下列问题:_______ (任写一种)。
(2)请写出元素⑦的氧化物与元素③的氢化物的水溶液反应的化学方程式_______ 。
(3)元素①和元素⑦最高价氧化物的水化物中酸性较强的是_______ (填化学式)。
II.硅是地壳中含量第二大的元素,其单质是一种重要的半导体材料。
(4)硅元素在自然界中通常以石英石 和硅酸盐的形式存在。已知
和硅酸盐的形式存在。已知 是一种酸性氧化物,请写出其与氢氧化钠溶液反应的化学方程式
是一种酸性氧化物,请写出其与氢氧化钠溶液反应的化学方程式_______ 。 的SiO2中含有Si-O键
的SiO2中含有Si-O键_______ 个。
(5)高纯硅单质可由石英砂(主要成分是 )制得,制备高纯硅的主要工艺流程如图所示:
)制得,制备高纯硅的主要工艺流程如图所示:_______ ;
ii.流程①焦炭体现了_______ (填“氧化性”或“还原性”);
iii.由于硅酸盐组成比较复杂,通常用氧化物的形式表示:请用氧化物的形式表示钾云母K(Al3Si3O10)(OH)2的组成_______ 。
(2)请写出元素⑦的氧化物与元素③的氢化物的水溶液反应的化学方程式
(3)元素①和元素⑦最高价氧化物的水化物中酸性较强的是
II.硅是地壳中含量第二大的元素,其单质是一种重要的半导体材料。
(4)硅元素在自然界中通常以石英石
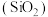 和硅酸盐的形式存在。已知
和硅酸盐的形式存在。已知 是一种酸性氧化物,请写出其与氢氧化钠溶液反应的化学方程式
是一种酸性氧化物,请写出其与氢氧化钠溶液反应的化学方程式 的SiO2中含有Si-O键
的SiO2中含有Si-O键(5)高纯硅单质可由石英砂(主要成分是
 )制得,制备高纯硅的主要工艺流程如图所示:
)制得,制备高纯硅的主要工艺流程如图所示:
ii.流程①焦炭体现了
iii.由于硅酸盐组成比较复杂,通常用氧化物的形式表示:请用氧化物的形式表示钾云母K(Al3Si3O10)(OH)2的组成
您最近一年使用:0次