名校
解题方法
1 . 黄铁矿(主要成分FeS2)在空气中会被缓慢氧化,过程如图所示。下列说法正确的是

| A.发生反应a时,每0.2molFeS2被还原,转移2.8mole- |
B.25℃时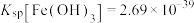 ,则该温度下d的逆反应平衡常数 ,则该温度下d的逆反应平衡常数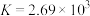 |
C.c发生反应的离子方程式为: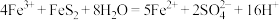 |
| D.黄铁矿是工业制备硫酸的必选原料 |
您最近一年使用:0次
2024-05-22更新
|
202次组卷
|
3卷引用:辽宁省部分高中期中联考2023-2024学年高三下学期5月期中考试化学试题
辽宁省部分高中期中联考2023-2024学年高三下学期5月期中考试化学试题 辽宁省部分高中2023-2024学年高三下学期第三次模拟考试化学试题(已下线)湖南师大附中2024届高三下学期第三次模拟考试化学试题
名校
解题方法
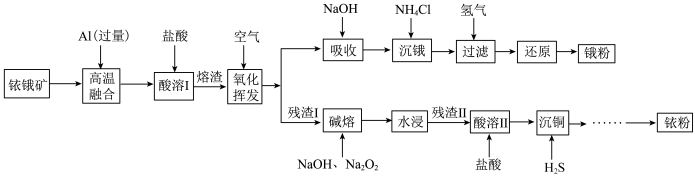
2 . 铱(77Ir)和锇(76Os)属于铂族金属,与金、银合称贵重金属,可以用于电气、精密仪表、催化剂等领域。铱锇矿的主要成分有Ir、Os、Ir2O3、OsO2,还含有CuO和SiO2等杂质,从铱锇矿中提取铱和锇的流程如下:
回答下列问题:
(1)“酸溶I”的目的是___________ ;酸溶I后溶渣的主要成分除Ir、Os外,还有___________ (填化学式)。
(2)“氧化挥发”是将溶渣置于300~800℃的管式炉内,通入空气氧化。再用NaOH溶液吸收OsO4生成Na2OsO4,该反应的离子方程式为___________ 。
(3)“沉锇”时,NH4Cl与Na2OsO4发生反应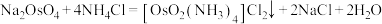 ,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是
,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是___________ 。
(4)“碱熔”时,“残渣I”中的Ir与Na2O2反应生成IrO2·nNa2O和O2,该反应的化学方程式为___________ 。
(5)“沉铜”过程中,当通入H2S达到饱和时测得溶液的pH=1,此时溶液中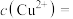
___________ mol/L。[已知:25℃,H2S溶于水形成饱和溶液时, ;H2S的电离常数
;H2S的电离常数 ,
,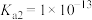 ;
;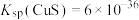 ]
]
(6)化合物 IrO2的四方晶格结构如图所示,其棱边夹角均为90°。已知IrO2晶体密度为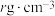 ,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为
,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为___________ (用代数式表示)g/mol。
回答下列问题:
(1)“酸溶I”的目的是
(2)“氧化挥发”是将溶渣置于300~800℃的管式炉内,通入空气氧化。再用NaOH溶液吸收OsO4生成Na2OsO4,该反应的离子方程式为
(3)“沉锇”时,NH4Cl与Na2OsO4发生反应
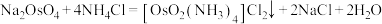 ,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是
,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是(4)“碱熔”时,“残渣I”中的Ir与Na2O2反应生成IrO2·nNa2O和O2,该反应的化学方程式为
(5)“沉铜”过程中,当通入H2S达到饱和时测得溶液的pH=1,此时溶液中
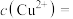
 ;H2S的电离常数
;H2S的电离常数 ,
,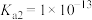 ;
;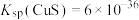 ]
](6)化合物 IrO2的四方晶格结构如图所示,其棱边夹角均为90°。已知IrO2晶体密度为
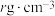 ,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为
,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为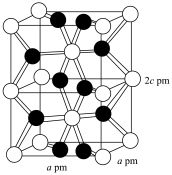
您最近一年使用:0次
2024-05-21更新
|
225次组卷
|
3卷引用:辽宁省部分高中期中联考2023-2024学年高三下学期5月期中考试化学试题
3 . 已知反应: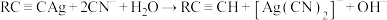 ,该反应可用于提纯炔烃。下列说法错误的是
,该反应可用于提纯炔烃。下列说法错误的是
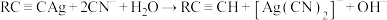 ,该反应可用于提纯炔烃。下列说法错误的是
,该反应可用于提纯炔烃。下列说法错误的是A. 的电子式为 的电子式为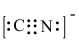 |
B.基态O原子的价电子排布图为 |
C. 的空间填充模型为 的空间填充模型为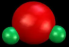 |
D.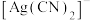 中 中 键与 键与 键的个数比为1:2 键的个数比为1:2 |
您最近一年使用:0次
2024-05-20更新
|
236次组卷
|
3卷引用:辽宁省部分高中期中联考2023-2024学年高三下学期5月期中考试化学试题
名校
解题方法
4 .  是一种高效多功能的绿色消毒剂和水处理剂。但是由于存在自催化现象[即分解产物
是一种高效多功能的绿色消毒剂和水处理剂。但是由于存在自催化现象[即分解产物 可催化高铁酸盐的分解],限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解],限制了它的大规模应用,研究使其稳定的方法尤为关键。
已知:①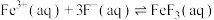
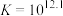
②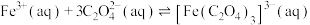

I.制备高铁酸盐
(1)在碱性条件下以多孔的磁铁矿作阳极电解制备高铁酸盐的电极反应式是___________ 。
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的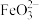 ,此过程的反应为
,此过程的反应为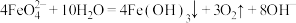 、
、___________ 。
为研究使稳定的方法,分别做以下4个实验:
资料:吸光度大小与溶液中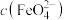 成正比。
成正比。___________ ,但吸光度结果图显示甲同学预测并不正确,原因可能是d试管加入的 与
与 发生配位反应的速率
发生配位反应的速率___________ (填“快”或“慢”),且进行程度大,导致催化剂 量减少,
量减少, 的分解速率
的分解速率___________ (填“快”或“慢”)。
(4)乙同学推测“ ”曲线为试管c的实验结果,依据是
”曲线为试管c的实验结果,依据是___________ 。
(5)综合以上分析,为增强高铁酸盐的稳定性,可向其中加入___________ (填化学式)。
Ⅲ.高铁酸盐产品纯度的测定
称取mg高铁酸钾粗品,配成250mL溶液,准确量取25.00mL放入锥形瓶,加入足量 和NaOH溶液,振荡,再加入稀硫酸酸化后得到
和NaOH溶液,振荡,再加入稀硫酸酸化后得到 和
和 ,滴入几滴二苯胺磺酸钠作指示剂,用
,滴入几滴二苯胺磺酸钠作指示剂,用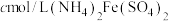 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液VmL。
标准溶液VmL。
(6)粗品中 的质量分数为
的质量分数为___________ 。[已知: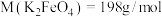 ]
]
 是一种高效多功能的绿色消毒剂和水处理剂。但是由于存在自催化现象[即分解产物
是一种高效多功能的绿色消毒剂和水处理剂。但是由于存在自催化现象[即分解产物 可催化高铁酸盐的分解],限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解],限制了它的大规模应用,研究使其稳定的方法尤为关键。已知:①
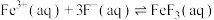
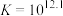
②
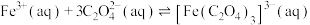

I.制备高铁酸盐
(1)在碱性条件下以多孔的磁铁矿作阳极电解制备高铁酸盐的电极反应式是
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的
 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的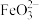 ,此过程的反应为
,此过程的反应为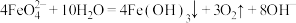 、
、为研究使稳定的方法,分别做以下4个实验:
| 序号 |  | 现象 | |
| a | 2滴0.01mol/LKI溶液 | 紫色迅速褪去 |
| b | 2滴蒸馏水 | 分别用紫外可见分光光度计测三支试管内溶液的吸光度,结果如下图所示。 | |
| c | 2滴0.01mol/LNaF溶液 | ||
| d | 2滴 溶液 溶液 |
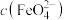 成正比。
成正比。
 与
与 发生配位反应的速率
发生配位反应的速率 量减少,
量减少, 的分解速率
的分解速率(4)乙同学推测“
 ”曲线为试管c的实验结果,依据是
”曲线为试管c的实验结果,依据是(5)综合以上分析,为增强高铁酸盐的稳定性,可向其中加入
Ⅲ.高铁酸盐产品纯度的测定
称取mg高铁酸钾粗品,配成250mL溶液,准确量取25.00mL放入锥形瓶,加入足量
 和NaOH溶液,振荡,再加入稀硫酸酸化后得到
和NaOH溶液,振荡,再加入稀硫酸酸化后得到 和
和 ,滴入几滴二苯胺磺酸钠作指示剂,用
,滴入几滴二苯胺磺酸钠作指示剂,用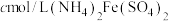 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液VmL。
标准溶液VmL。(6)粗品中
 的质量分数为
的质量分数为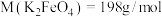 ]
]
您最近一年使用:0次
2024-05-20更新
|
216次组卷
|
3卷引用:辽宁省部分高中期中联考2023-2024学年高三下学期5月期中考试化学试题
名校
解题方法
5 . 下列化学反应与相应的离子(或化学)方程式不相符的是
A.AgCl沉淀溶于氨水: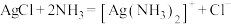 |
B.将过量 通入冷氨水中: 通入冷氨水中: |
C.用盐酸处理铜器表面的铜锈: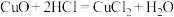 |
D.氯水中加入小苏打提高漂白性: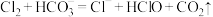 |
您最近一年使用:0次
2024-05-20更新
|
228次组卷
|
3卷引用:辽宁省部分高中期中联考2023-2024学年高三下学期5月期中考试化学试题
6 . 设 代表阿伏加德罗常数的值。下列说法正确的是
代表阿伏加德罗常数的值。下列说法正确的是
 代表阿伏加德罗常数的值。下列说法正确的是
代表阿伏加德罗常数的值。下列说法正确的是A. 中含有 中含有 个离子 个离子 |
B.常温常压下, 与足量 与足量 溶液反应生成气体的分子数为0.15 溶液反应生成气体的分子数为0.15 |
C.标准状况下,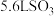 中含硫原子数为 中含硫原子数为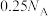 |
D. 的 的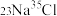 溶液中的中子数为 溶液中的中子数为 |
您最近一年使用:0次
名校
7 . 根据下列实验操作及现象,一定能推出相应结论的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某盐与盐酸反应产生的气体通入澄清石灰水中 | 澄清石灰水先变浑浊,一段时间后变澄清 | 该盐为碳酸盐 |
| B | 向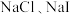 的混合稀溶液中滴入少量稀 的混合稀溶液中滴入少量稀 溶液 溶液 | 有黄色沉淀生成 | 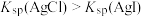 |
| C | 将氧气通入氢硫酸溶液中 | 溶液变浑浊 | 非金属性: |
| D | 将 加入 加入 溶液中 溶液中 | 有无色气泡产生 |  具有氧化性 具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
8 .  与
与 溶液反应的化学方程式为
溶液反应的化学方程式为 。下列说法正确的是
。下列说法正确的是
 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为 。下列说法正确的是
。下列说法正确的是A.基态 原子中含有2个未成对电子 原子中含有2个未成对电子 |
B.每生成 转移电子数为 转移电子数为 |
C.常温下,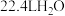 中心原子上含有的孤电子对数是 中心原子上含有的孤电子对数是 |
D. 中的中心离子是 中的中心离子是 ,配位数为3 ,配位数为3 |
您最近一年使用:0次
名校
9 . 下列化学用语或表述正确的是
A. 分子的VSEPR模型: 分子的VSEPR模型: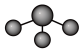 |
B. 的形成主要是通过共用电子对 的形成主要是通过共用电子对 |
C. 中的共价键类型是非极性键 中的共价键类型是非极性键 |
D.基态碳原子核外电子轨道表示式: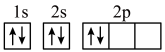 |
您最近一年使用:0次
名校
解题方法
10 . 碲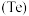 广泛用于航空航天和电子领域。以含碲废料(主要成分为
广泛用于航空航天和电子领域。以含碲废料(主要成分为 ,含少量
,含少量 和
和 等)为原料回收碲和贵重金属的流程如下:
等)为原料回收碲和贵重金属的流程如下: 是酸性氧化物,难溶于水,具有强还原性。②
是酸性氧化物,难溶于水,具有强还原性。②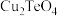 难溶于水。③碲酸稳定,不能与硫酸亚铁铵反应。
难溶于水。③碲酸稳定,不能与硫酸亚铁铵反应。
回答下列问题:
(1)已知基态 的价层电子排布式为
的价层电子排布式为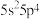 。
。 的热稳定性比
的热稳定性比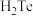 的强,其原因是
的强,其原因是___________ (从结构和键能角度分析)。
(2)“氧化1”采用“逆流操作”,其目的是___________ 。写出“氧化1”工序中主要反应的化学方程式:___________ 。
(3)“水浸”时溶质的浸出率与温度的关系如图所示,解释 点达到“峰值”的原因:
点达到“峰值”的原因:___________ ;对滤液1蒸发浓缩、降温结晶、过滤、洗涤、空气干燥得到晶体是___________ (填化学式)。 的作用是
的作用是___________ 。
(5)写出“沉碲”反应的离子方程式:___________ 。
(6)测定粗碲样品纯度。称取 粗碲,将其转化成
粗碲,将其转化成 ,配制成
,配制成 溶液。准确量取
溶液。准确量取 配制溶液于锥形瓶中,向锥形瓶中加入
配制溶液于锥形瓶中,向锥形瓶中加入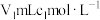 酸化的
酸化的 溶液,充分反应使亚碲酸
溶液,充分反应使亚碲酸 转化为碲酸
转化为碲酸 。加入
。加入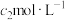 标准
标准 溶液滴定剩余的
溶液滴定剩余的 ,滴定终点恰好消耗滴定液
,滴定终点恰好消耗滴定液 (还原产物为
(还原产物为 )。该粗碲含
)。该粗碲含 的质量分数为
的质量分数为___________  。若
。若 使用之前被部分氧化,则测得结果
使用之前被部分氧化,则测得结果___________ (填“偏高”“偏低”或“无影响”)。
 广泛用于航空航天和电子领域。以含碲废料(主要成分为
广泛用于航空航天和电子领域。以含碲废料(主要成分为 ,含少量
,含少量 和
和 等)为原料回收碲和贵重金属的流程如下:
等)为原料回收碲和贵重金属的流程如下:
 是酸性氧化物,难溶于水,具有强还原性。②
是酸性氧化物,难溶于水,具有强还原性。②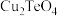 难溶于水。③碲酸稳定,不能与硫酸亚铁铵反应。
难溶于水。③碲酸稳定,不能与硫酸亚铁铵反应。回答下列问题:
(1)已知基态
 的价层电子排布式为
的价层电子排布式为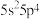 。
。 的热稳定性比
的热稳定性比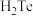 的强,其原因是
的强,其原因是(2)“氧化1”采用“逆流操作”,其目的是
(3)“水浸”时溶质的浸出率与温度的关系如图所示,解释
 点达到“峰值”的原因:
点达到“峰值”的原因:
 的作用是
的作用是(5)写出“沉碲”反应的离子方程式:
(6)测定粗碲样品纯度。称取
 粗碲,将其转化成
粗碲,将其转化成 ,配制成
,配制成 溶液。准确量取
溶液。准确量取 配制溶液于锥形瓶中,向锥形瓶中加入
配制溶液于锥形瓶中,向锥形瓶中加入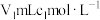 酸化的
酸化的 溶液,充分反应使亚碲酸
溶液,充分反应使亚碲酸 转化为碲酸
转化为碲酸 。加入
。加入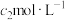 标准
标准 溶液滴定剩余的
溶液滴定剩余的 ,滴定终点恰好消耗滴定液
,滴定终点恰好消耗滴定液 (还原产物为
(还原产物为 )。该粗碲含
)。该粗碲含 的质量分数为
的质量分数为 。若
。若 使用之前被部分氧化,则测得结果
使用之前被部分氧化,则测得结果
您最近一年使用:0次




