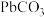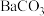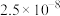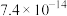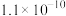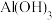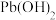1 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:

已知:最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ (填化学式)。
(2)水浸渣中主要有SiO2和___________ 。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________ 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致___________ ;pH>9时,会导致___________ 。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有___________ (填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________ 。

已知:最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)水浸渣中主要有SiO2和
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近一年使用:0次
2023-06-10更新
|
18480次组卷
|
18卷引用:2023年高考新课标理综化学真题
2023年高考新课标理综化学真题(已下线)T26-工业流程题(已下线)2023年高考化学真题完全解读(新课标卷:适用安徽、云南、山西、吉林、黑龙江五省)(PPT+Word)(已下线)专题18 工艺流程题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省滨州市2023-2024学年高三上学期11月期中考试化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建
2 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为_______ (答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸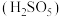 ,
, 中过氧键的数目为
中过氧键的数目为_______ 。
(3)“氧化”中,用石灰乳调节 ,
, 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ ( 的电离第一步完全,第二步微弱);滤渣的成分为
的电离第一步完全,第二步微弱);滤渣的成分为 、
、_______ (填化学式)。
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为_______ 时, (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是_______ 。
 (Ⅱ)在空气中可被氧化成
(Ⅱ)在空气中可被氧化成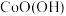 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(6)“沉镁”中为使 沉淀完全
沉淀完全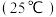 ,需控制
,需控制 不低于
不低于_______ (精确至0.1)。
 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。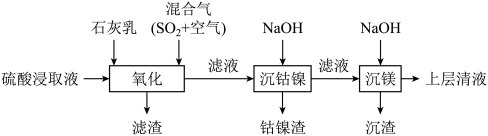
| 物质 |  |  |  |  |
 |  | 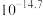 | 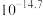 | 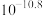 |
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸
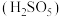 ,
, 中过氧键的数目为
中过氧键的数目为(3)“氧化”中,用石灰乳调节
 ,
, 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱);滤渣的成分为
的电离第一步完全,第二步微弱);滤渣的成分为 、
、(4)“氧化”中保持空气通入速率不变,
 (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为 (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是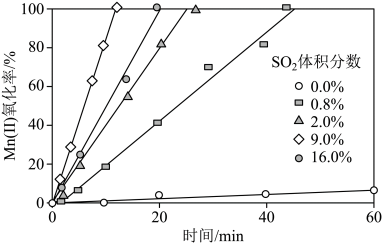
 (Ⅱ)在空气中可被氧化成
(Ⅱ)在空气中可被氧化成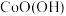 ,该反应的化学方程式为
,该反应的化学方程式为(6)“沉镁”中为使
 沉淀完全
沉淀完全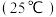 ,需控制
,需控制 不低于
不低于
您最近一年使用:0次
2023-06-13更新
|
12077次组卷
|
20卷引用:2023年高考辽宁卷化学真题
2023年高考辽宁卷化学真题(已下线)测试辽宁化学 请勿下载(已下线)T16-工业流程题(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)专题18 工艺流程题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)江苏省华罗庚中学2023-2024学年高三夏令营学习能力测试化学试题山西省三重教育联盟2023-2024学年高三上学期9月联考化学试题四川省成都市第七中学2023-2024学年高三上学期入学考试理综化学试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省镇江市丹阳市吕叔湘中学2023-2024学年高三上学期10月月考化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题辽宁省葫芦岛市第一高级中学2023-2024学年高二上学期化学期末复习提升卷福建泉州科技中学2022-2023学年高二下学期期末考化学试题甘肃省白银市会宁县第四中学2023-2024学年高三上学期第三次月考化学试题
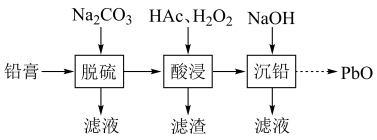
3 . 废旧铅蓄电池的铅膏中主要含有 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
一定条件下,一些金属氢氧化物沉淀时的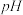 如下表:
如下表:
回答下列问题:
(1)在“脱硫”中 转化反应的离子方程式为
转化反应的离子方程式为________ ,用沉淀溶解平衡原理解释选择 的原因
的原因________ 。
(2)在“脱硫”中,加入 不能使铅膏中
不能使铅膏中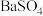 完全转化,原因是
完全转化,原因是________ 。
(3)在“酸浸”中,除加入醋酸(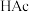 ),还要加入
),还要加入 。
。
(ⅰ)能被 氧化的离子是
氧化的离子是________ ;
(ⅱ) 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为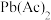 ,其化学方程式为
,其化学方程式为________ ;
(ⅲ) 也能使
也能使 转化为
转化为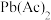 ,
, 的作用是
的作用是________ 。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是________ 。
(5)“沉铅”的滤液中,金属离子有________ 。
 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质 |
|
|
|
|
|
|
|
|
|
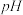 如下表:
如下表:金属氢氧化物 |
|
|
|
|
开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
(1)在“脱硫”中
 转化反应的离子方程式为
转化反应的离子方程式为 的原因
的原因(2)在“脱硫”中,加入
 不能使铅膏中
不能使铅膏中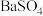 完全转化,原因是
完全转化,原因是(3)在“酸浸”中,除加入醋酸(
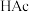 ),还要加入
),还要加入 。
。(ⅰ)能被
 氧化的离子是
氧化的离子是(ⅱ)
 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为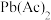 ,其化学方程式为
,其化学方程式为(ⅲ)
 也能使
也能使 转化为
转化为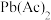 ,
, 的作用是
的作用是(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是
(5)“沉铅”的滤液中,金属离子有
您最近一年使用:0次
2022-06-09更新
|
25349次组卷
|
27卷引用:2022年高考全国乙卷化学真题
2022年高考全国乙卷化学真题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)专题15 工艺流程综合题-备战2023年高考化学母题题源解密(全国通用)(已下线)易错点26 沉淀溶解平衡-备战2023年高考化学考试易错题河北省石家庄市第二中学2022-2023学年高二上学期10月月考化学试题云南省昭通市昭阳区第二中学2021-2022学年高二下学期期末考试化学试题(已下线)热点情景汇编-专题十 工艺流程中的新工艺山东省威海乳山市银滩高级中学2022-2023学年高二12月月考化学试题福建省2022-2023学年高三上学期化学1月质检考前模拟试题第二部分 热点专项突破——解题能力稳提升 专项3 结合理论的综合类工艺流程(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 大题突破3 无机化工流程题题型研究(已下线)题型140 沉淀溶解平衡的应用北京市顺义区第一中学2023届高三下学期2月月考化学试题(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)回归教材重难点04 “9种”物质的性质及应用-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题福建省漳州市华安县第一中学2023-2024学年高三上学期开学考试化学试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)微专题 无机化工流程题的解题策略(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)河南省驻马店市“逐梦计划”大联考2023-2024学年高二上学期12月期末考试化学试题
真题
解题方法
4 .  是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
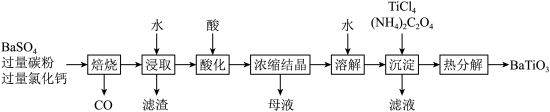
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是_______ 。
(2)“焙烧”后固体产物有 、易溶于水的
、易溶于水的 和微溶于水的
和微溶于水的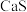 。“浸取”时主要反应的离子方程式为
。“浸取”时主要反应的离子方程式为_______ 。
(3)“酸化”步骤应选用的酸是_______ (填标号)。
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?_______ ,其原因是_______ 。
(5)“沉淀”步骤中生成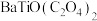 的化学方程式为
的化学方程式为_______ 。
(6)“热分解”生成粉状钛酸钡,产生的
_______ 。
 是一种压电材料。以
是一种压电材料。以 为原料,采用下列路线可制备粉状
为原料,采用下列路线可制备粉状 。
。
回答下列问题:
(1)“焙烧”步骤中碳粉的主要作用是
(2)“焙烧”后固体产物有
 、易溶于水的
、易溶于水的 和微溶于水的
和微溶于水的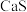 。“浸取”时主要反应的离子方程式为
。“浸取”时主要反应的离子方程式为(3)“酸化”步骤应选用的酸是
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
(4)如果焙烧后的产物直接用酸浸取,是否可行?
(5)“沉淀”步骤中生成
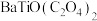 的化学方程式为
的化学方程式为(6)“热分解”生成粉状钛酸钡,产生的
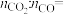
您最近一年使用:0次
2023-06-09更新
|
13960次组卷
|
12卷引用:2023年高考全国甲卷化学真题
2023年高考全国甲卷化学真题(已下线)T26-工业流程题(已下线)2023年高考化学真题完全解读(全国甲卷)(ppt+word)(已下线)专题18 工艺流程题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建
5 . 盐湖卤水(主要含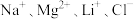 、
、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如下:
的工艺流程如下: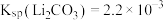 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。
(1)含硼固体中的 在水中存在平衡:
在水中存在平衡: (常温下,
(常温下,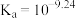 );
); 与
与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中, 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为_____ ,该溶液
_____ 。
(2)滤渣Ⅰ的主要成分是_____ (填化学式);精制Ⅰ后溶液中 的浓度为
的浓度为 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在_____  以下。若脱硼后直接进行精制Ⅰ,除无法回收
以下。若脱硼后直接进行精制Ⅰ,除无法回收 外,还将增加
外,还将增加_____ 的用量(填化学式)。
(3)精制Ⅱ的目的是_____ ;进行操作 时应选择的试剂是
时应选择的试剂是_____ ,若不进行该操作而直接浓缩,将导致_____ 。
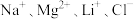 、
、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如下:
的工艺流程如下: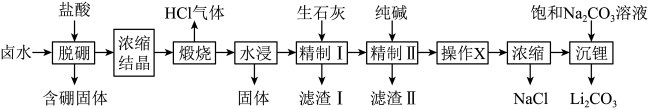
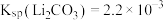 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。
(1)含硼固体中的
 在水中存在平衡:
在水中存在平衡: (常温下,
(常温下,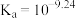 );
); 与
与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中, 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为
(2)滤渣Ⅰ的主要成分是
 的浓度为
的浓度为 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在 以下。若脱硼后直接进行精制Ⅰ,除无法回收
以下。若脱硼后直接进行精制Ⅰ,除无法回收 外,还将增加
外,还将增加(3)精制Ⅱ的目的是
 时应选择的试剂是
时应选择的试剂是
您最近一年使用:0次
2023-06-19更新
|
8797次组卷
|
11卷引用:2023年高考山东卷化学真题
2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)福建省泉州市培元中学2023-2024学年高三上学期12月月考化学试题(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建(已下线)FHgkyldyjhx04
真题
解题方法
6 . 某工厂采用辉铋矿(主要成分为 ,含有
,含有 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制各
)联合焙烧法制各 和
和 ,工艺流程如下:
,工艺流程如下:
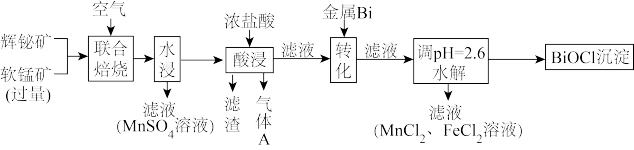
已知:①焙烧时过量的 分解为
分解为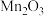 ,
, 转变为
转变为 ;
;
②金属活动性: ;
;
③相关金属离子形成氢氧化物的 范围如下:
范围如下:
回答下列问题:
(1)为提高焙烧效率,可采取的措施为_______ 。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2) 在空气中单独焙烧生成
在空气中单独焙烧生成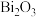 ,反应的化学方程式为
,反应的化学方程式为_______ 。
(3)“酸浸”中过量浓盐酸的作用为:①充分浸出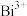 和
和 ;②
;②_______ 。
(4)滤渣的主要成分为_______ (填化学式)。
(5)生成气体A的离子方程式为_______ 。
(6)加入金属Bi的目的是_______ 。
(7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量 产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为
产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为_______ 。
 ,含有
,含有 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制各
)联合焙烧法制各 和
和 ,工艺流程如下:
,工艺流程如下:
已知:①焙烧时过量的
 分解为
分解为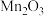 ,
, 转变为
转变为 ;
;②金属活动性:
 ;
;③相关金属离子形成氢氧化物的
 范围如下:
范围如下:开始沉淀 | 完全沉淀 | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
(1)为提高焙烧效率,可采取的措施为
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2)
 在空气中单独焙烧生成
在空气中单独焙烧生成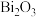 ,反应的化学方程式为
,反应的化学方程式为(3)“酸浸”中过量浓盐酸的作用为:①充分浸出
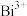 和
和 ;②
;②(4)滤渣的主要成分为
(5)生成气体A的离子方程式为
(6)加入金属Bi的目的是
(7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量
 产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为
产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为
您最近一年使用:0次
2022-09-02更新
|
10587次组卷
|
9卷引用:2022年辽宁高考真题化学试题
2022年辽宁高考真题化学试题(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编(已下线)易错点32 物质的分离、提纯与检验-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十 工艺流程中的新工艺(已下线)2022年辽宁高考真题化学试题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)河北省涞水北雄高级中学2022-2023学年高三下学期3月月考化学试题
7 . 氢气是一种清洁能源,绿色环保制氢技术研究具有重要意义。
(1)“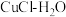 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
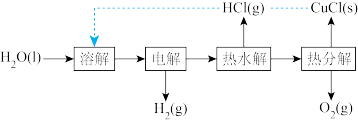
①电解在质子交换膜电解池中进行。阳极区为酸性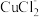 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中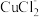 转化为
转化为 。电解时阳极发生的主要电极反应为
。电解时阳极发生的主要电极反应为_______ (用电极反应式表示)。
②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有_______ (填元素符号)。
(2)“ 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收
热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收 制得的
制得的 溶液反应,生成
溶液反应,生成 、
、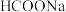 和
和 ;
; 再经生物柴油副产品转化为Fe。
再经生物柴油副产品转化为Fe。
①实验中发现,在 时,密闭容器中
时,密闭容器中 溶液与铁粉反应,反应初期有
溶液与铁粉反应,反应初期有 生成并放出
生成并放出 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
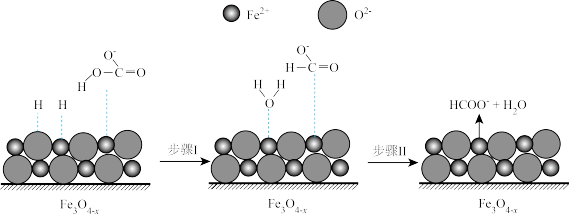
②随着反应进行, 迅速转化为活性
迅速转化为活性 ,活性
,活性 是
是 转化为
转化为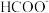 的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为_______ 。
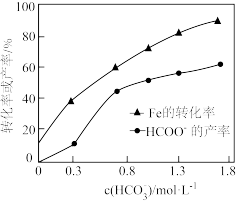
③在其他条件相同时,测得Fe的转化率、 的产率随
的产率随 变化如题图所示。
变化如题图所示。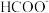 的产率随
的产率随 增加而增大的可能原因是
增加而增大的可能原因是_______ 。
(3)从物质转化与资源综合利用角度分析,“ 热循环制氢和甲酸”的优点是
热循环制氢和甲酸”的优点是_______ 。
(1)“
 热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。
①电解在质子交换膜电解池中进行。阳极区为酸性
 溶液,阴极区为盐酸,电解过程中
溶液,阴极区为盐酸,电解过程中 转化为
转化为 。电解时阳极发生的主要电极反应为
。电解时阳极发生的主要电极反应为②电解后,经热水解和热分解的物质可循环使用。在热水解和热分解过程中,发生化合价变化的元素有
(2)“
 热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收
热循环制氢和甲酸”的原理为:在密闭容器中,铁粉与吸收 制得的
制得的 溶液反应,生成
溶液反应,生成 、
、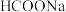 和
和 ;
; 再经生物柴油副产品转化为Fe。
再经生物柴油副产品转化为Fe。①实验中发现,在
 时,密闭容器中
时,密闭容器中 溶液与铁粉反应,反应初期有
溶液与铁粉反应,反应初期有 生成并放出
生成并放出 ,该反应的离子方程式为
,该反应的离子方程式为②随着反应进行,
 迅速转化为活性
迅速转化为活性 ,活性
,活性 是
是 转化为
转化为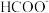 的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
的催化剂,其可能反应机理如图所示。根据元素电负性的变化规律。如图所示的反应步骤Ⅰ可描述为
③在其他条件相同时,测得Fe的转化率、
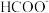 的产率随
的产率随 变化如题图所示。
变化如题图所示。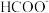 的产率随
的产率随 增加而增大的可能原因是
增加而增大的可能原因是
(3)从物质转化与资源综合利用角度分析,“
 热循环制氢和甲酸”的优点是
热循环制氢和甲酸”的优点是
您最近一年使用:0次
2022-07-21更新
|
9475次组卷
|
11卷引用:江苏省2022年普通高中学业水平选择性考试
江苏省2022年普通高中学业水平选择性考试(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编(已下线)2022年江苏卷高考真题变式题14-17(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题江苏省徐州市第七中学2022-2023学年高三上学期10月学情调研化学试题(已下线)热点情景汇编-专题十二 原理应用中的新概念(已下线)专题十一 化学能与电能-实战高考·二轮复习核心突破(已下线)江苏省2022年普通高中学业水平选择性考试变式题(原理综合题)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
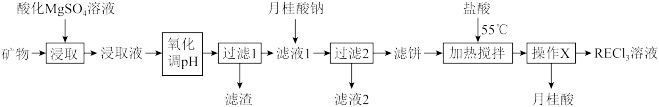
8 . 稀土(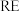 )包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸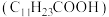 熔点为
熔点为 ;月桂酸和
;月桂酸和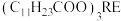 均难溶于水。该工艺条件下,稀土离子保持
均难溶于水。该工艺条件下,稀土离子保持 价不变;
价不变;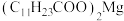 的
的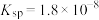 ,
, 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
(1)“氧化调pH”中,化合价有变化的金属离子是_______ 。
(2)“过滤1”前,用 溶液调pH至
溶液调pH至_______ 的范围内,该过程中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)“过滤2”后,滤饼中检测不到 元素,滤液2中
元素,滤液2中 浓度为
浓度为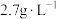 。为尽可能多地提取
。为尽可能多地提取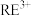 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中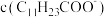 低于
低于_______  (保留两位有效数字)。
(保留两位有效数字)。
(4)①“加热搅拌”有利于加快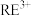 溶出、提高产率,其原因是
溶出、提高产率,其原因是_______ 。
②“操作X”的过程为:先_______ ,再固液分离。
(5)该工艺中,可再生循环利用的物质有_______ (写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂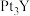 。
。
①还原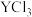 和
和 熔融盐制备
熔融盐制备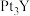 时,生成1mol
时,生成1mol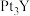 转移
转移_______  电子。
电子。
② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化
用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为
的还原,发生的电极反应为_______ 。
 )包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸
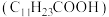 熔点为
熔点为 ;月桂酸和
;月桂酸和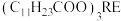 均难溶于水。该工艺条件下,稀土离子保持
均难溶于水。该工艺条件下,稀土离子保持 价不变;
价不变;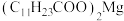 的
的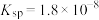 ,
, 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。| 离子 |  |  |  | 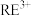 |
| 开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 4.7 | / |
(2)“过滤1”前,用
 溶液调pH至
溶液调pH至 发生反应的离子方程式为
发生反应的离子方程式为(3)“过滤2”后,滤饼中检测不到
 元素,滤液2中
元素,滤液2中 浓度为
浓度为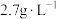 。为尽可能多地提取
。为尽可能多地提取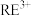 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中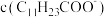 低于
低于 (保留两位有效数字)。
(保留两位有效数字)。(4)①“加热搅拌”有利于加快
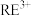 溶出、提高产率,其原因是
溶出、提高产率,其原因是②“操作X”的过程为:先
(5)该工艺中,可再生循环利用的物质有
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂
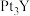 。
。①还原
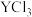 和
和 熔融盐制备
熔融盐制备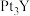 时,生成1mol
时,生成1mol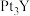 转移
转移 电子。
电子。②
 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化
用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为
的还原,发生的电极反应为
您最近一年使用:0次
2022-06-10更新
|
13523次组卷
|
17卷引用:2022年新高考广东化学高考真题
2022年新高考广东化学高考真题(已下线)2022年广东卷高考真题变式题(17-21)(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编福建省厦门集美中学2022-2023学年高三上学期期中考试化学试题第二部分 热点专项突破——解题能力稳提升专项2 物质提纯类的工艺流程(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)云南省丽江市古城区第一中学2022-2023学年高三下学期3月月考化学试题北京市第八十中学2023届高三下学期二模适应考试化学试题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题四川省仁寿第一中学校南校区2023-2024学年高三上学期11月期中考试理综化学试题(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建
真题
解题方法
9 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
的一种制备方法如下图所示: 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为_______ ,生成的沉淀与硝酸反应,生成_______ 后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为_______ ;若反应物用量比 时,氧化产物为
时,氧化产物为_______ ;当 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是_______ 。
(2)以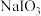 为原料制备
为原料制备 的方法是:先向
的方法是:先向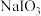 溶液中加入过量的
溶液中加入过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入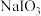 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应的离子方程式为
的总反应的离子方程式为_______ 。
(3) 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成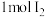 ,消耗的
,消耗的 至少为
至少为_______  。
。 在
在 溶液中可发生反应
溶液中可发生反应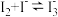 。实验室中使用过量的
。实验室中使用过量的 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是_______ 。
(1)
 的一种制备方法如下图所示:
的一种制备方法如下图所示: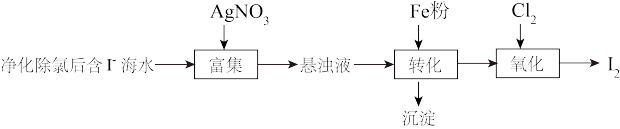
 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为②通入
 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为 时,氧化产物为
时,氧化产物为 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是(2)以
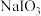 为原料制备
为原料制备 的方法是:先向
的方法是:先向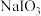 溶液中加入过量的
溶液中加入过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入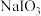 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应的离子方程式为
的总反应的离子方程式为(3)
 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成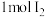 ,消耗的
,消耗的 至少为
至少为 。
。 在
在 溶液中可发生反应
溶液中可发生反应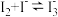 。实验室中使用过量的
。实验室中使用过量的 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是
您最近一年使用:0次
2021-06-11更新
|
20189次组卷
|
28卷引用:2021年高考全国甲卷化学真题
2021年高考全国甲卷化学真题(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(二)陌生化学方程式书写(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题天津市第一零二中学2022届高三上学期第一次月考化学试题(已下线)2021年高考全国甲卷化学试题变式题(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第10讲 氯及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)微专题 陌生情景中反应方程式的书写(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第2讲 卤素及海水提溴、提碘(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河南省济源英才学校2023-2024学年高三上学期11月月考 化学试卷云南省大理州实验中学2021-2022学年高二上学期化学期末考试题
10 .  催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为
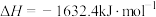 。
。
(1)催化剂的制备。将预先制备的一定量的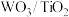 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发、焙烧等工序得到颗粒状
溶液,经蒸发、焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为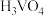 沉淀的离子方程式为
沉淀的离子方程式为___________ ;反应选用 溶液而不选用
溶液而不选用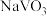 溶液的原因是
溶液的原因是___________ 。
(2)催化剂的应用。将一定物质的量浓度的NO、 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是___________ ;反应温度高于380℃,NO转化率下降,除因为进入反应器的NO被还原的量减少外,还有___________ (用化学方程式表示)。 废催化剂并制备
废催化剂并制备 的过程可表示为
的过程可表示为___________ 。
②通过萃取可分离钒和钨,在得到的钒酸中含有 。已知
。已知 具有八元环结构,其结构式可表示为
具有八元环结构,其结构式可表示为___________ 。
③向pH=8的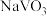 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知:
沉淀。已知: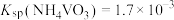 ,加过量
,加过量 溶液的目的是
溶液的目的是___________ 。
 催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为
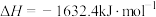 。
。(1)催化剂的制备。将预先制备的一定量的
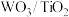 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发、焙烧等工序得到颗粒状
溶液,经蒸发、焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为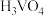 沉淀的离子方程式为
沉淀的离子方程式为 溶液而不选用
溶液而不选用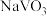 溶液的原因是
溶液的原因是(2)催化剂的应用。将一定物质的量浓度的NO、
 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是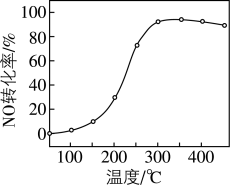
 废催化剂并制备
废催化剂并制备 的过程可表示为
的过程可表示为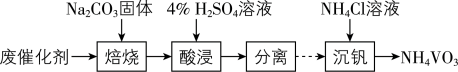
②通过萃取可分离钒和钨,在得到的钒酸中含有
 。已知
。已知 具有八元环结构,其结构式可表示为
具有八元环结构,其结构式可表示为③向pH=8的
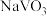 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知:
沉淀。已知: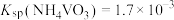 ,加过量
,加过量 溶液的目的是
溶液的目的是
您最近一年使用:0次